ФП Натрия пара-аминосалицилат (ПАСК-Nа) Natrii рага- aminosalicylas
Натриевая соль п-аминосалициловой кислоты
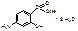
ФГ в структуре вещества: NН2 - первичная ароматическая аминогруппа, ОН - фенольный гидроксил, СООН - карбоксильная группа
Получение – синтез, источник – м-аминофенол.
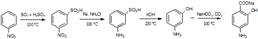
Процесс синтеза складывается из трех стадий: 1.Карбоксилирование м-аминофенола. 2.Выделение пара-аминосалициловой кислоты. 3.Получение натрия п-аминосалицилата. На первой стадии происходит карбоксилирование м-аминофенола по методу Кольбе-Шмидта (получение салициловой кислоты). На второй стадии под действием 50% серной кислоты происходит выделение ПАСК. На третьей стадииПАСК нейтрализуется гидрокарбонатом натрия и образуется ПАС-натрия.
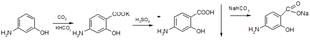
Источником синтеза может быть нитробензол:
Описание: белый или белый с желтоватым оттенком или розоватый мелкокристаллический порошок. Легко растворим в воде, растворы при стоянии темнеют. Трудно растворим в спирте.
Подлиннность
1.УФ-спектрофотометрия. УФ-спектр 0,001% водного раствора ПАСК-Nа, который имеет 2 максимума поглощения– 265нм и 299нм (свидетельствует о наличии фенольного гидроксила и ПАА). ФС Соотношение оптических плотностей при длинах волн 265 и 299 нм должно быть в пределах 1,50-1,56 (указывает на отсутствие поглощающих при данных длинах волн примесей). Величины удельных показателей поглощения при максимумах поглощения равны соответственно 736 и 483.
2. Температура плавления Т°пл=122оС.
Реакции подлинности
1. ФС Реакция на фенольный гидроксил – в кислой средес раствором хлорида железа (III): образуетсякомплексное соединение (фиолетово-красное окрашивание).
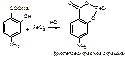
Водные растворы ПАС-натрия имеют рН 6,5-8,5, в этой среде с хлоридом железа образуется комплекс коричнево-красного цвета. Поэтому проводят подкисление разведенной хлороводородной кислотой. 2.ФС Реакция образования азокрасителя, основанная на наличии в структуре: первичной ароматической аминогруппы и фенольного гидроксила. А)В методике ФС после диазотирования раствором нитрита натрия в кислой среде проводят азосочетание с β-нафтолом в щелочной среде, появляется красное окрашивание (ЛВ диазосоставляющая):
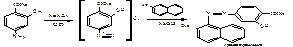
Б) в методике МФ- IIпосле диазотирования ЛВ в качестве азосоставляющей берется α-нафтиламин. Реакция проводится в кислой среде. Образуется красное окрашивание, переходящее в оранжевое при добавлении раствора гидроксида натрия (ЛВ диазосоставляющая):
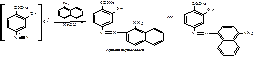
В) следующий вариант образования азокрасителя основан на наличии фенольного гидроксила.
Г) есть еще один вариант, основанный на том, что ПАС-натрия имеет в структуре одновременно ПАА и фенольный гидроксил. В щелочной среде сочетается как фенол:
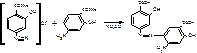 В кислой среде ПАС-натрия сочетается как амин, присоединение идет в 3-положении (пара- к ПАА).
В кислой среде ПАС-натрия сочетается как амин, присоединение идет в 3-положении (пара- к ПАА).
3.На ион натрия–окрашивает пламя горелки в желтый цветФС.
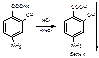 4. Реакция на карбоксильную группу – выделение свободной ПАСК(слабая к-та) из ее соли минеральной кислотой:
4. Реакция на карбоксильную группу – выделение свободной ПАСК(слабая к-та) из ее соли минеральной кислотой:
5. Реакция на карбоксильную и гидроксильную группы – с солями тяжелых металлов (с меди (II) сульфатом образует травянисто-зелёное окрашивание
Чистота 1.Прозрачность и цветность раствора, т.к. ПАС-натрия – лабильное вещество.
2.м-аминофенол (допустимая в пределах эталона примесь). Источников появления этой примеси два – 1) процесс получения (исходное вещество синтеза) и 2) процесс декарбоксилирования, который идет уже при 70-80оС.
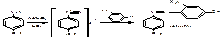
Количественное определение
1.Фармакопейный метод – нитритометрический, основанный на реакции диазотирования первичной ароматической аминогруппы натрия нитритом в кислой среде в присутствии катализатора - калия бромида. индикатор внешний – йодкрахмальная бумага. Титруют до появления синего пятна на бумаге.
 йодкрахмальная бумага
йодкрахмальная бумага
NaNO2 + HCl → HNO2 + NaCl
KI + HCl → HI + KCl
2HNO2 + 2HI → I2+ 2NO↑ + 2H2O
Суммарно:
2NaNO2 + 2KI + 4HCl → I2 + 2NO↑ + 2NaCl + 2KCl + 2H2O
1.Броматометрический и йодхлорметрический методы (см. определение производных п-аминобензойной кислоты). f = ¼ 2.Ацидиметрия (см. определение салицилата натрия).f = 1
Хранение Хранят в хорошо укупоренной таре, в сухом, защищенном от света месте, предохраняя от окисления и образования примесей продуктов разложения. Применение Внутрь для лечения различных форм туберкулёза по 2,0-3,0 г.
18.Производные фенилпропионовой кислоты: ибупрофен. Синтез. Физические свойства. Определение подлинности. Испытание на чистоту. Количественное определение. Условия хранения. Фармакологическое действие .
d,l-2-(4-изобутилфенил)-пропионовая кислота
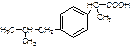
Описание белый или почти белый кристаллический порошок с характерным запахом. Тпл=75-77,5оС. Практически не растворим в воде, растворим в органических растворителях.
Подлинность
1.ИК-спектр ФС, снятый в диске с калия бромидом, в области 4000-400 см-1 должен иметь полное совпадение полос поглощения с полосами поглощения спектра стандартного образца.
2.УФ-спектр ФС раствора препарата в 0,1М натрия гидроксиде имеет максимумы при длинах волн 265 и 273 нм, а также плечо от 257 до 261 нм.
3.ВЭЖХ метод ФС.
4.ТСХ в таблетках – сравнение со стандартом (свидетелем).
Чистота 1. Цветность определяют спектрофотометрическим методом.
Оптическая плотность указанного раствора при длине волны λ=440 нм должна быть не более 0,28.
2.Посторонние примеси определяют: методом ГЖХ (по отношению суммы площадей пиков, обусловленных примесями, к площади пика ибупрофена). методом ТСХ
Количественное определение
1.ФС Алкалиметрия, вариант нейтрализации (по карбоксильной группе), растворитель и среда – этанол, индикатор – – тимоловый синий (от желтого до голубовато-серого).
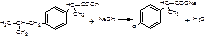 R-СООН + NаОН → R-СООNа+Н2О f экв,ибупрофена =1
R-СООН + NаОН → R-СООNа+Н2О f экв,ибупрофена =1
Ставят контрольный опыт (титруют без ЛВ)
2.ФС Метод ВЭЖХ (таблетки, растворы для инъекций). Количественное содержание рассчитывают по площади пика, которая пропорциональна количеству ЛВ в пробе.
Дата: 2019-07-30, просмотров: 1497.