В медицинской практике применяют железа (II) сульфат. Гептагидрат сульфата железа FeSO4 · 7H2O содержит природный минерал мелантерит. Его получают также, растворяя избыток восстановленного железа в 25–30%-ном растворе серной кислоты, при нагревании до 80 °C: Fe + H2SO4 à FeSO4 + H2
Раствор упаривают до кристаллизации, и полученный железа (II) сульфат сушат при 30 °C.
Железа (II) сульфат проявляет восстановительные свойства, образует двойные соли (соль Мора), аддукты (FeSO4)x(NO)y, другие комплексы. С раствором аммиака или щелочей соли железа (II) образуют осадок железа (II) гидроксида светло-зеленого цвета, который на воздухе постепенно превращается в бурого цвета осадок железа (III) гидроксида:
Fe2+ + 2OH– à® Fe(OH)2¯
4Fe(OH)2 + O2 + 2H2O à 4Fe(OH)3
Свойства железа (II) сульфата FeSO4 · H2O--Прозрачные кристаллы светлого голубовато-зеленого цвета или кристаллический бледно-зеленый порошок. На воздухе выветривается. Катион железа (II) можно обнаружить с помощью различных реакций. ФС рекомендует для этого реакцию образования синего осадка турнбулевой сини при действии раствором гексацианоферрата (III) калия:
FeSO4 + K3[Fe(CN)6] à FeK[Fe(CN)6]¯ + K2SO4
C сульфид-ионами катионы железа (II) образуют черный осадок сульфида:
FeSO4 + Na2S àFeS¯ + Na2SO4
Диметилглиоксим образует с ионами железа (II) в аммиачных растворах устойчивое комплексное соединение красного цвета, растворимое в воде. Для количественного определения используют реакцию окисления ионов железа (II) в ионы железа (III) с помощью титрованного раствора перманганата калия: 10 FeSO 4 + 8 H 2 SO 4 + 2 KMnO 4 à 5 Fe 2 ( SO 4 )3 + K 2 SO 4 + 2 MnSO 4 + 8 H 2 O
Использование хлороводородной кислоты вместо серной ведёт к перерасходу титранта, т.к. избыток хлоридов взаимодействует с перманганат-ионом. Простым методом, позволяющим быстро и точно определять содержание железа (II), является цериметрия. Соли железа (II) в присутствии разведенной серной кислоты и a,a’-дипиридила приобретают интенсивное красное окрашивание:
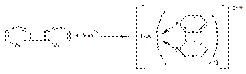
Ce4+ +e– àCe3+
2FeSO4 + 2Ce(SO4)2 à Fe2(SO4)3 + Ce2(SO4)3
Окраска исчезает после добавления избытка раствора сульфата церия (IV), что позволяет использовать a,a’-дипиридил в качестве индикатора при цериметрическом определении.
Фотометрический метод основан на образовании окрашенного комплекса железа (II) с о-фенантролином. Оптическую плотность измеряют при 508 нм. Титрование солей железа (II) может быть выполнено методом дихроматометрии по реакции:
6Fe2+ + Cr2O72– + 14H+ à 6Fe3+ + 2Cr3+ + 7H2O. В качестве индикатора используют дифениламин.
Железа (II) сульфат хранят в хорошо укупоренных банках в сухом месте, чтобы не допустить потери кристаллизационной воды. Он может также окисляться во влажном воздухе с образованием основной соли Fe2(OH)4SO4. При 64 °C железа (II) сульфат плавится в своей кристаллизационной воде.
ЛС средства органической природы
1.Глицерин. Получение, контроль качества, условия хранения .
Получение. Омыление жиров
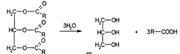 В присутствии щелочей или катализаторов образуются глицерин и высокомолекулярные жирные кислоты. Подлинность глицерина устанавливают по образованию непредельного альдегида — акролеина под действием водоотнимающих веществ (Hапример гидросульфата калия):
В присутствии щелочей или катализаторов образуются глицерин и высокомолекулярные жирные кислоты. Подлинность глицерина устанавливают по образованию непредельного альдегида — акролеина под действием водоотнимающих веществ (Hапример гидросульфата калия):
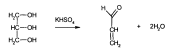
 Образование акролеина происходит также при нагревании смеси глицерина с борной кислотой. Открывают глицерин с помощью реакции образования глицерата меди» Смешивают предварительно 5% -ный раствор сульфата меди с раствором гидроксида натрия. К выпавшему голубому осадку гидроксида меди прибавляют несколько капель глицерина. Осадок растворяется с образованием синего раствора глицерата меди.
Образование акролеина происходит также при нагревании смеси глицерина с борной кислотой. Открывают глицерин с помощью реакции образования глицерата меди» Смешивают предварительно 5% -ный раствор сульфата меди с раствором гидроксида натрия. К выпавшему голубому осадку гидроксида меди прибавляют несколько капель глицерина. Осадок растворяется с образованием синего раствора глицерата меди.
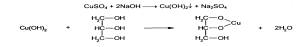
Для количественного определения глицерина можно использовать реакцию образования сложного эфира:

Глицерин хранят в хорошо укупоренной таре, в прохладном месте» учитывая способность глицерина поглощать пары воды, содержащиеся в воздухе. Глицерин в виде 84—88%-ной смеси с водой при наружном применении оказывает смягчающее действие.
Дата: 2019-07-30, просмотров: 444.