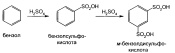
Сульфированием бензола, например* получают резорцин:
Колич-е определ-е. Бромид-броматометрическоё определение фенола, тимола, резорцина выполняют обратным титрованием ОД M раствором бромата калия в присутствие бромида калия:
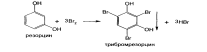
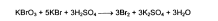
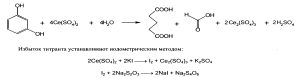
При определении резорцина избыток брома устанавливают иодометрически:
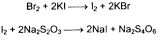
Для количественного определения резорцина может быть использован цериметрический метод.
Подлинность 1) При прибавлении к раствору препарата раствора хлорида окисного железа появляется сине-фиолетовое окрашивание, переходящее от прибавления раствора аммиака в буровато-желтое. 2) При сплавлении в фарфоровой чашке нескольких кристаллов препарата с избытком фталевого ангидрида получается плав желто-красного цвета. При растворении плава в растворе едкого натра появляется интенсивная зеленая флюоресценция. Препараты хранят в хорошо укупоренной таре. предохраняют от действия света. Фенол, резорцин и тимол применяют в качестве антисептических средств.
12. Производные п-аминофенола: парацетамол. Получение. Контроль качества, условия хранения. Парацетамол представляет собой белое кристаллическое вещество, умеренно растворимое в воде, легко растворимое в этаноле, растворимое в ацетоне и растворах едких щелочей, практически нерастворимое в эфире. Синтез парацетамола выполняют ацетилированием n-аминофенола:
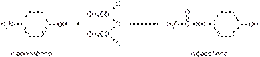
Известен также способ синтеза парацетамола из фенола:
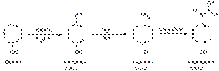
Подлинность парацетамола 1.ИК-спектру (снятому в вазелиновом масле) в области 4200-400 см–1, полосы поглощения которого должны полностью совпадать с прилагаемым к ФС рисунком спектра. 2.УФ-спектр 0,0005%-ного раствора парацетамола в метаноле, подкисленном хлороводородной кислотой, в области 220-350 нм имеет максимум поглощения при длине волны 249 нм. Водный раствор имеет максимум поглощения при 243 нм, а раствор в 0,001 М гидроксиде натрия — два максимума при 257 и 273 нм.
Цветную реакцию на фенольный гидроксил с раствором хлорида железа (III) используют для испытания подлинности парацетамола, в присутствии которого возникает сине-фиолетовое окрашивание. Испытание основано на реакциях гидролиза, окисления и образования производных индофенола:
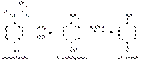
Непрореагировавший n-аминофенол при взаимодействии с хинонимином образует индофенол:

Раствор парацетамола при действии азотной кислотой приобретает желто-бурую окраску.
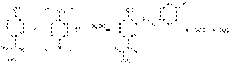
Под действием реактива Марки парацетамол приобретает буро-красное окрашивание. Образовавшаяся в результате гидролиза парацетамола соль ароматического амина после добавления нитрита натрия и щелочного раствора b-нафтола образует красного цвета азосоединение за счет наличия в молекуле ароматической аминогруппы 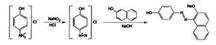 Парацетамол также образует красного цвета азосоединение с диазореактивом за счет наличия в молекуле фенольного гидроксила:
Парацетамол также образует красного цвета азосоединение с диазореактивом за счет наличия в молекуле фенольного гидроксила:
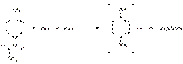
 Парацетамол при кипячении (2 мин) с разведенной хлороводородной или серной кислотой вследствие гидролиза выделяет уксусную кислоту, которую можно обнаружить по запаху:
Парацетамол при кипячении (2 мин) с разведенной хлороводородной или серной кислотой вследствие гидролиза выделяет уксусную кислоту, которую можно обнаружить по запаху:
Реакцию кислотного гидролиза используют для испытания на подлинность и в различных способах количественного определения. Парацетамол количественно определяют по образующемуся при кипячении с обратным холодильником в течение 1 часа продукту кислотного гидролиза — гидрохлориду п-аминофенола, используя нитритометрический метод:
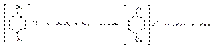
Эквивалентную точку устанавливают потенциометрически или с помощью внешнего индикатора — иодкрахмальной бумаги (ФС), которая синеет от выделившегося при добавлении избытка титранта иода:
NaNO2 + HCl à NaCl + HNO2 2)KI + HCl ----> KCl + HI 3)2HNO2 + 2HI àI2 + 2NO + 2H2O
Эквивалентную точку при нитритометрическом определении парацетамола можно также установить со смешанным внутренним индикатором, содержащим 0,1%-ный раствор тропеолина 00 и 0,15%-ный раствор метиленового синего.
Способ обратного цериметрического определения парацетамола основан на предварительном кислотном гидролизе и последующем окислении п-аминофенола избытком 0,1 М раствора сульфата церия. Процесс идет по схеме:
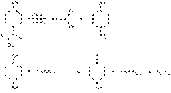
Точку эквивалентности устанавливают иодометрическим методом, добавляя 10%-ный раствор иодида калия и титруя выделившийся иод 0,1 М раствором тиосульфата натрия (индикатор крахмал): 2 Ce ( SO 4 )2 + 2 KI à I 2 + Ce 2 ( SO 4 )3 + K 2 SO 4. Фотоколориметрический метод определения парацетамола основан на образовании молибденовой сини при взаимодействии с молибдатом аммония в сильнокислой среде. Парацетамол хранят по списку Б в хорошо укупоренной таре, в сухом месте. Предохраняют от действия света, чтобы не допустить гидролиза и окисления.
13.Кислота бензойная и бензоат натрия. Получение. контроль качества, условия хранения .
Кислоты бензойную получают, используя общие методы синтеза ароматических кислот. Синтезируют кислоту бензойную, окисляя толуол различными окислителями — азотной или хромовой кислотами, дихроматом калия, диоксидом марганца:
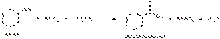
Современный промышленный способ основан на жидкофазном окислении толуола кислородом воздуха при 130-160 °C и давлении 308-790 кПа по схеме:
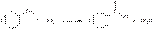
 Натрия бензоат получают, выпаривая досуха раствор соответствующей кислоты (бензойной или салициловой), нейтрализованной эквивалентным количеством карбоната или гидрокарбоната натрия:
Натрия бензоат получают, выпаривая досуха раствор соответствующей кислоты (бензойной или салициловой), нейтрализованной эквивалентным количеством карбоната или гидрокарбоната натрия:
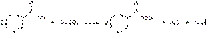 Полученную соль перекристаллизовывают из спирта.
Полученную соль перекристаллизовывают из спирта.
Подлинность УФ-спектр водного раствора натрия бензоата в области 220-300 нм должен иметь максимум поглощения при 226 нм. Раствор (0,001%) кислоты салициловой в 0,5 М растворе серной кислоты имеет два максимума поглощения при 235 и 300 нм.
Кислота бензойная и натрия бензоат дают характерную реакцию с раствором хлорида железа (III). Кислоту бензойную предварительно растворяют в 0,1 М растворе гидроксида натрия (реакция раствора должна быть нейтральной). В результате реакции образуется нерастворимый в воде основной бензоат железа (III) розово-желтого цвета:
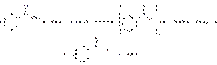
Подлинность натрия бензоата устанавливают по иону натрия (окраска бесцветного пламени горелки в желтый цвет) и по выделению соответствующих кислот после нейтрализации растворов натриевых солей разведенной азотной кислотой. Способы количественного определения бензойной основаны на использовании алкалиметрического метода. В качестве растворителя используют этанол (так как кислоты мало растворимы в воде). Этанол предварительно нейтрализуют по фенолфталеину (феноловому красному). Затем растворяют навеску и титруют 0,1 М раствором гидроксида натрия (не содержащим карбонатов) с тем же индикатором:

Натрия бензоат, количественно определяют ацидиметрическим методом. Титруют раствором хлороводородной кислоты, используя смешанный индикатор (смесь равных количеств метилового оранжевого и метиленового синего:

Хранят ароматические кислоты и их соли в сухом, защищённом от света месте, при комнатной температуре, в хорошо укупоренной таре, учитывая возможность возгонки кислоты бензойной и кислоты салициловой. Применяют кислоты бензойную и салициловую наружно в качестве антисептических средств. Натрия бензоат назначают как отхаркивающее средство (в микстурах по 0,2–0,5 г или внутривенно в виде 15%-ного раствора).
14. Кислота салициловая и салицилат натрия. Получение, контроль качества, условия хранения. Кислоты салициловую получают, используя общие методы синтеза ароматических кислот.
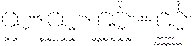 В химической промышленности кислоту салициловую получают карбоксилированием фенола по реакции Кольбе–Шмидта:
В химической промышленности кислоту салициловую получают карбоксилированием фенола по реакции Кольбе–Шмидта:
При карбонизации фенолята калия происходит образование смеси салициловой и n-оксибензойной кислот. При использовании фенолята натрия получается в основном кислота салициловая. При синтезе кислоты салициловой могут образовываться также небольшие количества оксидифенила:
Натрия салицилат получают, выпаривая досуха раствор соответствующей кислоты (бензойной или салициловой), нейтрализованной эквивалентным количеством карбоната или гидрокарбоната натрия:
Полученную соль перекристаллизовывают из спирта.
Подлинность натрия салицилата подтверждают с помощью ИК-спектра в области 4000-400 см–1 (спресованный в таблетках с бромидом калия), который должен полностью совпадать со спектром, прилагаемым к ФС. Раствор (0,001%) кислоты салициловой в 0,5 М растворе серной кислоты имеет два максимума поглощения при 235 и 300 нм. Для испытания подлинности кислоты салициловой и натрия салицилата также используют в качестве реактива раствор хлорида железа (III):

С раствором сульфата меди натрия салицилат образует зеленого цвета салицилат меди:
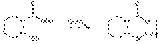
При нагревании кислоты салициловой или натрия салицилата с концентрированной серной кислотой и метанолом возникает резкий характерный запах метилсалицилата. При нагревании выше температуры плавления кристаллов кислоты салициловой или нагревании ее смеси с кристаллами солей органических кислот (цитрата или ацетата натрия) происходит разложение с образованием фенола (запах) и диоксида углерода:
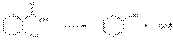
Диоксид углерода можно обнаружить по образованию опалесценции при пропускании выделяющегося газа через известковую воду: Ca(OH)2 + CO2--à CaCO3¯ + H2O
Кислота салициловая образует окрашенное в красный цвет соединение (ауриновый краситель) при действии раствором формальдегида в присутствии концентрированной серной кислоты.
Подлинность натрия салицилата устанавливают по иону натрия (окраска бесцветного пламени горелки в желтый цвет) и по выделению соответствующих кислот после нейтрализации растворов натриевых солей разведенной азотной кислотой.
Способы количественного определения салициловой кислот основаны на использовании алкалиметрического метода. В качестве растворителя используют этанол (так как кислоты мало растворимы в воде). Этанол предварительно нейтрализуют по фенолфталеину (феноловому красному). Затем растворяют навеску и титруют 0,1 М раствором гидроксида натрия (не содержащим карбонатов) с тем же индикатором:
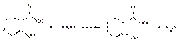
Натрия салицилат количественно определяют ацидиметрическим методом
.
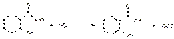
Количественное определение кислоты салициловой и натрия салицилата можно выполнить также бромид-броматометрическим методом, так как они являются производными фенола: KBrO3 + 5KBr + 3H2SO4--à 3Br2 + 3K2SO4 + 3H2O
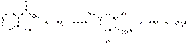 Избыток брома затем определяют иодометрическим методом:
Избыток брома затем определяют иодометрическим методом:
Br2 + 2KI --à I2 + 2KBr
I2 + 2Na2S2O3 --à 2NaI + Na2S4O6
Определить содержание кислоты салициловой и натрия салицилата можно иодхлорометрическим методом, основанным на иодировании этих веществ в орто- и пара-положениях до дииодпроизводных:
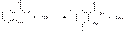
Затем прибавляют 10%-ный раствор иодида калия, который взаимодействует с избытком иодмонохлорида и выделившийся иод оттитровывают 0,1 М раствором тиосульфата натрия: 1)ICl + KI --à I2 + KCl 2)I2 + 2Na2S2O3--à2NaI + Na2S4O6
Хранение: в сухом, защищ от света месте, при комнатной т, в хорошо укупоренной таре.. Кислоту салициловую назначают в качестве антисептического и кератолитического средства наружно. Натрия салицилат оказывает противоревматическое, противовоспалительное, болеутоляющее и жаропонижающее действие при приеме внутрь в дозах по 0,5–1,0 г.
Дата: 2019-07-30, просмотров: 750.