Раствор водорода перекиси H2O2-Бесцветная прозрачная жидкость без запаха3% H2O2
Магния перекисьMgO2 + MgO--Белый легкий порошок, практически нерастворимый в воде25% MgO2. Гидроперит- белый кристаллический порошок, легко растворимый в воде, растворимый в этаноле, практически нерастворимый в хлороформе. Гидроперит образует водорода перекись при растворении в воде. Магния перекись выделяет водорода перекись в расворах минеральных кислот: MgO2 + 2HCl ® MgCl2 + H2O2
Водорода перекись впервые получена Тенаром в 1818 г. при действии серной кислотой на бария перекись: BaO2 + H2SO4 ® H2O2 + BaSO4¯
Производство водорода перекиси осуществляют электролизом 40-68%-ных растворов серной кислоты при 5-8°С. Процесс электролиза проходит по схеме:
 Продуктом электролиза является надсерная (пероксодисерная) кислота.:
Продуктом электролиза является надсерная (пероксодисерная) кислота.:
Эти способы позволяют получать разбав-ные р-ры водорода перекиси. Путем перегонки в вакууме 70°С конц-ют водорода перекись, получая в рез-те 30-60%-ные р-ры.
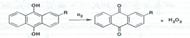 В химическом отношении водорода перекись представляет собой очень слабую кислоту. Водные растворы ее имей слабокислую реакцию, константа диссоциации 2,0.10-12. Водорода перекись проявляет как окислительные, так и восстановительные свойства. Она устойчива в чистом состоянии и в водных растворах (при обычной температуре).:
В химическом отношении водорода перекись представляет собой очень слабую кислоту. Водные растворы ее имей слабокислую реакцию, константа диссоциации 2,0.10-12. Водорода перекись проявляет как окислительные, так и восстановительные свойства. Она устойчива в чистом состоянии и в водных растворах (при обычной температуре).:


Окислительные свойства водорода перекиси используют как для подтверждения подлинности, так и количественного определения. При установлении подлинности к 2 мл раствора водорода перекиси добавляют по I мл разведенной серной кислоты и йодида калия, а затем 5 мл хлороформа. Смесь взбалтывают, после расслоения образовавшийся в результате реакции свободный йод окрашивает слой хлороформа в фиолетовый цвет: Для установления подлинности указанных лекарственных препаратов водорода перекиси используют реакцию образования окрашенных в синий цвет перекисных соединений (смеси надхромовых кислот и пероксида хрома), растворимых в эфире. К раствору водорода перекиси, подкисленному серной кислотой, прибавляют диэтиловый эфир и несколько капель раствора дихромата калия. После взбалтывания и отстаивания смеси эфирный слой окрашивается в синий цвет:
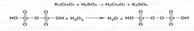

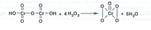 При выполнении реакции с водорода перекисью высокой концентрации образуется надхромовая кислота состав Н2Сr2O12
При выполнении реакции с водорода перекисью высокой концентрации образуется надхромовая кислота состав Н2Сr2O12
Наличие иона магния в магния перекиси подтверждают по образованию белого кристаллического осадка фосфата магния-аммония при взаимодействии с раствором гидрофосфата динатрия в присутствии хлорида аммония и аммиака:

Количе опред-е перекиси вод- восстан вып-ют прямым перманганат-им титр-ем в кислой среде (до слабо-розового окрашивания): Лекарственный препарат должен содержать 2,5-3,5% водорода перекиси. Количественное содержание можно также установить, используя окислительные свойства водорода перекиси, йодометрическим методом:
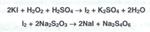 Количественное определение магния перекиси и водорода перекиси в гидроперите проводят прямым перманганатометрическим титрованием. Они должны соответственно содержать 25% магния перекиси и 35% водорода перекиси в гидроперите.
Количественное определение магния перекиси и водорода перекиси в гидроперите проводят прямым перманганатометрическим титрованием. Они должны соответственно содержать 25% магния перекиси и 35% водорода перекиси в гидроперите.
Хранят 3%-ный раствор водорода перекиси в склянках с притертыми стеклянными пробками, в прохладном, защищенном от света месте. Твердые препараты водорода перекиси хранят в сухом, защищенном от света месте, в хорошо укупоренной таре при комнатной температуре.
Раствор водорода перекиси применяют в качестве антисептического, дезодорирующего и депигментирующего средства.
Дата: 2019-07-30, просмотров: 443.