Наиболее важные минералы бора: борная кислота (сассолин) H3BO3; бура Na2B4O7 × 10H2O; кернит Na2B4O7 × 4H2O; борокальцит CaB4O7 × 4H2O; ашарит B2O3 × 2MgO × H2O и др. В медицинской практике применяют лекарственные вещества кислоту борную и натрия тетраборат. Источниками их получения являются природные минералы, которые либо сами содержат борную кислоту (сассолин) и натрия тетраборат (бура, кернит), либо разрушаются с их образованием.. Кислоту борную получают также разложением буры или борокальцита горячим раствором хлороводородной кислоты:
Na2B4O7 × 10H2O + 2HCl à4H3BO3 + 2NaCl + 5H2O
CaB4O7 × 4H2O + 2HCl + H2O à4H3BO3 + CaCl2
Фильтрат охлаждают, и выделившиеся кристаллы кислоты борной перекристаллизовывают из воды. Натрия тетраборат получают действием растворов карбоната натрия (при нагревании) на кислоту борную или минерал борокальцит:
4H3BO3 + Na2CO3 à Na2B4O7 + CO2 + 6H2O
CaB4O7 + Na2CO3àNa2B4O7 + CaCO3¯
При перекристаллизации натрия тетраборат присоединяет 10 молекул воды.
Кислота борная-H3BO3-Бесцветные, блестящие, жирные на ощупь чешуйки или мелкокристаллический порошок без запаха Натрия тетраборат (бура)Na2B4O7·10H2O представляют собой бесцветные , прозрачные вещества , легко выветривающиеся кристаллы или белый кристаллический порошок.
Водные растворы кислоты борной (1:50) имеют слабокислую реакцию (K = 6,4 × 10–10). В водной среде устанавливается равновесие: + H2O ⇄ B(OH)4– + H+
При нейтрализации гидроксидами щелочных металлов образуются соли тетраборной кислоты H2B4O7(тетрабораты) или реже метаборной HBO2 (метабораты).
Водные растворы натрия тетрабората имеют щелочную реакцию (вследствие гидролиза):
Na2B4O7 + 7H2O à 4H3BO3 + 2NaOH
Под действием сильных кислот происходит нейтрализация:
Na2B4O7 + 2HCl + 5H2O à 4H3BO3 + 2NaCl
Эту реакцию используют для подготовки натрия тетрабората к испытанию на подлинность, а также для его количественного определения. Подлинность соединений бора можно установить по реакции образования в присутствии этанола борноэтилового эфира:
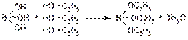 Для количественного определения соединений бора используют кислотные свойства растворов кислоты борной в глицерине и щелочные свойства водных растворов натрия тетрабората. При прямом титровании кислоты борной щелочью образуется метаборат натрия, который в водных растворах сильно гидролизуется: H3BO3 + NaOH à NaBO2 + 2H2O
Для количественного определения соединений бора используют кислотные свойства растворов кислоты борной в глицерине и щелочные свойства водных растворов натрия тетрабората. При прямом титровании кислоты борной щелочью образуется метаборат натрия, который в водных растворах сильно гидролизуется: H3BO3 + NaOH à NaBO2 + 2H2O
NaBO2 + 2H2O à H3BO3 + NaOH
Для количественного определения используют способность кислоты борной образовывать с глицерином сильную одноосновную диглицериноборную кислоту, которую можно с достаточной точностью оттитровать щелочью, используя в качестве индикатора фенолфталеин:
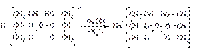 Количественное определение кислоты борной проводят в смеси (1:4) свежепрокипяченной воды (свободной от углекислого газа) и нейтрализованного (по фенолфталеину) глицерина при комнатной температуре. Для контроля полноты образования натриевой соли диглицериноборной кислоты к концу титрования добавляют дополнительную порцию (10 мл) глицерина. Сохранение при этом розовой окраски свидетельствует о достижении эквивалентной точки.
Количественное определение кислоты борной проводят в смеси (1:4) свежепрокипяченной воды (свободной от углекислого газа) и нейтрализованного (по фенолфталеину) глицерина при комнатной температуре. Для контроля полноты образования натриевой соли диглицериноборной кислоты к концу титрования добавляют дополнительную порцию (10 мл) глицерина. Сохранение при этом розовой окраски свидетельствует о достижении эквивалентной точки.
Количественное определение натрия тетрабората выполняют методом нейтрализации (индикатор метиловый оранжевый), используя для этого реакцию взаимодействия с хлороводородной кислотой:
Na2B4O7 · 10H2O + 2HCl à 4H3BO3 + 2NaCl + 5H2O
Лекарственные препараты соединений бора хранят в защищённом от света месте, в хорошо укупоренной таре. Кислоту борную и натрия тетраборат применяют в качестве наружных антисептических средств в виде водных 1–4%-ных растворов.
11.Алюминия оксид гидратированный и алюминия фосфат. Получение, контроль качества, условия хранения .
Из соединений алюминия в медицине чаще всего применяют алюминия гидроксид. Источниками получения алюминия и его солей являются минералы боксит, гиббсит (гидраргиллит), алунит и другие, представляющие собой смесь гидроксидов или их сочетание с сульфатом алюминия, оксидом кремния (IV). Алюминия гидроксид получают из сульфата алюминия или квасцов и раствора аммиака:
Al2(SO4)3 + 6NH3 · H2О à 2Al(OH)3¯ + 3(NH4)2SO4
2KAl(SO4)2 + 6NH3 · H2О à 2Al(OH)3¯ + K2SO4 + 3(NH4)2SO4
Осаждают при температуре 60 °C в присутствии сульфата аммония. Осадок отфильтровывают, промывают горячей водой и высушивают при 40 °C. Известны четыре кристаллические (a, b, g и g’) модификации и аморфный (гелеобразный) алюминия гидроксид переменного состава Al2O3 · nH2O. По современным представлениям образование гидроксида алюминия происходит по схеме:
Al(H2O)63+ + H2OàAl(H2O)5OH2+ + H3O+ (pKa1 = 4,96)
2Al(H2O)4(OH)+2 + nH2O à Al2O3 × nH2O + 2H3O+
H3O+ + OH– à2H2O
Алюминия гидроксид Al(OH)3 или Al2O3 · nH2O -Аморфный рыхлый белый порошок . Алюминия гидроксид практически нерастворим в воде и этаноле, но растворим при нагревании в разведённых кислотах и растворах едких щелочей с образованием прозрачного или слабо мутного раствора:
Al(OH)3 + 3HCl à AlCl3 + 3H2O
Al(OH)3 + NaOH à Na[Al(OH)4]
Таким образом алюминия гидроксид является амфотерным соединением:
Al2O3 × nH2O + 6H+ à 2Al3+ + (3+n)H2O
Al2O3 × nH2O + 2OH– à Al(OH)4– + Al(OH)4(H2O)2+ + yH2O
Добавлением раствора хлорида аммония к щелочному раствору можно понизить pH раствора и осадить гидроксид алюминия: 2Al(OH)4– + NH4+ à Al2O3 · nH2O¯ + NH3. Эту реакцию используют для испытания на подлинность.. Ион алюминия обнаруживают с помощью реакции пиролиза. Смоченное раствором нитрата кобальта небольшое количество алюминия гидроксида образует после прокаливания плав, окрашенный в синий цвет вследствие образования алюмината кобальта (тенаровой сини) — Co(AlO2)2.
Количественное определение алюминия гидроксида выполняют комплексонометрическим методом, используя обратное титрование. Избыток ЭДТА Na оттитровывают 0,02 М раствором сульфата меди (индикатор мурексид). Для количественного определения алюминия гидроксида может быть применён гравиметрический метод, основанный на предварительном t°
прокаливании,охлаждении и взвешивании образовавшегося оксида алюминия: 2Al(OH)3 à Al2O3 + 3 H2O. Хранят алюминия гидроксид в хорошо укупоренной таре, применяют как антацидное средство. Применяют в медицине также алюминия фосфат (Aluminium phosphate). Его получают из растворимых солей алюминия при взаимодействии с эквивалентными количествами ортофосфатов щелочных металлов в растворах с pH 4,0-4,5: Al2(SO4)3 + 2Na3PO4 + nH2O à2AlPO4 · nH2O + 3Na2SO4 Выпадает аморфный осадок. Применяют алюминия фосфат в виде геля в качестве противоязвенного, антацидного, обволакивающего, адсорбирующего средства. Механизм действия заключается в том, что в желудке в течение 10 мин pH повышается до 3,0-5,0 и снижается протеолитическая активность пепсина. Назначают при различных заболеваниях желудочно-кишечного тракта внутрь, через 1-2 часа после еды по 3-5 пакетиков на приём (один пакетик с 16 г геля содержит 10,4 г алюминия фосфата). Хранят в сухом прохладном месте. Замораживание не допускается. Применяют как антацидное средство при язвенной болезни, гастритах, диспепсии и др.
Дата: 2019-07-30, просмотров: 974.