В медицине применяют неорганические соединения цинка: цинка оксид и цинка сульфат. Основной источник их получения — очищенный от примесей металлический цинк. Цинка сульфат впервые получен в 1730 г. растворением цинка в разведенной серной кислоте.: Zn + H2SO4 à ZnSO4 + H2
Из растворов кристаллизуется гептагидрат цинка сульфата при 39-41 °C. При 42-70 °C образуется гексагидрат, а выше 70 °C — моногидрат. Раствор цинка сульфата при нагревании с карбонатом натрия образует осадок основного карбоната цинка, который промывают для удаления сульфат-ионов, сушат и прокаливают (300 °C) до получения оксида:
5ZnSO4 + 5Na2CO3 + 3H2O à 2ZnCO3 · 3Zn(OH)2¯ + 5Na2SO4 + 3CO2
300 °C
2ZnCO3 · 3Zn(OH)2 à 5ZnO + 2CO2 + 3H2O
Цинка оксид получают также окислением цинка на воздухе или в кислороде:
2Zn + O2 à 2ZnO
Цинка окись, цинка оксид -ZnO- Белый или белый с желтоватым оттенком аморфный порошок Цинка сульфат- ZnSO4 · 7H2O- Бесцветные прозрачные кристаллы или мелкокристаллический порошок без запаха. На воздухе выветривается, а при 280 °C полностью теряет кристаллизационную воду. Соединения цинка проявляют амфотерные свойства. При растворении в разведенных минеральных кислотах цинка оксид образует соли, а в избытке растворов гидроксидов щелочных металлов растворимые в воде гидроксокомплексы:
2NaOH NaOH H2SO4
[Zn(OH)4]2– à Zn(OH)2 à ZnO à ZnSO4
Гидроксид цинка растворим также в избытке раствора аммиака с образованием комплексной соли:
Zn(OH)2 + 4NH4OH à [Zn(NH3)4](OH)2 + 4H2O
Перед испытанием на подлинность цинка оксид превращают в соль, растворяя в разведенной серной кислоте. Наличие иона цинка устанавливают по образованию белого осадка сульфида цинка, нерастворимого в уксусной кислоте и легко растворимого в разведенной хлороводородной кислоте (поэтому реакцию нужно выполнять в нейтральной среде): ZnSO4 + Na2S à ZnS¯ + Na2SO4
Эта реакция позволяет отличать цинк от других тяжелых металлов, образующих сульфиды черного цвета. Растворы солей цинка образуют белый гелеобразный осадок при взаимодействии с раствором гексацианоферрата (II) калия: ZnSO 4 + K 4 [ Fe ( CN )6] à K 2 Zn [ Fe ( CN )6]¯ + K 2 SO 4
Осадок нерастворим в разведенных кислотах, растворим в растворах щелочей. Тетрароданомеркурат (II) аммония образует с солями цинка в слабокислой среде белый кристаллический осадок: ZnCl2 + (NH4)2Hg(NCS)4 àZnHg(NCS)4¯ + 2NH4Cl
Подобно ионам алюминия (III) цинк во всех соединениях можно обнаружить специфичной реакцией, основанной на прокаливании с нитратом кобальта. Образуется так называемая «зелень Ринмана» — ярко-зелёный плав: t°
ZnO + Co ( NO 3 )2 à CoZnO 2 + 2 NO 2 + ½ O 2
Количественное определение обоих лекарственных веществ проводят комплексонометрическим методом по иону цинка.. Соединения цинка хранят в хорошо укупоренной таре. При хранении следует иметь в виду, что цинка оксид поглощает углекислый газ из воздуха: ZnO + CO2 à ZnCO3
Растворы цинка сульфата при хранении мутнеют вследствие образования основной соли: 3Zn(OH)2 · ZnSO4 · 4H2O. Цинка оксид применяют наружно в качестве вяжущего, подсушивающего и дезинфицирующего средства при кожных заболеваниях. Растворы цинка сульфата (0,1–0,25%) применяют в качестве вяжущего и антисептического средства в офтальмологии, оториноларингологической и урологической практике.
14.Соединения серебра: серебра нитрат, протаргол. Получение, контроль качества, условия хранения. В медицинской практике применяют серебра нитрат и коллоидные препараты серебра: колларгол и протаргол. Получают серебра нитрат действием на металлическое серебро избытком азотной кислоты. Происходит процесс окисления серебра с образованием соли:
3 Ag + 4 HNO 3 à 3 AgNO 3 + 2 H 2 O + NO
Для очистки от примесей полученный серебра нитрат осаждают из раствора хлороводородной кислотой в виде хлорида серебра:
AgNO3 + HCl à AgCl¯ + HNO3
Хлорид серебра промывают и восстанавливают цинковой пылью до металлического серебра:
2AgCl + Zn + H2SO4à2Ag¯ + ZnSO4 + 2HCl
Затем вновь получают серебра нитрат из очищенного металлического серебра, растворяя его в азотной кислоте. Полученный раствор концентрируют до кристаллизации. Под влиянием света, особенно в присутствии следов органических веществ, серебра нитрат темнеет, так как происходит восстановление серебра: AgNO3 à Ag + NO + O2
Свойство - серебра нитрат-AgNO3-Бесцветные прозрачные кристаллы в виде пластинок или белых цилиндрических палочек, без запаха.
Для испытания подлинности серебра нитрата использованы те же принципы, что и при идентификации меди (II) сульфата: восстановление и способность к комплексообразованию. Серебро восстанавливается из аммиачного раствора серебра нитрата при нагревании с раствором формальдегида:
AgNO3 + NH3 · H2O à AgOH + NH4NO3
AgOH + 2NH3à [Ag(NH3)2]OH
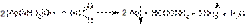
Эти реакции лежат в основе образования «серебряного зеркала» — тонкой блестящей пленки серебра на стенках пробирки.
Ион серебра можно открыть с помощью реакции, которую используют для обнаружения хлорид-иона. Реактивом при этом служит раствор хлороводородной кислоты или хлорида натрия. Осаждающийся хлорид серебра нерастворим в азотной кислоте, но растворяется в растворе аммиака с образованием комплексного соединения:
AgNO3 + HCl ® AgCl¯ + HNO3
AgCl + 2NH3 · H2О à [Ag(NH3)2]Cl + 2H2O
Для обнаружения иона серебра можно применить реакцию осаждения с иодид-ионом. Образуется желтого цвета осадок иодида серебра, нерастворимый в растворах аммиака и азотной кислоты. Ион серебра можно обнаружить, используя реакцию осаждения с хроматом калия, по образованию оранжево-красного осадка хромата серебра: AgNO3 + K2CrO4 à AgCrO4¯ + 2KNO3
Количественно серебра нитрат определяют тиоцианатометрическим (роданометрическим) методом:
AgNO3 + NH4NCS à AgNCS¯ + NH4NO3
Избыток титранта — тиоцианата аммония взаимодействует с индикатором —железоаммониевыми квасцами, окрашивая смесь по окончании титрования в розовый цвет:
3NH4NCS + FeNH4(SO4)2 à Fe(NCS)3 + 2(NH4)2SO4
Серебра нитрат хранят по списку А в хорошо укупоренных банках с притертой пробкой, в защищенном от света месте, чтобы не допустить восстановления серебра нитрата до металлического серебра. Применяют серебра нитрат в качестве антисептического средства наружно в виде 1–2%-ных водных растворов для лечения глазных и кожных заболеваний. (Необходимо очень тщательно контролировать концентрацию.)
Дата: 2019-07-30, просмотров: 471.