Получают карбонаты и гидрокарбонаты аммиачно-хлоридным способом. На очищенный от примесей рассол хлорида натрия действуют аммиаком, а затем подвергают карбонизации в барботажных колоннах: NaCl + NH3 + CO2 + H2O à NaHCO3 + NH4Cl
Прокаливанием гидрокарбонатов получают карбонаты. Испытания на подлинность и количественное определение карбонатов и гидрокарбонатов основаны на химической реакции разложения минеральной кислотой: Na2CO3 + 2HCl à CO2 + 2NaCl + H2O
NaHCO3 + HCl à CO2 + NaCl + H2O
Этот процесс лежит в основе антацидного действия натрия гидрокарбоната.
Натрия гидрокарбонат был открыт в 1801 г. В. Розе. В настоящее время его получают при насыщении очищенного кристаллического карбоната натрия диоксидом углерода:
Na2CO3 · 10H2O + CO2 à 2NaHCO3 + 9H2O
Для окончательной очистки натрия гидрокарбонат перекристаллизовывают из теплой воды (60 °C), насыщенной диоксидом углерода. Натрия гидрокарбонат растворим в воде, практически нерастворим в этаноле. Водные растворы имеют слабощелочную реакцию.
Подлинность его устанавливают по наличию иона натрия и гидрокарбонат-иона. Последний обнаруживают с помощью реакции разложения разведенной хлороводородной кислотой, которое происходит с выделением пузырьков газа: NaHCO3 + HClàNaCl + H2O + CO2
Для количественного определения используют ту же реакцию. Навеску растворяют в свежее прокипяченной и охлажденной воде (воду кипятят для удаления растворенного углекислого газа) и титруют 0,1 М раствором хлороводородной кислоты (индикатор метиловый оранжевый). Натрия гидрокарбонат хранят в хорошо укупоренных банках.Натрия гидрокарбонат применяют в качестве антацидного средства внутрь, а также наружно в виде полосканий, промываний, ингаляций (0,5–2%-ные растворы).
8.Кальция хлорид и кальция сульфат гептагидрат. Получение, контроль качества, условия хранения.
Кальция хлорид получают обработкой мела или мрамора хлороводородной кислотой:
CaCO3 + 2HCl à CaCl2 + CO2 + H2O
В медицинской практике применяют кальция хлорид . Он очень легко растворим в воде с образованием растворов нейтральной реакции. Раствор в воде при этом сильно охлаждается. В отличие от многих неорганических солей кальция хлорид легко растворяется в этаноле.
Кальция хлорид-CaCl2 · 6H2O-Бесцветные кристаллы без запаха, горько-соленого вкуса, очень гигроскопичные, расплываются на воздухе, переходя при 34 °C в дигидрат. Наличие иона кальция устанавливают по окрашиванию бесцветного пламени горелки в кирпично-красный цвет и по образованию белого осадка при добавлении оксалата аммония к раствору кальция хлорида. Осадок растворим в разведенных минеральных кислотах, поэтому реакцию необходимо вести в нейтральной среде или в присутствии уксусной кислоты:
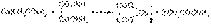
В разбавленных растворах ион кальция образует с серной кислотой (1:4) характерные игольчатые кристаллы CaSO4 × 2H2O.
Гексацианоферрат (II) калия при pH 7 в присутствии хлорида аммония образует с ионами кальция белый кристаллический осадок:
CaCl2 + K4[Fe(CN)6] + NH4Cl à KNH4Ca[Fe(CN)6]¯ + 3KCl
Кальция хлорид испытывают также на наличие хлорид-ионов.
Количественное определение кальция хлорида выполняют комплексонометрическим методом. В основе определения лежит тот же химический процесс, что и при анализе солей магния. Индикатором служит кислотный хром темно-синий, который в эквивалентной точке приобретает сине-фиолетовое окрашивание. Кальция хлорид можно количественно определить и по аниону аргентометрическим методом: CaCl2 + 2AgNO3 à 2AgCl¯ + Ca(NO3)2
При хранении необходимо учитывать высокую гигроскопичность кальция хлорида. Поэтому его хранят в небольших хорошо укупоренных стеклянных банках с пробками, залитыми парафином, в сухом месте. Кальция хлорид применяют в качестве средства, оказывающего противоаллергическое, противовоспалительное, кровоостанавливающее, диуретическое действие. В хирургической и стоматологической практике применяют кальция сульфат жженый (Calcii sulfas ustus). В природе широко распространен гипс, представляющий собой кальция сульфата дигидрат CaSO4·2H2O. При нагревании до 130–150 °C он теряет часть своей кристаллизационной воды и превращается в гемигидрат (полугидрат) 2CaSO4·H2O. Кальция сульфат жженый (гипс) — сухой, мелкий, аморфный порошок белого или слегка сероватого цвета. Он мало растворим (1:600) в воде, водный раствор имеет нейтральную реакцию. Подлинность гипса устанавливают по иону кальция и сульфат-иону. Гипс испытывают также на затвердевание: смесь 10 ч. гипса и 5 ч. воды должна затвердевать в белую твердую плотную массу не ранее, чем через 4 мин и не позднее чем через 10 мин. Хранят гипс в хорошо укупоренных стеклянных и жестяных банках в сухом прохладном месте.
9.Магния оксид и магния сульфат гептагидрат MgSO₄·7H₂O. Получение, контроль качества, условия хранения.
Встречается магний в природе в виде различных соединений, главным образом магнезита MgCO3, доломита MgCa(CO3)2, кизерита MgSO4 × H2O, эпсомита MgSO4 × 7H2O, различных силикатов (серпентин, асбест, тальк и др.). Соединения магния применяют в медицинской практике в виде магния оксида, магния сульфата и др.
Магния оксид можно получить при обработке природных рассолов гидроксидом кальция (известковым молоком). Образуется гидроксид магния, который превращают в оксид термической обработкой (при 500–700 °C):
MgCl2 + Ca(OH)2 à CaCl2 + Mg(OH)2¯
Mg(OH)2 à MgO + H2O
Приготовленный в таких условиях магния оксид называют «лёгкой магнезией». Магния сульфат получают нагреванием магнезита с избытком серной кислоты (избыток кислоты необходим, чтобы избежать образования основных солей магния): MgCO3 + H2SO4 à MgSO4 + H2O + CO2
При комнатной температуре из водных растворов кристаллизуется MgSO4 × 7H2O.
Магния оксид и магния сульфат различаются по физическим свойствам .Магния оксид-Белый мелкий легкий порошок без запаха. практически нерастворим в воде (свободной от примеси углекислого газа) и в этаноле, но растворим в разведённых кислотах. Магния сульфат -Бесцветные призматические выветривающиеся кристаллы .легко растворим в воде, практически нерастворим в этаноле.
Испытания на подлинность магния оксида проводят после предварительного растворения в разведенных кислотах: MgO + 2HCl à MgCl2 + H2O . Для обнаружения иона магния используют общую реакцию образования нерастворимого в воде, но растворимого в уксусной кислоте белого кристаллического осадка фосфата магния-аммония. Осадок выпадает при добавлении к раствору соли магния гидрофосфата динатрия и раствора аммиака:
NH4Cl
MgCl2 + Na2HPO4 + NH3 · H2О à NH4MgPO4¯ + 2NaCl + H2O
NH4MgPO4 + 2CH3COOH àMg(CH3COO)2 + NH4H2PO4
Ион магния в магния оксиде обнаруживают, осаждая его из растворов в хлороводородной кислоте избытком гидроксида натрия. Образующийся гидроксид магния представляет собой белый студенистый осадок, нерастворимый в избытке раствора гидроксида натрия.
В магния сульфате устанавливают наличие сульфат-иона: MgSO4 + BaCl2 à BaSO4¯ + MgCl2
 Соединения магния количественно определяют прямым комплексонометрическим методом с использованием индикатора кислотного хром черного специального (эриохром черный Т). После добавления индикатора к титруемому раствору ионы магния образуют с ним непрочное комплексное соединение:
Соединения магния количественно определяют прямым комплексонометрическим методом с использованием индикатора кислотного хром черного специального (эриохром черный Т). После добавления индикатора к титруемому раствору ионы магния образуют с ним непрочное комплексное соединение:
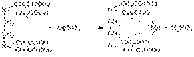 Титрант — 0,05 М раствор трилона Б (ЭДТАNa2) связывает находящиеся в растворе ионы магния в комплексное соединение:
Титрант — 0,05 М раствор трилона Б (ЭДТАNa2) связывает находящиеся в растворе ионы магния в комплексное соединение:
Поскольку при этом происходит выделение серной кислоты, для поддержания оптимального значения pH среды необходимо прибавлять аммиачный буферный раствор. В эквивалентной точке, когда все ионы магния будут связаны в комплексное соединение металл — ЭДТА Na2, ЭДТА Na2 — металл, поэтому происходит разрушение комплекса индикатора с ионами магния. При этом красно-фиолетовая окраска раствора переходит в синюю окраску свободного индикатора:
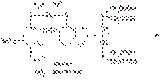
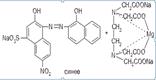
Соединения магния хранят в хорошо укупоренной таре, так как магния оксид взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примесь карбоната и гидроксида магния: MgO + CO2 à MgCO3 MgO + H2O ® Mg(OH)2. Магния сульфат в плохо укупоренной таре постепенно теряет кристаллизационную воду.
Дата: 2019-07-30, просмотров: 1351.