Тема 1
Содержание травматологии, ортопедии и военно-полевой хирургии. История отечественной травматологии и ортопедии. История нашей кафедры. Социальные аспекты специальности. Классификация травм. Профилактика травматизма. Организация оказания травматологической помощи в России.
Время: 2 часа
Травматология. Trauma – повреждение, logos – наука. Это повреждение любых органов и систем от любых внешних воздействий.
До 1967 года в нашей стране травматология входила в состав общей хирургии и сводилась к лечению повреждений опорно-двигательной системы, то есть костей, суставов, связок.
В нашей стране только профессор Валентина Валентиновна Гориновская (ГИДУВ г. Москва, кафедра ВПХ институт СМП им. Склифосовского – заведующая травматологическим отделением) в 1937 году (!) опубликовала руководство «Основы травматологии», где изложила повреждение любых органов и систем от любых внешних воздействий. Эта книга была переиздана в 1953 году в двух томах. Но, когда в 1967 году был издан Приказ МЗ СССР о выделении травматологической помощи из общей хирургии, а это – создание травматологических и ортопедических отделений в республиках, регионах, в НИИ, кафедр травматологии и ортопедии при медицинских институтах и институтах усовершенствования врачей, то стали в большинстве городов страны создаваться клиники и отделения, занимающиеся лечением только повреждений ОДС.
Наша кафедра травматологии, ортопедии и ВПХ была создана 1 сентября 1968 года по приказу ректора института Георгия Викторовича Стовичека. На заведование кафедрой был приглашён д.м.н. Николай Константинович Митюнин (1920 – 1977 г.г.), который по окончании Пермского медицинского института в 1941 году был отправлен в действующую армию и всю ВОВ служил ведущим хирургом Мед СБ действующей армии Северо-Западного фронта. После окончания войны работал военным хирургом группы госпиталей ограниченного контингента войск в Германии, стал там кандидатом медицинских наук (его кандидатская диссертация посвящена остеосинтезу переломов спицами Киршнера), а потом он по конкурсу в 1960 г. был избран на должность заведующего травматологическим отделением Ленинградского НИИ скорой помощи им. И.И. Джанелидзе, где в 1966 году выполнил докторскую диссертацию по остеосинтезу переломов длинных костей стержнями из титановых сплавов прямоугольного сечения. Он хорошо знал любые повреждения как военно-полевой хирург, потому наша клиника, созданная вначале на базе травматологического отделения Ярославской железнодорожной больницы, а потом в КБ СМП им. Н.В. Соловьёва, с первых дней работы под руководством Н.К. Митюнина стала заниматься лечением больных с любым повреждением любых органов и систем, а не только травмой ОДС.
Поэтому наша клиника сейчас, имея 11 специализированных отделений в КБ СМП им. Н.В. Соловьёва, оказывает медицинскую помощь населению г.Ярославля и сельских районов с любым повреждением любых органов и систем.
Вот поэтому и руководство, написанное коллективом кафедры под моей редакцией, называется «Хирургия повреждений». Оно издано трижды в 1999г., 2004г. и 2013г. общим тиражом 11 тыс. 500 экз. Второе издание нашего руководства и будет вашим учебником при изучении травматологии.
Ортопедия - второй раздел нашей специальности. Это слово произошло из двух слов - orthos – прямой и pais - дитя. В 1741 г. французский профессор- хирург Andry издал книгу «Ортопедия как искусство предупреждения и исправления деформаций тела у детей средствами, доступными отцам и матерям и всем тем лицам, которым приходиться воспитывать детей». Andry и предложил эмблему новой специальности – кривое дерево, привязанное для исправления этой кривизны к прямой жерди. Эмблема Andry стала эмблемой травматологии и ортопедии во всех странах мира.
Очень хорошее определение ортопедии дал в начале прошлого века профессор Санкт-Петербургского ВМА Роман Романович Вреден - «Ортопедия является той отраслью хирургии, которая занимается изучением, профилактикой и лечением всевозможных деформаций конечностей и позвоночника, как врождённых, так и приобретённых в связи с различными паталогическими процессами и травмами».
В ортопедию входят:
- врождённые и приобретённые деформации ОДС у детей и взрослых (в том числе и послетравматические);
- костно-суставной туберкулёз;
- опухоли костей;
- обменные заболевания скелета;
- деформирующие артрозы;
- асептические некрозы.
И ещё одна составляющая нашей специальности, с которой мы должны познакомить Вас за четыре недели пребывания на нашей кафедре - это военно-полевая хирургия.
Военно-полевая хирургия – это лечение повреждений в условиях военных действий. Характер военных действий за последние десятилетия после Великой Отечественной войны 1941 – 1945 г.г. очень изменился, очень изменилась помощь раненым на этапах медицинской эвакуации. И мы непременно коснёмся этого в соответствующем разделе нашей лекции.
История развития ВПХ
Периоды развития ВПХ:
- допироговский,
- ВПХ времён Николая Ивановича Пирогова,
- создание и претворение в жизнь доктрины об этапном лечении с эвакуацией по назначению Владимиром Андреевичем Оппелем, проверка этой доктрины в годы ВОВ 1941-1945г.г.;
- послевоенные приобретения ВПХ;
- особенности ВПХ современных локальных воин.
Допироговский период
До конца 19 века характер боевых сражений позволял лечить раненых «на месте» (после окончания сражения). Методы лечения были примитивными. Эвакуация осуществлялась конными повозками без иммобилизации.
Летальность при огневых ранениях ≈ 80%.
Прогрессивной была установка главного хирурга французской армии Наполеона Жан Жака Лоррея выполнять ампутации при огнестрельных переломах конечностей на поле боя. Он создал передвижные операционные – амбулансы, и сам в сутки делал до 230 ампутаций.
В этот период надо отметить деятельность президента Санкт-Петербургской МВА Якова Васильевича Виллье (1766 – 1854 г.г.) , президент МВА 1808 – 1838г.г. – 30 лет.
Он разработал «Положение для временных военных госпиталей большой действующей армии (1812г.)».
Он предложил эшелонировать военные госпиталя (ВГ):
- ВГ первой линии – для нетранспортабельных и легкораненых,
- ВГ второй линии – для нуждающихся в длительном лечении, но могущих быть возвращёнными в строй,
- ВГ третьей линии – для «увечных, не подлежащих возвращению в строй.
Пироговский период
Н.И. Пирогов (1810 – 1881г.г.)
1841 – 1856г.г. возглавлял кафедру госпитальной хирургии МВА.
Принимал участие в военных действиях на Кавказе (1847г.), в Крыму (1851– 1856г.г.), во франко-прусской и русско-турецкой воинах.
Опубликовал ряд крупных научных трудов по организации и лечению раненых на войне. Главный из них - книга «Начала общей военно-полевой хирургии» 1865г. (на русском языке).
Деятельность Н.И. Пирогова была настолько многогранна, а научные достижения столь велики и значимы, что его по праву называют Гением русской медицины.
Очень хорошо об этом написал Н.В.Склифосовский: « …Народ, имевший своего Пирогова, имеет право гордиться. С этим именем связан целый период развития врачебноведения. Начала, внесённые в науку Н.В.Пироговым, останутся вечным вкладом и не могут быть стёрты со скрижалей, пока будет существовать русская наука, пока не умрёт... последний звук богатой русской речи».
Невозможно переоценить разработанные Н.И. Пироговым принципы сберегательного лечения, апробированные им в воинах того времени:
- он категорично возражал против зашивания огнестрельных ран;
- он отказался от ампутаций при огнестрельных переломах, а делал их только в случаях осложнений;
- экспериментально разработал и внедрил общее обезболивание в ВПХ (Кавказ, 1847г.);
- он с 1854 г. начал использовать гипсовые повязки для транспортной и лечебной иммобилизации;
- он оптимизировал технику многих известных оперативных вмешательств, его предложения в этом плане остаются классическими до сих пор – это оперативные доступы к артериям, это техника костно-пластических ампутаций стопы.
- большой вклад Н.И.Пирогов внёс во многие частные разделы ВПХ – подробно описал ранения черепа, груди, живота, таза, конечностей;
- ряд предложений Н.И.Пирогова по оперативной технике остаются классическими в хирургической практике до сих пор- оперативные доступы к артериям, это техника костно-пластических ампутаций стопы и др.
Особенно велики заслуги Н.И.Пирогова в формировании самого предмета ВПХ. Он создал научные основы ВПХ, обозначив три основные её особенности:
1-я – массовость санитарных потерь. Война – это травматическая
эпидемия;
2-я - важность организации помощи раненым: «не медицина, а
администрация медицинского обеспечения играет главную роль»;
3-я - главным инструментом этой организации является сортировка раненых с определением необходимого объёма медицинской помощи, её срочность и очерёдность, а также места оказания помощи.
Третий этап развития ВПХ связан с именем профессора Санкт-Петербургской ВМА Владимира Андреевича Оппеля (1872 – 1932 г.г.).
Это был разносторонний хирург, изучивший в боевых условиях все этапы ВПХ - в первую империалистическую он был хирургом передового отряда Красного креста, главным хирургом фронта, а потом членом Учёного Совета в военно-санитарном управлении.
В конце 19-го и начале 20-го века лечение раненых было в основном консервативным (господствовала теория Эсмарха и Бергмана о стерильности огнестрельных ран, преобладали (80-85%) пулевые ранения, потому возможно было заживление в ряде случаев без осложнений (конечно, не при огнестрельных переломах).
Но в 1-ю мировую войну изменился характер ранений. В 70 – 75% случаев они стали осколочными. Организация медицинской помощи не готова была к изменению существовавшей консервативной тактики лечения огнестрельных ран на активную. В дивизиях не было медицинских батальонов, где можно было бы оперировать раненых.
Во время первой мировой войны система этапного лечения по Оппелю не применялась. Главная причина этому - не было подготовленных врачей, инструментов и оборудования для создания хирургических отделений медсанбатов.
В.А. Оппель считал, что для успеха этапного лечения необходима специализированная помощь в армейском и фронтовом тылу. Он создал первую в стране кафедру ВПХ в ВМА. Она была открыта в 1931 г. Так была создана система подготовки военно-полевых хирургов в нашей стране. В 1940г. (уже после его смерти 1932г.) был издан объёмный труд В.А. Оппеля и его учеников «Очерки военно-полевой хирургии». Таким образом, под руководством В.А. Оппеля к началу ВОВ была создана система оказания помощи раненым в боях, система этапного лечения с организацией в медсанбатах этапа квалифицированной хирургической помощи, где выполняли операции по поводу огнестрельных ранений конечностей, груди, живота, таза, головы и др.
Созданная им система получила практическую проверку при боевых действиях на озере Хасан (1938г.), в Манжурии (1939г.), в советско-финской войне (1939 – 1940г.г.). и эффективность её была подтверждена опытом ВОВ. Число раненых, возвращённых в строй, составило 17 млн человек (численность Красной Армии в 1942г. – 3 млн 394 тыс., в 1945г. – 6 млн 700 тыс.).
Из этих цифр становится очевидным, что война была выиграна солдатами и офицерами, возвращёнными в строй после ранения медицинской службой.
Послевоенные приобретения ВПХ связаны с развитием хирургии и травматологии в нашей стране после Великой Отечественной войны 1941-1945г.г.
Это:
- антибиотики и успехи в лечении гнойной инфекции,
- успехи анестезиологии и реаниматологии,
- успехи комбустологической службы (пересадка кожи),
- успехи травматологии (внутренний остеосинтез и компрессионно- дистракционный остеосинтез),
- успехи микрохирургии и пластической хирургии.
Профилактика травматизма
В нашей стране много десятилетий тому назад была создана система профилактики травм, связанных с производством, - главный инженер предприятия, заместитель директора по технике безопасности, отдел техники безопасности. Каждый принимаемый на конкретное рабочее место получал обучение – инструктаж. Каждый случай производственной травмы рассматривался, наказывались виновные, выполнялись меры по предупреждению новых подобных травм.
Но в нашей стране нет до сих пор должной государственной системы профилактики травм, не связанных с производством и травм у детей. В 1983 г. при ЦИТО был создан комитет по профилактике травм, не связанных с производством и травм у детей. В областях были созданы при департаментах здравоохранения комиссии по предупреждению непроизводственных травм, в НИИ – отделы с полным штатным обеспечением (заведующий - д.м.н., старшие и младшие научные сотрудники).
Я входил во всесоюзный комитет. Мы собирались под председательством директора ЦИТО академика М.В.Волкова, обсуждали частные вопросы этой проблемы.
Мы у себя с ассистентом к.м.н. Евгением Владимировичем Зверевым решили принять участие в решении в этой проблемы. У нас все травмированные госпитализировались в одну нашу клинику – КБ СМП им. Н.В.Соловьёва.
Проанализировали за несколько лет причины получения населением травм, не связанных с производством, и пришли к выводу, что причиной травмы является травмоопасная ситуация, попав в которую человек получает травму (упал на гололёде и сломал руку или, отряхнувшись, продолжил свой путь).
Мы предложили разделить все травмоопасные ситуации на две большие группы.
Социальным пусковым механизмом первой группы травмоопасных ситуаций является то, что люди из-за дефектов воспитания, дефектов социального уклада жизни сознательно или бессознательно нарушают технику безопасности в быту. Этот социальный пусковой механизм является причиной 63% всех травм, не связанных с производством. Он порождает следующий травмоопасные ситуации, попав в которые человек получает травму:
- нарушений правил дорожного движения,
- вождение транспорта в состоянии алкогольного опьянения,
- нарушение водителями скоростного режима и знаков дорожного движения,
- драки, избиения и другие хулиганские действия,
- несоблюдение правил поведения на железной дороге,
- перелезание с балкона на балкон,
- ныряние на мелководье,
- нарушение техники безопасности в быту (строительные работы на дачах, использование электрических инструментов –пилы, фуганки и пр.).
Второй пусковой механизм – когда государство в лице имеющихся у него штатных служб не обеспечивает человеку безопасный быт и безопасную деятельность в быту. Второй пусковой инструмент порождает следующие травмоопасные ситуации, попав в которые человек может получить повреждения:
- гололедица на ступенях жилых домов и учреждений, на тротуарах и загородных дорогах,
- висящие с крыши сосульки и глыбы льда,
- плохое состояние автомобильных дорог(ямы), незакрытые люки;
- травмоопасные загородные трассы (безопасны только 10% всех трасс),
- травмоопасные детские и спортивные площадки,
- травмоопасная бытовая техника (газовые плиты),
- совмещённые балконы
и пр. и пр.
Второй социальный пусковой механизм является причиной 37% всех травм, не связанных с производством.
Существенной причиной растущего числа травм, не связанных с производством является то, что люди, виновные в возникших и имеющихся травмоопасных ситуациях, часто не наказываются. То есть до сих пор нет системы мер по предупреждению травм, не связанных с производством.
Травмоопасные ситуации обычной городской квартиры:
- английский замок во входной двери,
- линолеум в прихожей и кухне,
- половики и ковры в квартирах, где есть пожилые и старики,
- стекло в дверях между кухней и прихожей,
- отсутствие лестниц-стремянок, газовые горелки с открытым пламенем, совместные балконы, низкие их перила, плохие смесители в ваннах.
Третий этап – этап квалифицированной помощи травматологическим больным (ЦРБ)
В ЦРБ 50% больных хирургического профиля - это больные с травмой. 75% вызова хирурга вечером и ночью случается по поводу травм (А.Н.Капарулин, 2004г.). Вот почему один из хирургов ЦРБ должен иметь специализацию по травматологии. Он должен курировать травматологических больных в стационаре и вести травматологический приём в поликлинике 2-3 раза в неделю.
В ЦРБ, в котором нет травматологического отделения или травматологических коек и сертифицированного травматолога, могут находится те больные с травмой, которые нуждаются в недлительном лечении и не могут стать инвалидами. Это сотрясение и лёгкие ушиба головного мозга, повреждения голеностопного сустава, костей стопы, кисти, луча в типичном месте, хирургической шейки плечевой кости, не нуждающиеся в хирургическом лечении. Сюда же относятся травма кисти без повреждений сухожилий, раны без повреждений костей, сосудов, нервов, сухожилий, не проникающие в суставы; первичные вывихи (без перелома); переломы рёбер, не осложнённые повреждением лёгкого.
Конечно, хирург ЦРБ обязан выполнить операция ПХО раны вдавленного перелома черепа, резекционную трепанацию черепа при нарастающей компрессии мозга из-за внутричерепной гематомы.
Хирург ЦРБ должен выполнить операция по поводу ранения сердца, при большом и тотальном гемотораксе.
Хирург ЦРБ должен выполнить лапаротомию при кровотечении в живот, повреждении кишечника и желудка.
При открытых переломах выполняется туалет раны. Больной при изолированном повреждении отправляется скорой помощью на этап высокоспециализированной помощи, а если открытый перелом в составе политравмы, а больной нетранспортабелен, то к нему вызывается по санавиации травматолог из ортопедо- травматологического центра.
36% травматологических коек в России располагаются в районных больницах, где нет возможности оказать больным высокоспециализи-рованную травматологическую помощь (нет круглосуточной лабораторно-диагностической службы, нет КТ, нет в операционной ортопедического стола, нет электронно-оптического преобразователя, нет должных конструкций для остеосинтеза). Поэтому помощь травматолога-ортопеда на селе (ЦРБ, даже в травматологическом отделении) мы считаем этапом квалифицированной травматологической помощи.
Заведующий хирургического или травматологического отделения ЦРБ должен контролировать работу фельдшеров ФАП. Для этого рекомендуем метод доктора Дмитрия Леонидовича Соколова, работавшего в Мышкинской районной больнице с 1936 по 1953 год.
Суть метода. На карте района с обозначенными ФАПами и населёнными пунктами при госпитализации больного с травмой или острым хирургическим заболеванием и правильно оказанной помощью от ФАПа к ЦРБ проводится зелёная линия. Если помощь оказана неверно или больной с острым животом доставлен позже 12 часов после начала заболевания, то проводится красная линия, а на ней ФИО больного и суть ошибки. На дне фельдшера в ЦРБ (раз в месяц) хирург, имея час общения с фельдшерами (по часу другие заведующие отделениями), разбирает допущенные за месяц ошибки.
Тема 2
Методы лечения переломов
Время : 2 часа
При оказании помощи пострадавшему с переломом должна быть обеспечена неподвижность повреждённого сегмента – иммобилизация перелома.
Иммобилизация может быть транспортная (для транспортировки больного на этап специализированной помощи) и лечебная иммобилизация, обездвиживание перелома на этапе специализированной помощи, обеспечивающее его сращение и восстановление функций сломанного сегмента опорно-двигательной системы (ОДС).
Транспортная иммобилизация может быть осуществлена подручными средствами (обычно, при оказании первой помощи не медиками) и табельными средствами (при оказании первой помощи пострадавшему медицинскими работниками – бригадой СМП (в городах, районных центрах), фельдшерами ФАПов, врачами участковых больниц.
К табельным средствам транспортной иммобилизации относятся косынка; лестничные шины Крамера (большая и малая); шина Дитерикса (накладывается при высоких переломах голени, повреждениях коленного сустава, бедренной кости и тазобедренного сустава; лонгетная гипсовая повязка (она может быть наложена хирургом ЦРБ для транспортировки больного на этап специализированной помощи).
На практических занятиях вы должны изучить, как осуществляется транспортная иммобилизация переломов подручными средствами и табельными средствами и добуквенно записать в свою «Тетрадь сбора информации», как правильно наложить косынку, шинирование лестничными шинами переломов плеча, предплечья, голени, стопы и голеностопного сустава, и как наложить шину Дитерикса при повреждении коленного сустава, бедра и тазобедренного сустава.
Лечебная иммобилизация перелома осуществляется на этапе квалифицированной хирургической и травматологической помощи (ЦРБ) и специализированной помощи (ортопедо-травматологический центр). Она может осуществляться только на несколько дней – на период выведения пострадавшего из шока и подготовки его к операции. Это первичная лечебная иммобилизация. Она осуществляется гипсовыми лонгетными повязками, скелетным вытяжением (при переломах костей таза, бедра, голени, коленного и голеностопного суставов, переломов лопатки, плеча).
И лечебная иммобилизация может быть окончательная. Она осуществляется четырьмя основными методами лечения переломов – гипсовыми и ортезными повязками, постоянным скелетным вытяжением, внутренним остеосинтезем и внешним остеосинтезем.
Разберём эти методы.
Лечение переломов гипсовыми и ортезными повязками
Лечение переломов ортезными повязками использовалось с незапамятных времён. Гиппократ (ΙѴ век до нашей эры) для этой цели применял полоски сухой кожи, тонкие дощечки, полоски свинца. После закрытой репозиции перелома они фиксировались к сломанному сегменту конечности материей – бинтом. Не надо полагать, что эти древние повязки были примитивными.
В 1851 году голландские врачи Матиссен и Ван де Лоо для внешней накожной иммобилизации перелома предложили гипсовые повязки. в 1854 году Н.И. Пирогов в военно-медицинском журнале опубликовал статью об использовании гипсовых повязок на театре военных действий для транспортной и лечебной иммобилизации переломов. Гипсовые повязки много десятилетий широко были распространены в Европе и Америке.
Один из выдающихся довоенных советских хирургов С.С. Юдин (главный хирург Московского института скорой помощи им. Н.В. Склифосовского) рекомендовал глухие гипсовые повязки накладывать после операции первичной хирургической обработки огнестрельных переломов. В книге «лечение огнестрельных переломов бедренной кости», изданной в декабре 1941 г. и посвящённой защитникам Москвы, он во введении написал следующие слова: «В медицине часто бывает, что позабытый способ лечения при улучшенной технике и обновлённых показания начинает давать результаты, о которых прежде можно было только мечтать».
И сегодня военные хирурги при лечении огнестрельных переломов широко используют гипсовые повязки.
Постоянное вытяжение
Постоянное вытяжение было предложено для лечения переломов костей конечностей американскими хирургами братьями James 1837г. В этом году они опубликовали статью об успешном лечении 162 больных с переломами бедренной кости накожным вытяжением за голень и бедро липким пластырем (нарисовать на доске рисунок).
Повреждённая конечность подвешивается на матерчатых петлях к надкроватной раме.
Метод братьев Джеймс быстро распространился в Европе, особенно в Германии. Немецким профессором Бандергейером была издана монография о лечении переломов лейкопластырным вытяжением, которая была переведена на русский язык в 1889г. (она есть в нашей областной медицинской библиотеке).
В этой книге сформулированы пять основных принципов лечения переломов постоянным вытяжением:
1. Положение конечности на вытяжении должно быть среднефизиологическим (сгибание в ТС и КС 140°), лёгкое (10°) подошвенное сгибание стопы. Среднефизиологическое положение расслабляет мышцы-антагонисты и этим обеспечивает репозицию перелома.
2. Покой конечности, она должна быть подвешена к надкроватной раме на полотняных петлях.
3. Противопоставление периферического отломка центральному, для этого надо знать типичные смещения центрального отломка. Например, при высоком переломе бедренной кости центральный отломок отклоняется в наружную сторону, потому конечность должна быть отведена кнаружи.
4. Противовытяжение. Оно осуществлялось во всём мире поднятием ножного конца кровати на 30 – 70 см (!). Такое положение больного вниз туловищем и головой обеспечивает противовытяжение, способствует репозиции перелома и предупреждает стягивание больного грузами к ножному концу кровати.
5. Постепенность нагрузки, она обеспечивает постепенную релексацию мышц повреждённого сегмента. По физиологическому закону Вебера-Фехнера поперечно-полосатая мышца человека «различает» изменения нагрузке, равные 1/16 величины груза. Это значит, что при грузе 16 кг мышца заметит разницу большую 1 кг.
Накожное вытяжение имело два больших недостатка – трофические раздражения кожи под липкопластырными тягами и эти тяги часто срывались при использовании больших грузов.
Поэтому революционным в постоянном вытяжении было предложени6е немецкого профессора-травматолога Штеймана (Schteimann) в 1907 г. скелетного вытяжения за специальный 9 мм по диаметру гвоздь и надетую на него скобу. гвоздь Штеймана был остро заточен. Его забивали молотком через губчатую кость нижнего метафиза бедренной кости (при переломе бедра) или через пяточную кость (при переломе голени). К скобе через роликовый блок подвешивался груз до 25 кг.
Однако пробивание такого гвоздя было травматичным. Поэтому следующим этапом развития техники вытяжения стало предложение немецкого травматолога Киршнера (Kirschner) в 1913г. вместо гвоздя проводить через кость стальную спицу  2,5 мм, натягивать её в скобе так, что при подвешивании груза до 25 кг она не прогибалась. Спица проводилась специальной ручной дрелью.
2,5 мм, натягивать её в скобе так, что при подвешивании груза до 25 кг она не прогибалась. Спица проводилась специальной ручной дрелью.
В России постоянное вытяжение было внедрено в Харькове директором института травматологии Карлом Фёдоровичем Вагнером в 1907г. Там использовали классическое вытяжение, разработанное в Германии – при переломе бедра скелетное за мыщелки бедренной кости и клеевое за голень, при переломе голени – скелетное за пяточную кость и клеевое за бедро. Ногу подвешивали на трёх полотняных петлях-гамаках к балканской раме – за бедро, голень и стопу.
Такое вытяжение было многопредметным – для его осуществления требовались до 95 деталей. Оно ещё называлось свободным, так как нога покоилась на гамаках, подвешенных к надкроватной раме. В Харьковском НИИ травматологии и ортопедии было издано три монографии, посвящённых постоянному вытяжению – в 1940г.,1960г. и 1972г., авторы Н.П.Новаченко и Ф.Е.Эльетберг.
Немецкий травматолог профессор Белер (BÖhler) сконструировал для лечения вытяжением переломов бедра и голени шину, которая используется травматологами до сих пор – её называют шиной Белера.
В истории постоянного скелетного вытяжения надо непременно сказать о профессоре Н.К. Митюнине, который предложил демпферировать системы постоянного вытяжения стальными пружинами – демпферами, шарикоподшипниковыми блоками и капроновой леской.
В 1968г., уже будучи заведующим нашей кафедра, он дал доценту В.В.Ключевскому тему докторской диссертации, посвящённую совершенствованию постоянного скелетного вытяжения. Она была защищена в феврале 1975г. в г. Санкт-Петербурге. В этой диссертации В.В.Ключевский, записывая на потенциометр колебания силы вытяжения, доказал необходимость демпферирования систем постоянного вытяжения стальными пружинами, капроновой леской вместо хлопчатобумажных шнуров и шарикоподшипниковыми блоками вместо роликовых. Если в «жёстких» системах эти колебания были больше силы вытяжения в 2-3 раза, то-есть были надпологовыми, то в демпферных системах они были меньше порога различения поперечно-полосатой мышцы человека. Постоянство силы вытяжения позволяло репонировать отломки меньшими по величине грузами.
Мы унифицировали системы вытяжения, исключив вспомогательное накожное вытяжение. Для создание любой системы вытяжения при различных по локализации переломов теперь требовалось не более 8-9 деталей.
В диссертации В.В.Ключевский доказал, что поднятие ножного конца кровати для противовытяжение нефизиологично для больного и трения больного о постель при использовании демпферных систем достаточно для противовытяжение. Летальность пожилых и стариков при лечении вытяжением переломов верхнего отдела бедренной кости уменьшилась в 4 раза.
Устранение смещений отломков по ширине боковыми вправляющими петлями В.В. Ключевским было заменено боковым скелетным вытяжением за ступенеобразно изогнутые спицы (Block и Růkert, 1934г.).
Была исключена возможность смещения спиц и нагноения мягких тканей из-за этого вытяжением за две спицы со штыкообразными изгибами.
Скелетное вытяжение с нашими совершенствованиями его изложено в двух монографиях и в главах 3-х изданий руководства «Хирургия повреждений». Шины с демпферными устройствами выпускаются индустриально.
За последние 10 лет постоянное скелетное вытяжение используется в отечественных и зарубежных клиниках как средство первичной лечебной иммобилизации переломов. Как самостоятельный метод лечения переломов оно не применяется из-за длительности лечения вытяжением (от4 до 8 недель) и необходимости завершения его клинической глухой гипсовой повязкой со всеми её отрицательными сторонами, превращающими его в нефункциональный метод.
Но до сих пор оно широко применяется как метод первичной лечебной иммобилизации на период подготовки больного к операции остеосинтеза.
В огромных по территории северных и восточных регионах России есть организационные трудности транспортировки больных с переломами длинных костей (плечо, бедро, голень) на этап специализированной помощи для оперативного лечения. Поэтому в нашем последнем руководстве «Протоколы диагностики и лечения пострадавших с изолированными механическими повреждениями и политравмой на этапах медицинской эвакуации в Ярославской области», Ярославля, 2017 – 2018г.г. мы даём протоколы лечения вытяжением на этапе квалифицированной и хирургической и травматологической помощи (ЦРБ) переломов диафиза плечевой кости, вертельных переломов и переломов костей голени. Но необходим передвижной рентгеновский аппарат для выполнения снимков на вытяжении в палате.
Внутренний остеосинтез
Он осуществляется стержнями, пластинами и винтами.
История внутреннего остеосинтеза переломов начинается с 1862 года, когда американский хирург Гайланд (Gailand) выполнил остеосинтез несросшегося перелома бедренной кости круглым полым стержнем из нержавеющей стали. Он рассверливал костные каналы отломков по диаметру стержня.
Большой вклад в историю внутреннего остеосинтеза внесли немецкие ортопеды, в частности Кюнгер (Künther).
Революционным в мировой травматологии и в Советском Союзе было предложение профессора Н.К. Митюнина внутренний остеосинтез выполнять стержнями прямоугольного сечения из титановых сплавов ВТ1, ВТ2, ВТ5, ВТ6. Он на эту тему защитил в 1966 году докторскую диссертацию.
Основные принципы остеосинтеза переломов длинных костей титановыми стержнями прямоугольного сечения по Митюнину:
1. Стержень прямоугольного сечения заклинивается своими острыми гранями в стенках костного канала отломков, обеспечивая многоточечную фиксацию перелома, поэтому костный канал рассверливать не надо (как это предложил Кюнгер).
2. Стержень должен быть проведён на максимальную длину отломков, чтобы концы его заклинивались в метафизах и мелкоячеистой прочной кости эпифиза. Потому длина стержня определяется хирургом на операции из унифицированной по длине заготовки.
3. Для остеосинтеза переломов используются заточенные должным образом концы стержней и моделированные тяги, чтобы при ретроградном их вбивании они выходили из кости в нужной для хирурга точке.
4. Стержень должен быть моделирован в соответствии с физиологической кривизной кости (бедренная кость, плечевая в н/3, лучевая - физиологическая варусная кривизна).
5. Для фиксации переломов выше и ниже места равномерного сужения костной трубки (истмус) надо использовать два-три плоских стержня прямоугольного сечения с их разведением.
6. При остеосинтезе надо очень бережно относиться к надкостнице и мышцам – не обдирать их от кости. Это теперь называют «биологичный остеосинтез». Самый биологичный – это закрытый остеосинтез, когда место перелома не обнажается. Сейчас это возможно для почти каждого больного, так как стержни вводят антеградно под контролем ЭОПа.
После Н.К. Митюнина мы продолжили его направление по остеосинтезу титановыми стержнями прямоугольного сечения - это докторские диссертации Г. А. Суханова, Е.В.Зверева, И.И.Литвинова, кандидатские диссертации А.А.Дегтярёва, А.Д.Джурко, И.Н.Соловьёва, С.М.Сметанина, А.Г, Разанкова, А.А.Рыжкина и др.
В настоящее время травматологи всего мира ( и в России) при остеосинтезе переломов пользуются технологиями и констукциями ортопедов швейцарской ассоциации (АО/АSIF), отработанной до мелочей за последние 50 лет.
Заключение
И так, при лечении переломов в настоящее время применяются:
- внутренний внутрикостный и накостный остеосинтез,
- внешний компрессионно-дистракционный остеосинтез,
- скелетное вытяжение,
- ортезные изделия и повязки.
Внутренний остеосинтез стержнями, пластинами и винтами имеет несомненные преимущества перед другими методами, так как позволяет при правильном его использовании добиться полной репозиции (устранения смещения по длине, углового и ротационного смещения отломков длинных костей без обнажения торцов отломков и осколков) и биологичной фиксации при переломах диафизарных сегментов длинных костей. Этот метод усилиями швейцарской ассоциации ортопедов (АО/АSIF - ассоциация ортопедов / ассоциации изучения внутренней фиксации) с начала 50-х годов прошлого столетия широко применяется в экстренной травматологии и во всём мире и в том числе в России и странах СНГ.
Во многих странах мира созданы предприятия, выпускающие конструкции АО/АSIF (в том числе и в России – Казань, Москва, Рыбинск).
Однако метод внутреннего остеосинтеза требует хорошей подготовки специалиста ортопеда – травматолога. Для этой цели ассоциация АО/АSIF во многих странах мира организовала повторяющиеся первичные и закрепляющие курсы с завершением изучения этому методу в научно-практическом центре АО/АSIF в г. Даосе, Швейцария.
Метод обеспечивает высокую эффективность при соблюдении технологии его выполнения во всех мелочах и деталях. В Ярославле все травматологи ортопеда – травматологического центра прошли необходимое обучение и имеют сертификаты, позволяющие им использовать метод внутреннего остеосинтеза.
Этот метод в случае осложнений (главным образом инфекционных) является причиной остеомиелита и несращения перелома.
Метод внешнего остеосинтеза компрессионно–дистракционными аппаратами (спицами по Илизарову и стержнями) в экстренной травматологии широко используется как первичная лечебная иммобилизация в случае открытых переломов, особенно при большой зоне разрушения мягких тканей и кости, при множественных и сочетанных повреждениях, осложнённых тяжёлым шоком.
Метод внешнего остеосинтеза широко используется в ортопедии при лечении гнойных осложнений (посттравматический остеомиелит), несращения и костных дефектов.
Этот метод также требует длительного детального изучения (лучше в таких учебных центрах как Курганский НИИ, Санкт-Петербургский НИИ, Екатеринов-градский НИИ). Больные при использовании этого метода нуждаются в пристальном наблюдении оперировавшего их врача. Это наблюдение должно осуществляться или в стационаре, или в дневном стационаре для жителей населённого пункта, где развёрнуто это ортопедическое отделение.
Метод постоянного скелетного вытяжения по-прежнему широко используется как первичная лечебная иммобилизация изолированных переломов длинных костей, осложнённых лёгким шоком и шоком средней степени тяжести на период подготовки больного к операции (5-12 дней) или к эвакуации с этапа квалифицированной помощи (ЦРБ) в специализированное травматологическое отделение.
Этот метод прост в изучении и применении. В некоторых случаях (нежелание больного лечиться в другом городе; сопутствующие заболевания не позволяют его оперировать) скелетное вытяжение может быть использовано и как окончательный метод. Но в отделении, где лечится больной, должен быть передвижной рентгеновский аппарат.
И, наконец, лечение переломов ортезными повязками и ортезными изделиями. Этот метод имеет самую древнюю историю. С 1851 г. (год разработки гипсовых повязок) он широко использовался в травматологии при лечении свежих переломов, при лечении открытых и огнестрельных переломов, как средство внешней иммобилизации перелома после лечения его скелетным вытяжением или после выполнения некорректного остеосинтеза. Несколько поколений хирургов и травматологов (за 150 лет – с 1851г. по 2000г.) широко применяли гипсовые повязки при лечении внутрисуставных и внесуставных переломов.
Внедрение внутреннего остеосинтеза стержнями и пластинами, внедрение внешнего остеосинтеза спицевыми и стержневыми аппаратами в конце 20 и начале 21 века значительно сузило показания к использованию гипсовых повязок. Они применяются в амбулаторной травматологии (переломы мелких костей кисти и стопы, некоторые переломы лучевой кости в типичном месте и некоторые повреждения голеностопного сустава), как средство первичной лечебной иммобилизации закрытых изолированных и нетяжёлых сочетанных переломов (плечо, предплечье, голень), как средство первичной лечебной иммобилизации после скелетного вытяжения и корректного остеосинтеза.
На смену гипсовым повязкам всё шире и шире внедряют современная ортезотерапия – использование индустриальных и индивидуально изготовленных ортезов из современных материалом. Метод пока культивируется на протезно-ортопедических предприятиях. Мы пока ещё плохо знаем, а потому недооцениваем современную ортезотерапию, вновь пришедшую к нам взамен гипсовых повязок.
Тема 3
Политравма. Системные патологические процессы при травмах – шок и кровопотеря, жировая эмболия, травматический шок и кровопотеря. Повреждение груди, живота и таза при политравме. Синдром длительного сдавливания.
Время: 4 часа
Политравма – это сочетание у пострадавшего таких повреждений, каждое из которых могло быть причиной его нетрудоспособности.
Классификация политравм:
- множественные повреждения – два и более сегмента ОДС (сегменты руки - плечевой сустав, плечо, локтевой сустав, предплечье, лучезапястный сустав, кисть; сегменты ноги – тазобедренный сустав, бедро, коленный сустав, голень, голеностопный сустав, стопа, таз; позвоночник – шейный, грудной и поясничный отделы); два и более внутренних органов одной анатомической области;
- сочетанные повреждения - один и более сегмента ОДС + один и более внутренних органов двух и более анатомических областей или один и более внутренних органов двух и более анатомических областей;
- комбинированные повреждения – от действия двух и более различных по механизму повреждающих факторов.
Политравмы бывают при ДТП, падении с высоты (кататравма), при обвалах (землетрясения, аварии в шахтах), при избиении.
Патогенез шока
Первое место в патогенезе шока занимает циркуляторная недостаточность из-за кровопотери.
Компенсацию гиподинамики при шоке обеспечивают стресс-гормоны. Это в первую очередь адреналин. Он увеличивает сократительную функцию миокарда и обеспечивает централизацию кровообращения при шоке. В компенсации гемодинамики при шоке оказывают также влияние АКТГ, ангиотензин, альдостерон и др.
Гемодинамические нарушения при шоке проявляются как в системе макроциркуляции, так и как в системе микроциркуляции (это сосуды в диаметре менее 100 микрон). В крупных сосудах синдром гипоциркуляции развивается по следующему сценарию - в ответ на прогрессирующий дефицит ОЦК возникает артериальная и венозная гипотензия, возрастает число сердечных сокращений, увеличивается, а затем падает периферическое сопротивление - тотальная капилляропатия – патологическое депонирование крови.
Изменение микроциркуляции развивается фазно. Вначале происходит спазм артериол и прекапилярных сфинктеров в нежизненно важных органах – кожа подкожная клетчатка, мышцы, кости. Это способствует шунтированию крови по артерио-венозным шунтам и обеспечивает кровоснабжение жизненно важных органов – сердца, лёгких, мозга, печени, почек и кишечной стенки. Это и есть централизация кровоснабжения.
Но централизация кровоснабжения долго продержаться не может. Истощаются стресс-гормоны. Нарастает гипоксия нежизненно важных тканей, снимается спазм артериол, открываются прекапиллярные сфинктеры, развивается паралич венул. Капиллярное русло нежизненно важных органов переполняются кровно. Это ещё более уменьшает ОЦК. Децентрализации кровообращения приводит к падению max АД, ещё большему учащению пульса.
В капиллярах развивается внутрисосудистое свёртывание крови, проявляющееся агрегацией (склеиванием) форменных элементов крови, прогрессирует гипоксия всех тканей, переходящая в их некробиоз. Смерть клеток тканей обусловливает необратимость шока. Необратимый шок наступает, если АД ниже критического уровня остаётся на 2 и более часов.
Патофизиологи различают 2 фазы течения клока эректильную (возбуждения) и торпидную (торможения).
Никто из клиницистов никогда не видел эректильную фазу травматического шока человека. Поэтому считаю, что можно о ней и не говорить.
Торпидный шок мы делим на фазу скрытой декомпенсации (или шок I степени тяжести), когда PS не чаще 100 в минуту, max АД не ниже 100 мм рт.ст., почки больного фильтруют мочу, состояние больного средней степени тяжести и фазу явной декомпенсации, когда PS чаще 100 в минуту, max АД ниже 100 мм рт.ст., состояние больного тяжёлое.
Фаза явной декомпенсации делится на:
шок средней степени тяжести, когда PS чаще 100, но реже 120 в минуту, АД ниже 100 мм рт.ст., но больше критического, почки фильтруют мочу, состояние больного тяжёлое;
шок тяжёлый - PS чаще 120 в минуту, max АД ниже критического, почки не фильтруют мочу, состояние больного крайне тяжёлое. Он бледен, дыхание учащено, поверхностное, сознание спутанное периферические отделы конечностей холодные;
и, наконец, шок терминальный – PS и АД на периферии не определяются. Термальный шок проявляется тремя периодами -
предагония - дыхание ритмичное, агония - дыхание аритмичное и остановка дыхания и сердца - клиническая смерть .
Обратите внимание, что фаза явной декомпенсации и три её степени тяжести - шок средней тяжести, тяжёлый и терминальный шок имеют чёткие критерии.
Наоборот, их нет в фазе скрытой декомпенсации.
Мы предлагаем, и это доказано в докторской диссертации нашего сотрудника К.А.Гураля (2007г.), критерием фазы скрытой декомпенсации (так называемый «лёгкий шок») считать кровопотерю более 10% ОЦК. А это - изолированные переломы позвоночника, перелом таза, бедренной кости (и вертельной у людей пожилого и старческого возраста), костей голени плечевой кости и, конечно, любая политравма (множественные переломы и сочетанные повреждения). Изолированные травмы таза, позвоночника, бедра, костей голени и плеча тем более надо относить к фазе скрытой декомпенсации, поскольку при них больным часто не оказывается должная первая медицинская помощь (ФАП, здравпункт, бригада скорой помощи) - часто не осуществляется корректная транспортная иммобилизация (особенно при переломах бедра и плеча) и не производится совсем инфузионная терапия.
И ещё одна причина скрытого течения шока у больных с политравмой (а это кататравма, ДТП, избиение) - это часто сопутствующие политравме повреждения мозга (у 65 - 67,5 пострадавших с политравмой). Травма мозга маскирует шок. Максимальное АД при травме мозга не снижается часто ниже 100 мм рт.ст.!!!
Клиника фазы скрытой декомпенсации шока:
- кожные покровы обычной окраски или бледные,
- сознание ясное, если нет сопутствующей ЧМТ,
- дыхание не учащено,
- дистальные отделы конечностей или обычной температуры или холодные. Температурный показатель шока (Т прямой кишки всегда больше температуры тыла первого пальца стопы возле ногтевого ложа не более чем на 5°, при шоке эта разница больше 5°. В приёмном покое должен быть медицинский электротермометр.).
- Пульс обычной частоты или учащённый до 100 в минуту.
- Максимальное АД более 100 мм рт.ст.
- У всех пациентов через 6 часов после травмы имеет место стресс- реакция - изменение индекса л/с (отношение количества лимфоцитов к числу сегментоядерных нейтрофилов). В норме этот показатель 0,5 - 0,7. В фазе скрытой декомпенсации он менее 0,5 и даже 0.3 .
У детей и лиц пожилого и старческого возраста травматический шок протекает тяжелее.
Маскируют шок:
- травма черепа и мозга,
- алкогольное и наркотическое опьянение.
Шок имеет свои особенности клинического течения и проявления:
- при травме черепа и мозга;
- при открытом и закрытом повреждении груди (открытый пневмоторакс, закрытый клапанный и напряжённый пневмоторакс, гемоторакс, пульманит, ателектаз лёгкого, ушиб сердца, синдром сдавливания груди);
- при открытых и закрытых повреждениях живота с кровотечением в брюшную полость и (или) повреждением полых органов живота - нарастающая интоксикация из-за присоединяющегося перитонита;
- при переломах заднего полукольца таза (большая кровопотеря, нарастающая); большая забрюшинная гематома (парез кишечника!);
- при сопутствующих перелому длинных костей повреждениях магистральных сосудов - компенсированная ишемия переходит в декомпенсированную и присоединяется интоксикация;
- при синдроме длительного давления конечностей (интоксикация и большая плазмопотеря после освобождения).
Кровотечения
Остановка наружного кровотечения :
- наложение давящей повязки,
- жгута,
- тампонада раны с зашиванием кожи над тампоном,
- лигатура или зажим на сосуда в ране
- временное шунтирование (только бедренной артерии и плечевой
артерии).
Остановка внутреннего кровотечения:
- торакотомия при большом и тотальном гемотораксе,
- лапаротомия при кровотечении в живот,
- фиксация таза стержневым аппаратом,
- лапаротомия и тампонада полости малого таза при переломах таза и неэффективности аппарата внешней фиксации.
Лечение боли
1. Анальгетики и наркотики (но нельзя при тяжёлом шоке, при тяжёлом шоке нельзя вводить 1% новокаин в зону перелома, max доза 1% раствора новокаина 100 мл-1,0),
2. Иммобилизация. Она может быть:
1) транспортная (подручные и табельные средства),
2) первичная лечебная (гипсовые лонгеты, постоянное вытяжение, аппараты внешней фиксации, щиты для внутрибольничной транспортировки больных);
3) окончательная лечебная (гипсовые и ортезные повязки, скелетное вытяжение, внутренний остеосинтез, внешний остеосинтез);
4) щиты для внутрибольничной транспортировки больных.
При госпитализации пострадавших на этап специализированной или квалифицированной помощи не надо спешить с заменой транспортной иммобилизации, если она корректно выполнена табельными средствами (шины Крамера, шина Дитерикса) на первичную лечебную (гипсовыми лонгетами, постоянным вытяжением или аппаратами внешней фиксации). Надо начать инфузионную терапию шока, а через несколько часов под в/в обезболиванием выполнить первичную лечебную иммобилизацию.
Синдром сдавления груди (ССГ)
Возникает при сильном одномоментном сдавлении груди между двумя плоскостями. Обычного, при этом имеются множественные переломы рёбер.
В патогенезе ССГ лежит резкий подъём давления в верхней полой вене и возникающими из-за этого кровоизлияниями в бассейне верхней полой вены. Они и обуславливают клиническую картину ССГ.
Кровоизлияния в венулы и капилляры кожи дают симптом травматичной синюхи – лицо, шея и верхняя половина груди синюшные, конъюнктивы глаз ярко-красные, отёчные и выстоят из глазной щели.
Кровоизлияния в слизистую глотки, трахеи и бронхов дают кровохаркание и осиплость голоса.
Кровоизлияния в мозговые оболочки - симптомы их раздражения. Кровоизлияния в вещество мозга – рассеянную корковую симптоматику. Кровоизлияния в продолговатый мозг может быть причиной внезапной остановки сердца и дыхания (18-летний тракторист в г. Галиче).
Лечении ССГ симптоматическое с обязательным подключением гормональных препаратов.
Разрывы диафрагмы (РД)
При закрытой травме груди. Чаще рвётся левый купол диафрагмы, так как он не защищён печенью. Правый купол страдает много реже. Обычно он отрывается от грудной стенки. Печень смещается в правую плевральную полость.
Разрывы диафрагмы могут быть при любой закрытой травме груди. Но их всякий раз надо исключать, если сломаны 5-е и ниже рёбра, если есть осаднение кожи над нижними отделами груди («знак травмы»).
При разрыве левого купола диафрагмы полые органы живота (желудок, кишечник) часто выходят в левую плевральную полость. При отрыве правого купола – печень.
Признаки разрыва диафрагмы:
- знак травмы,
- учащение дыхания,
- укорочение перкуторного звука в нижних отделах плевральной полости, ослабление дыхания при аускультации, выслушивание в нижних отделах груди перистальтики кишечника;
- на рентгенограмме груди – затемнение нижних отделов плевральной полости, газовые пузыри на фоне затемнения.
Разрыв паренхимы лёгкого и пневмоторакс могут быть причиной появления серпа газа под правым куполом диафрагмы, если повреждён левый.
Можно дать больному выпить немного бария. И он будет виден на RÖ –грамме груди в левой половине её.
Позволяют поставить диагноз лапаротомия, КТ и УЗИ.
Лечение разрыва диафрагмы
Оторванный правый купол подшивается к грудной стенке. Для этого выполняется торакотомия.
При разрыве левого купола диафрагмы выполняется верхняя срединная лапаротомия. Органы живота, выпавшие в плевральную полость, вправляются в живот. Диафрагма зашивается отдельными швами. Выполняется ревизия органов брюшной полости. Дренирование плевральной полости. Зашивание живота.
Открытые повреждения груди
В этой лекции я остановлюсь на ранениях межрёберных и внутренних грудных артерий, и ранениях сердца.
Уже в начале лекции я сказал, что большой и тотальный гемоторакс бывают только при ранениях межрёберных артерий или внутренней грудной артерии.
Клиника большого и тотального гемоторакса:
- синдром кровопотери,
- симптомы накопления жидкости в плевральной полости: укорочение перкуторного звука, отсутствие дыхания или резкое ослабление его спереди и отсутствие дыхания сзади,
- на RÖ –грамме груди затемнение плевральной полости до 3-го ребра
или тотальное, смещение сердца и средостенья в противоположную
сторону.
Кровотечение из сосудов грудной стенки останавливается лишь при большой кровопотере и падении АД из-за этого до 70-60 мм рт.ст. поэтому часто бывает, что хирург, вскрыв плевральную полость и осушив её, не находит источник кровотечения, дренирует плевральную полость и зашивает торакотомную рану. Когда в ответ на инфузионную терапию max АД поднимается до 100 и выше, то тромб из повреждённой артерии выталкивается и кровотечение вновь возобновляется.
В книге «Хирургия повреждений» приведены наблюдения таких ошибок.
Рассказать, как правильно сделать торакотомию, чтобы не повредить a.thoracicа int и a. Intercostal is.
Ранения сердца
Они могут быть всякий раз, если рана расположена в опасной зоне груди – сверху ключицы, по бокам передние подмышечные линии и внизу рёберные дуги. Особо опасны раны в проекции сердца и по парастернальным линиям.
Ранения сердца часто сопровождаются тампонадой его, когда в полость перикарда изливается 150-250 мл крови, а рана перикарда маленькая и закрыта сгустком крови. Кровопотери смертельной нет, но больной погибает от остановки сердца из-за тампонады скопившейся в перикарде кровью.
У 50% пострадавших рана сердца не проникает в его полость, ног при развившейся тампонаде кровотечение из него останавливается. Поэтому только пункция перикарда и устранение тампонады достаточно для спасения жизни пострадавшему.
Клиника тампонады сердца:
- состояние тяжёлое, лицо синюшное, вены шеи раздуты,
- рана в опасной зоне груди, а особенно в проекций сердца,
- не пальпируется верхушечный толчок (!),
- при перкусии сглажена тали сердца и расширена правая граница его,
- пульс частый, слабого наполнения, АД меньше 100 мм рт.ст.,
- глухость тонов,
- расширение вен шеи, изменения на ЭКГ,
- RÖ груди – трапециевидная тень сердца (нарисовать).
Если состояние больного крайне тяжёлое (пульс за 100, АД ниже 70-60 мм рт.ст.) и рана расположена в опасной зоне груди или в проекций сердца, то без рентгенограммы груди , без ЭКГ выполняется немедленная торакотомия в 5-м межреберье (не более 5 минут с момента пересечения порога приёмного покоя).
Техника операционного вмешательства по поводу ранения сердца добуквенно написана в книге «Хирургия повреждений».
Жировая эмболия (ЖЭ)
ЖЭ - одно из самых грозных осложнений шока. Морфологически она проявляется множественной закупоркой жира артериол и капилляров, а клинически - универсальной гипоксией мозга и других тканей.
Она бывает при неадекватном восполнении тяжёлой кровопотери при множественных переломах и политравме (по нашему убеждению) при непроведении должной инфузионной терапии тяжёлого шока.
В последние годы, когда стали проводить инфузионную терапию всем с возможной кровопотерей более 10% ОЦК, мы это осложнение видим редко.
По данным литературы клинические проявления ЖЭ имеют место у 1 – 2% пострадавших с травмой.
На вскрытии у пострадавших обнаруживают отёк лёгких со множественными кровоизлияниями под плеврой, эмфизему и ателектазы. На разрезе из лёгких вытекает пенистая кровянистая жидкость.
Многими авторами термины: респираторный дестресс-синдром взрослых (РДСВ), «шоковое лёгкое» и синдром жировой эмболии (СЖЭ) используют как взаимозаменяемые.
Л.Ашофф(L. Aschoff) в 1893 году сформулировал механическую теорию жировой эмболии - капли жира из мест повреждений попадают в просвет вен, далее в сосуды лёгких, а если есть незаращение межпредсердной перегородки - в сосуды большого круга кровообращения. Возникает молниеносная форма ЖЭ.
Е.Кронке (Е. Kronke) в 1953 году выдвинул ферментативную теорию жировой эмболии, согласно которой жировые эмболы из костного мозга активируют сывороточную липазу, которая превращает липиды крови из тонкодисперсной эмульсии в грубые капли, закупоривающие артериолы и капилляры. Этому способствует нарушения химизма крови при шоке. Поэтому правы анестезиологи и реаниматологи (А. Ю. Пащук и Н.А.Фаддеев), считая, что ЖЭ – это проявление нелечёного или плохо лечёного шока.
Кстати, ранее мы часто видели это осложнение именно у таких больных.
Очень интересное исследование на огромном материале клиники ВПХ ВМА им. Кирова (С-Петербург) выполнил М.Б. Борисов (2001г.)
На 1817 больных с тяжёлой механической травмой ЖЭ имела место у 2,4%.
На 151 больного изолированной травмы ЖЭ имела место у 1,2%, на 812 пострадавших с сочетанной травмой – у 5,1%.
По данным М.Б. Борисова (2001г.) риск ЖЭ увеличивается при переломах двух и более сегментов скелета, повреждениях скелета и тяжёлой травме лёгкого; при тяжёлых переломах костей таза, переломах скелета и челюстно-лицевой травме (!).
Риск ЖЭ увеличивается при длительной гипотонии (АД ниже 90 мм рт.ст.), когда величина кровопотери превышает 1,5 литра; когда пострадавшие доставляются с плохой транспортной иммобилизацией переломов.
Клиника ЖЭ
- развивается в первые 2-3 суток после травмы,
- дурашливость (гипоксия мозга),
- высокая t° (39° и более),
- тахикардия (PS 120 и более в минуту),
- нарастающая дыхательная недостаточность,
- на RÖ снимках лёгких симптом нарастающего отёка - «снежная буря», на ЭКГ признаки ишемии,
- снижение числа тромбоцитов.
Больные с жировой эмболией лечат в отделении реанимации.
Лечение СДС
Догоспитальный этап:
- закрытый массаж сердца,
- искусственная вентиляция лёгких,
- остановка наружного кровотечения.
- устранение боли. Очень важно добиться обезболивания ещё до освобождения из-под завала. Вводят наркотики - 1% раствор морфия, 2% раствор омнопона, 2% раствор промедола. Лучше это сделать в/в. Анальгетический эффект наступает сразу.
В/м вводятся ненаркотические анальгетики вместе с транквилизаторами, антигистаминными препаратами и нейроплегиками.
Мощным обезболивающим эффектом обладают новокаиновые блокады - футлярная, проводниковая, мест закрытых переломов. Патогенетически обусловлены паранефральные блокады. Накладывать или не накладывать жгут перед или после освобождения конечности из-под завала?
Жгут следует накладывать только в двух случаях:
1) при явных признаках нежизнеспособности конечности;
2) при наружнем кровотечении из-за повреждения магистральных сосудов.
Накладывать жгут с целью предупреждения интоксикации с места сдавления следует считать ошибкой.
После освобождения обязательно эластичное бинтование конечности и полноценная транспортная иммобилизация. В первые часы после освобождения применяется местная гипотермия.
Огромное значении имеет рано начатая диффузионная терапия. В первую очередь вводятся кристаллические растворы, бикарбонат натрия, коллоидные растворы.
Рациональна следующая последовательность введения - в первую очередь сбалансированные солевые растворы - трисоль, лактосоль, ацесоль.
Затем вводят низкие и среднемолекулярные растворы реополигмонин, реоглюман, полиглюкин.
Вводят сердечные гликозиды, кардиотонизирующие средства. Особенно показан хлорид кальция. Он уменьшает гиперкалиемию, улучшает сердечную деятельность.
Для улучшения реологии крови вводится гепарин.
Детоксикация при СДС
При умеренной токсемии (без признаков почечной недостаточности) можно ограничиться гемодилюцией (стандартные кристаллические растворы у и низкомолекулярные каллоидные растворы - реополигмокин, неогемодез, раствор глюкозы) и стимуляцией диуреза - лазиксом и инфузиями 10 - 20% раствора глюкозы.
При тяжёлой токсемии (и ОТН) для уменьшения токсемии используют содовые промывания желудка и кишечника, гастроэтеросорбцию (энтеродез, энтеросорбент, активированный уголь), внутривенно вливают гемодез. Уменьшению интоксикации способствует и принудительная диаррея (промывание желудка тёплым 2-4% раствором бикарбоната натрия с последующим введением через зонд 200-300 мл 33% раствора сульфата магния. Если нет жидкого стула спустя 4-5 часов, то ставят сифонную клизму.
В случае почечно-печёночной недостаточности показана гемосорбция гемофильтрация, гемодиализ, плазмоферез в сочетании с нативной плазмой альбумином, коллоидными и кристалловидными растворами.
Методика фасциотомии
Разрез кожи и подкожной клетчатки над фасциальным футляром длинной 10 см. Тупферами отслаивают вверх и вниз подкожную клетчатку над фасцией выше и ниже кожного разреза. Затем ножницами рассекается фасция по ходу кожной раны, выше и ниже её.
Рана рыхло тампонируется водорастворимыми антисептиками.
На кожную рану можно наложить редкие швы.
Тема 4
Современная огнестрельная рана
Время – 2 часа
История применения огнестрельного оружия насчитывает 600 лет (П.Н.Зубарев, 2007г.), но лишь с начала 19 века были начаты исследования механизмов повреждающего действия огнестрельных снарядов (Дипиютрен, 1834г.; Н.И.Пирогов 1848г.).
Огнестрельные ранения были и остаются одной из основных проблем военной медицины. Их частота в современных вооружённых конфликтах составляет от49 до 67% среди убитых и 32 – 40% среди раненых хирургического профиля.
Очень важно, что огнестрельные повреждения только мягких тканей составляют 58 – 68,6% от всех огнестрельных ранений. А именно эти раненые наиболее перспективны для возвращения в строй. В годы ВОВ возвращено в строй около 18 млн человек военнослужащих (а численность наших войск к концу войны составляла около 6 млн человек). То есть ВОВ была выиграна солдатами и офицерами, перенёсшими огнестрельные ранения.
Действие самого снаряда
Основной баллистической характеристикой является начальная скорость снаряда:
низкоскоростные - ˂ 700 м/сек,
среднескоростные - от 700 м/сек до 1000 м/сек,
высокоскоростные - ˃ 1000 м/сек.
Во время полёта на снаряд действуют аэродинамические силы. Высокая скорость его и вращение вокруг оси способствует сохранению (устойчивости) снаряда в полёте. Но сопротивление воздуха, неровности поверхности осколка и смещённый центр веса пули опрокидывает снаряд, создавая его кувыркание в полёте. Кувыркание увеличивается при входе в ткани, возрастает при этом коэффициент торможения и за счёт этого увеличивается энергия, передаваемая тканям. Процесс ранения и передача энергии снаряда тканям представляет собой гидродинамический эффект. Он в наибольшей степени проявляется в тканях, содержащих много жидкости и имеющих оболочки - это мышцы в фасциальном футляр, паренхиматозные органы в капсуле, полые органы, заполненные содержимым (желудок, кишечник, мочевой пузырь), это мозг в оболочках и черепной коробке.
Третий фактор повреждающего действия снаряда – боковая ударная волна и образуемая вокруг снаряда временная пульсирующая полость. Она превышает диаметр снаряда в 10 – 25 раз, а время её пульсации больше времени прохождения снаряда через ткани в 1 – 2тыс. раз.
Четвёртый фактор – воздействие вихревого следа. Это вихреобразные движения воздуха и частиц тканей позади снаряда.
Эти четыре фактора - головная ударная волна, действие самого ранящего снаряда, боковая ударная волна и вихревой след и образуют огнестрельную рану.
При сквозных ранениях рана имеет входное и выходное отверстия и раневой канал. При действии низкоскоростного снаряда раневой канал может быть более или менее прямолинейным. При повреждении современными высокоскоростными снарядами раневой канал имеет неправильную форму и сложные контуры.
Фазы раневого процесса
Первая фаза – фаза экссудации – до 4 дней.
В эту фазу происходят следующие процессы в зоне раны:
- спазм сосудов, обеспечение гемостаза;
- образование фибринной плёнки;
- выделение медиаторов воспалительного процесса (серотонин, гистамин) - расширение сосудов и замедление кровотока;
- образование лимфоцитарного вала на границе живых и мёртвых тканей;
- фагоцитоз бактерий и крупных белковых осколков;
- лизис мёртвых тканей ферментами;
- образование грануляционной ткани.
Тема 5
Ожоги
В.Н. Березин.
Ожоги – это повреждения кожных покровов и глубжележащих тканей организма, возникающие в результате местного действия высокой температуры, а также химических веществ и в комбинации указанных факторов. В зависимости от повреждающего фактора различают термические, химические, электроожоги и радиационные ожоги
По данным ВОЗ, в общей структуре травматизма ожоги занимают третье место (1999). Доля пострадавших в результате термической травмы среди всех травм мирного времени составляет 5-12%. Ожоги у детей составляют 8% от числа всех видов повреждений, а среди травм, требующих стационарного лечения, они достигают 42% (П.В. Завьялов[24]). Значительно возросло число пациентов с критическими и сверхкритическими ожогами площадью более 40% поверхности тела (Малахов С.Ф. 2002 [27], Алексеев А.А. 2005 [4]). Общая летальность от ожогов достигает 6-7%, инвалидность – от 6,9% до 22,8%, среди которых 82% это люди молодого работоспособного возраста. (Азолов В.В., Пономарева Н.А.[2]). До 40% пролеченных пациентов с глубокими ожогами в дальнейшем нуждаются в реконструктивных, восстановительных и пластических операциях, в длительной медицинской, социально-трудовой и психологической реабилитации (Алексеев А.А. 2004 [3]).
В целом, лечение обожженных является одним из наиболее сложных и высокозатратных разделов медицинской помощи населению (Алексеев А.А. 2005 [4]). Проблема лечения ожогов сложна и многогранна. Решение ее во многом зависит не только от применяемых средств и методов, но и от единства стратегии, тактики, преемственности в лечении патологии (С.П. Пахомов [33]).
Строение и функции кожи
Кожа является наружным покровом, осуществляющим защитную функцию организма и его связь с окружающей средой. Кожа – это самый большой орган. Ее масса у взрослого человека составляет 4-6% от общей массы тела и достигает в среднем 5 килограмм, а ее площадь занимает примерно от 1,5 до 2 м2. Кожа имеет сложное строение, которое отличается на разных участках. Выделяют два типа кожи - толстую (на ладонной поверхности кисти и подошвенной поверхности стопы), и тонкую (на остальных участках тела). Такое подразделение зависит от толщины эпидермиса и приходящейся на него нагрузки. Строение кожи на срезе рассмотрено на рисунке 2.1-1.
К основным функциям кожи относятся: защитная (служит препятствием для микроорганизмов, оберегает от ультрафиолетового излучения), терморегуляторная, дыхательная, экскреторная, резорбционная, чувствительная, а также участвует в обмене, синтезе антирахитического витамина Д и др.
Таким образом, кожа – это чрезвычайно сложно устроенный орган, выполняющий многочисленные функции целостной системы организма. Поэтому при термическом повреждении кожи могут возникнуть необратимые патологические изменения во всех органах и системах организма[32].
Тяжесть ожгового больнлго зависит: 1- площади ожога, 2- грубины поражения, 3-возраста, 4- сопутствующих заболеваний, ТИТ- термоингаляционной травма
Ожоговая болезнь
Ожоговая болезнь – это комплекс патологических изменений, охватывающих все системы и органы организма, который обусловлен наличием ожоговой раны.
Интенсивный поток нервно-болевых импульсов с обширной площади ожога приводит к перенапряжению, истощению и резкому нарушению регулирующей функции центральной нервной системы. Это сопровождается патологическими реакциями и морфологическими изменениями со стороны сердечно-сосудистой, дыхательной, эндокринной, иммунной систем, крови, почек, печени, желудочно-кишечного тракта. Все это приводит к развитию ожоговой болезни с ее многообразными клиническими проявлениями, в основе которых лежат нервно-дистрофические расстройства , а также некомпенсированная утрата кожного покрова как органа, что и является пусковым механизмом к развитию патологии (А.А.Вишневский 1952 [ 17], Г.Д. Вилявин1963 [ 15])
У взрослого человека ожоговая болезнь развивается при поверхностных ожогах более 25% поверхности тела и при глубоких - более 10%. У детей, лиц пожилого и старческого возраста, пострадавших с хроническими заболеваниями ожоговая болезнь. может возникнуть и при меньшей площади поражения. Поэтому тяжесть ожоговой болезни будет определяться совокупностью следующих факторов: общей площадью ожога, особенно площадью глубокого ожога; глубиной ожога; термоингаляционной травмой верхних дыхательных путей; возрастом; наличием сопутствующих заболеваний.
Существует ряд формул для определения тяжести ожоговой травмы, но все они более или менее правомочны только при массовом поступлении пострадавших и служат для сортировки пациентов в целях формирования очередности оказания медицинской помощи[18]. Приведем ряд из них:
Правило Бо или правило сотни. К возрасту пострадавшего прибавляют процент ожога. Ожог дыхательных путей добавляет 10 баллов. Если получившаяся сумма 90-100, то прогноз - неблагоприятный, когда более 65, то прогноз сомнительный, менее 65 – прогноз благоприятный.
Индекс Франка: 1% поверхностного ожога равен 1 баллу,1% глубокого ожога равен 3 баллам, термоингаляционная травма (в зависимости от тяжести) 15-30 баллов. Если общая сумма до 65-75 баллов, то прогноз благоприятный; сомнительный – более 75 баллов и неблагоприятный от 100 до 120 баллов.
Индекс тяжести поражения (ИТП). При исчислении ИТП принимается, что 1% площади при ожогах I-II степени соответствует 1 ед., ,3ст. - 3 ед. Если имеется легкое поражение ВДП то добавляют 15 ед., среднее - 30 ед., тяжелое - 45 ед.. Каждый год возраста свыше 60 лет исчисляют за 1 ед. При 30-70 единицах ИТП без поражения органов дыхания и при 20-55 ед. с поражением ОД развивается легкий ожоговый шок. Тяжелый ожоговый шок возникает соответственно при 71-130 ед., а с поражением ОД – при 56-100 ед. Крайне тяжелый шок характерен для более 130 ед. ИТП, а с поражением ОД - 100 ед.
В течении ожоговой болезни принято выделять 4 периода, которые характеризуют время, прошедшее с момента травмы, и изменения, происходящие в ожоговой ране и в организме .
1 - период ожогового шока (1-3 суток) длится от момента травмы до восстановления микроциркуляции в тканях и органах, функции почек и повышения температуры.
2 - период острой ожоговой токсемии (3-14 сутки после травмы) от момента гипертермии до нагноения ран.
3 - период септикотоксемии (от 10-14 суток и продолжается до восстановления целостности кожного покрова и ликвидации инфекционных или иных осложнений).
4 - период реконвалесценции; продолжается до восстановления двигательной функции и возможности самообслуживания.
Продолжительность 3 и 4 периодов различна и зависит от сроков восстановления целостности кожных покровов.
Ожоговый шок
Это первый период ожоговой болезни, который начинается тотчас после получения травмы при площади глубокого ожога более 10-15% поверхности тела. У детей, пожилых, ослабленных больных с различными сопутствующими заболеваниями ожоговый шок может развиваться и при площади в 5%. Развитие шока обусловлено болевой импульсацией из ожоговой раны, которая в результате целого каскада взаимосвязей приводит к расстройству гемодинамики с резкими нарушениями микроциркуляции, к изменениям водно-электролитного баланса и кислотно-основного состояния (рис. 2.1-3) Уже в первые часы после обширных ожогов уменьшается объем циркулирующей крови, в большей степени - объем циркулирующей плазмы, за счет повышения проницаемости капилляров не только в зоне повреждения, но и в свободных от ожогов тканях, и выход в них значительного количества белка, особенно альбуминов, воды, электролитов. Так как альбумины поддерживают онкотическое давление плазмы, то их уменьшение в сосудистом русле является важнейшей причиной падения обьема циркулирующей плазм что приводит к гемоконцентрации со всеми вытекающими последствиями. Ведущую роль в развитии шока играет зона паранекроза, т. к. через нее идет всасывание продуктов распада, пропотевание плазмы, раздражение болевых рецепторов. Именно по этой причине, в период ожогового шока возможно развитие синдрома системного воспалительного ответа (ССВО), критериями которого являются:
1. Повышение температуры тела выше 38°С, или снижение температуры ниже 36°С.
2. ЧСС более 90 ударов в минуту
3. ЧДД более 20 в минуту или парциальное давление СО2 менее 4.0 кПА.
4. Количество лейкоцитов более 12х109 на литр, или менее 4 х109 на литр.
Диагностика ССВО очень важна, так как он является предвестником развития сепсиса и полиорганной недостаточности.
Зона некроза в это время индифферентна, так как из-за отсутствия кровообращения она теряет связь с организмом. Патогенез развития ожогового шока можно представить в виде схемы (рис. 2.1-3).
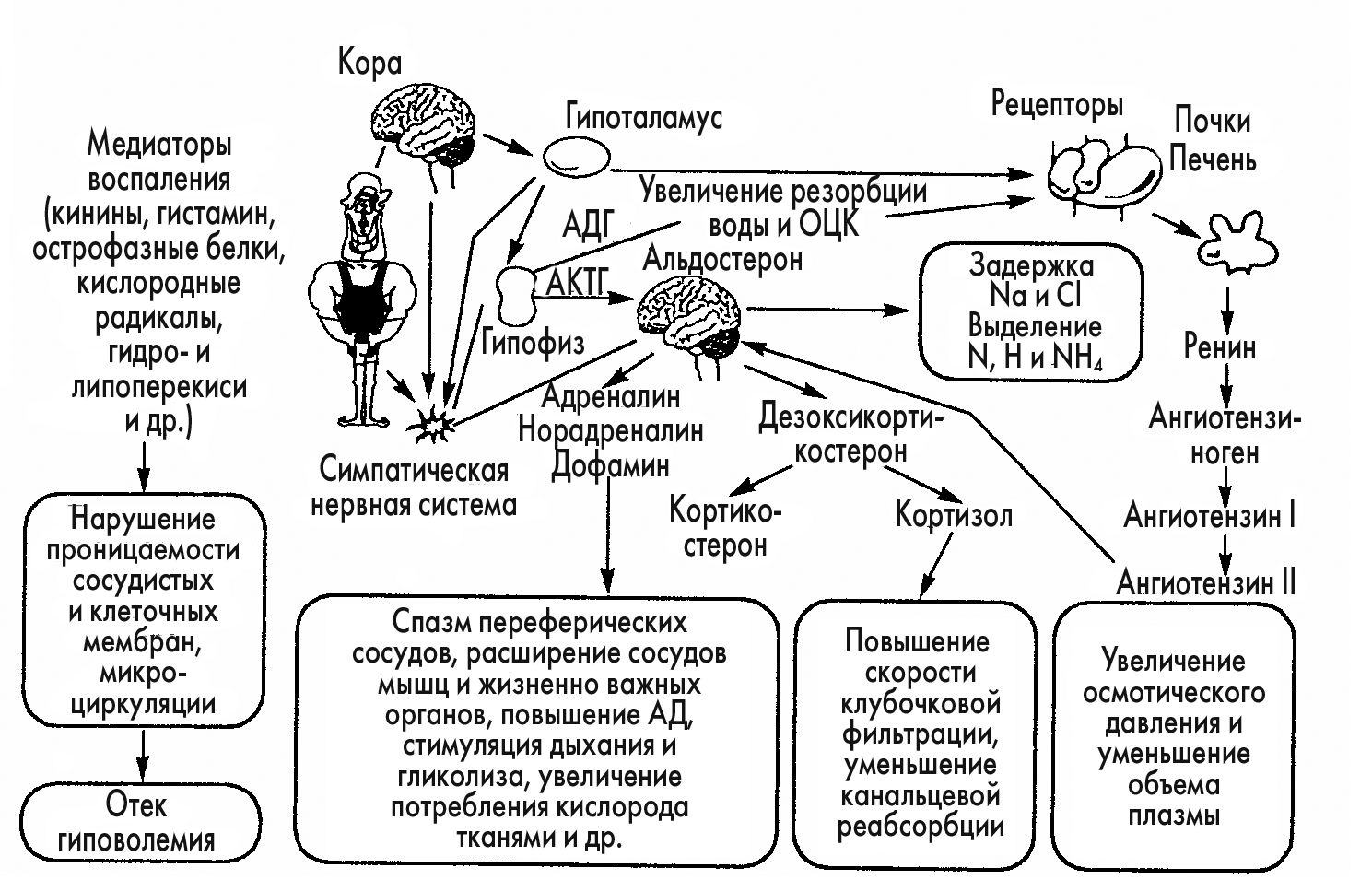
Рис. 2.1-3. Схема развития ожогового шока
Принято выделять легкий, тяжелый и крайне тяжелый ожоговый шок.
При легкой степени ожогового шока больные беспокойны, возбудимы, а иногда заторможены. Неповрежденные кожные покровы обычной окраски, но могут быть бледными, сухими, иногда появляется тошнота и рвота. Температура тела обычно нормальная или несколько снижена. У детей возможно повышение температуры, незначительно увеличивается число сердечных сокращений и частота дыхания. Диурез в первые часы после травмы почти неизменен.
Общей клинико-лабораторной картиной при площади поражения 20% и более для тяжелого и крайне тяжелого шока, будут следующие проявления:
Общая бледность, холодная, сухая кожа, акроцианоз, спавшиеся периферические вены, замедленный симптом капиллярного пятна, особенно на периферии, субнормальная температура тела, усиливающаяся тахикардия, тахипное, частая рвота после приема жидкости, снижение диуреза вплоть до анурии.
Артериальное давление, в отличии от травматического шока, остается нормальным, и даже может быть повышенным за счет возрастания общего периферического сопротивления кровотоку, а при крайне тяжелом ожоговом шоке происходит его падение. В анализах крови гемоконцентрация, увеличение гематокрита более 50, гемоглобин достигает 160 г/л и выше, количество эритроцитов 5,5х10х12, выраженный лейкоцитоз со сдвигом формулы влево, гипоальбуминемия, гипонатриемия, гиперкальциемия, азотемия.
В анализах мочи - увеличение удельного веса, протеинурия, появляется свободный гемоглобин . Если гематокрит более 60, то это плохой прогностический признак. Если пациент по истечении трех суток не выходит из шока, то это также является неблагоприятным прогностическим признаком.
Несмотря на развернутую симптоматику, диагностика ожогового шока, в ряде случаев, бывает затруднительной. Следует выделить симптомокомплекс, который наиболее достоверно подтверждает диагноз ожоговый шок:
1. Снижение максимального АД ниже 95 мм рт. ст. в течении 6-9 часов.
2. Олигоурия или анурия в течение того же времени.
3. Субнормальная температура тела.
4. Азотемия, остаточный азот более 35 ммоль/литр.
5. Упорная рвота.
6. Макрогемоглобинурия.
7. Ацидоз, PH крови до 7,3.
8. Ректально-кожный градиент температуры более 9 градусов.
Таблица 1
Острая токсемия
При правильном лечении ожогового шока, примерно на 3 сутки после получения травмы, состояние пациента относительно стабилизируется. Поднимается температура до 38°С, увеличивается диурез, и свидетельствует о том, что период острого ожогового шока закончился и наступила следующая стадия ожоговой болезни – острая ожоговая токсемия. В основе патогенеза ожоговой токсемии лежит всасывание токсинов, образующихся при разрушении поврежденных тканей. Доказано, что в этот период токсины, выделяемые микрофлорой, мало влияют на развитие симптоматики.
Основными симптомами в данный период болезни будут признаки интоксикации, более выраженные при влажном некрозе. Это реметтирующая лихорадка, с подъемами температуры тела до 38-39°С. Подъем температуры тела выше 40°С является неблагоприятным прогностическим фактором. Такая гипертермия связана с тем, что продукция тепла значительно превышает теплоотдачу из-за расстройства кровообращения, гипоксии и отека головного мозга. Это позволяет сделать вывод, что такая гипертермия имеет в основном центральное происхождение.
В фазе токсемии нарушены функции внешнего дыхания, появляется одышка, уменьшается жизненная емкость легких, возможно раннее развитие пневмонии, особенно у лиц пожилого и старческого возраста, у ослабленных больных.
Характерной является истинная анемия с резким падением содержания гемоглобина и количества эритроцитов, что связанно с массивным гемолизом и угнетением эритропоэза, а также с возвращением отечной жидкости и токсических продуктов из тканей в сосудистое русло. Прогрессирует снижение белков крови, лейкоцитоз с нейтрофилезом. В моче обнаруживается протеинурия, микрогематурия, цилиндроурия. Это признаки инфекционно-токсического нефроза.
Со стороны желудочно-кишечного тракта преобладат диспептические расстройства (вздутие живота, динамическая непроходимость), возможно развитие эрозий и язв с кровотечением (кровавая рвота, мелена)[9]. Вероятно развитие токсического гепатита с увеличением содержания в крови прямого билирубина и с повышением активности трансаминаз.
Со стороны ЦНС симптоматика бывает разнообразной, от нарушения сна с расстройством ориентации вплоть до делириозных состояний, такая симптоматика почти всегда является обратимой, по мере стабилизации состояния пациента.
Период острой ожоговой токсемии длится в среднем до двух недель, до начало отторжения струпа. Основными направлениями симптоматической терапии в этот период будут:
· Дезинтоксикация организма, профилактика и лечение анемии (переливание крови и ее компонентов, белковых препаратов альбумина, протеина, аминокислот, гемодеза и др.)
· Стимуляция адекватного диуреза, который должен соответствовать массивности инфузионной нагрузки, форсированный диурез (маннитол, лазикс, фуросемид).
· Коррекция вводно-электролитного баланса. Введение изотонического растворов хлорида натрия, Рингера, лактасола, при дефиците калия – раствора калия хлорида.
· Профилактика и коррекция гипоксии и сердечной недостаточности.
· Симптоматическое лечение нарушения функции почек, печени, ЖКТ, ЦНС.
· Восстановление моторики ЖКТ, особенно у больных пожилого и старческого возраста (очистительные клизмы).
· Профилактика и лечение инфекционных осложнений.
Также необходимо рациональное усиленное белковое питание с энергетической ценностью 4000-4500 ккал, богатое витаминами А, группы В, С, РР. При невозможности самостоятельного приема пищи - зондовое питание. Для восполнения дефицита белков и энергетических ресурсов - парентеральное питание: гидролизаты белка, растворы аминокислот, углеводов, жировых эмульсий, а для усиления эффекта назначают анаболические гормоны (ретаболил, нерабол)[16].
Показанием к проведению гормональной терапии при ожоговом истощении является надпочечниковая недостаточность. Эта терапия является заместительной, однако допустима только по строгим показаниям, особенно у лиц с язвенным анамнезом (кровотечения), и под прикрытием антибиотиков для предупреждения инфекционных осложнений.
Проводится активная иммунизация (стафилококковый анатоксин по 1 мл в сутки – 5-7 дней) и пассивная иммунизация (антистафилококковая плазма, антистафилококковый гамма-глобулин).
Ведущим направлением в местном лечении является предотвращение развития влажного некроза ожоговых ран, или перевод влажного некроза в сухой.
Ожоговая септикотоксемия
Примерно через 10-14 дней после получения ожога у пациента начинается период ожоговой септикотоксемии. Это тяжелая токсико-инфекционная патология, появляющаяся при развитии гноеродных и гнилостных процессов в ожоговых ранах и в резорбции в кровеносное русло микробов, их токсинов и продуктов распада погибших тканей.
Период септикотоксемии принято разделять на две фазы. Первая, которая длится 2-3 недели и характеризуется отторжением струпа. Вторая фаза – это период существующих гранулирующих ран и длится до полного их заживления. Для первой фазы характерны симптомы тяжелой интоксикации, обусловленные всасыванием продуктов жизнедеятельности микрофлоры. Для второй фазы характерно смягчение интоксикационной симптоматики, однако, если не восстановить целостность кожных покровов, как правило, развивается истощение с тяжелыми дистрофическими изменениями во внутренних органх, эндокринной недостаточностью, резким ослаблением защитных сил организма, снижением иммунитета и прекращением репаративных процессов в ране. Это может привести к развитию одного из грозных осложнений ожоговой болезни - сепсису. Состояние больного резко ухудшается, появляется высокая лихорадка с размахами в 2-3°С, в анализах крови нарастает лейкоцитоз, нейтрофилез со сдвигом формулы влево, в посевах крови - рост стафилококковой микрофлоры. Прогрессируют нарушения белкового обмена с выраженным отрицательным азотистым балансом. Потеря массы тела достигает до 20-30%, характерны адинамия и пролежни, контрактуры и вывихи, осложнения со стороны сердечно-сосудистой системы, легких и ЖКТ. Все это основные симптомы сепсиса и ожогового истощения.
Основными показаниями к проведению инфузионно-трансфузионной терапии является анемия, гипо- и диспронеинемия, метаболические нарушения, снижение защитных сил организма, интоксикация.
Выбор инфузионно-трансфузионных сред зависит от тяжести проявлений ожоговой болезни, нарушений со стороны крови, показателей обмена (вводно-электролитного, белково-азотистого) состояния и функции легких, почек, сердечно-сосудистой системы.
Переливание крови и плазмы, аминокислот и жировых эмульсий является необходимым компонентом для профилактики ожогового истощения, анемии, при подготовке ран к оперативному закрытию. Показатели белка крови на уровне 6,5-8,0 г/л свидетельствуют о благоприятном течении раневого процесса и готовности ран к пластике. Инфузионно- трансфузионная терапия должна сопровождаться рациональным питанием с высококалорийной, витаминизированной пищей. Количество белков и калорий должны превышать в 1,5-2 раза физиологическую потребность. При восстановлении всасывающей и моторной функции желудочно-кишечного тракта парентеральное питание можно заменить энтеральным зондовым питанием с использованием глюкозо-белково-жировых смесей. Переливание крови является необходимым компонентом в борьбе с анемией, в профилактике ожогового истощения в период предоперационной подготовки[8]. Гемотрансфузии назначаются по плану 3 раза в неделю, в промежутках между гемотрансфузиями целесообразно переливать белковые и аминокислотные препараты, растворы глюкозы для восполнения азотистого баланса, энергетических затрат, устранения гипо- и диспротеинемии. Такая интенсивная терапия должна проводится в первые 3-5 недель, а затем после восстановления кожного покрова объем переливаний уменьшается и зависит от общего состояния больного и лабораторных показателей крови.
Реконвалесценция
Ликвидация ожоговых ран еще не дает право говорить о выздоровлении пациента, период реконвалесценции в зависимости от тяжести травмы может занимать до одного года и более, однако нарушения функции сердца, печени, почек, легких, изменение психики больного может продолжаться длительное время. Об этом надо помнить при планировании различных реконструктивных операций.
Лечение в фазе реконвалесценции это консервативное и оперативное лечение последствий ожоговой травмы.
Типы покрытия ожоговых ран
| Синтетические | Биологические |
| Гомогенозные и однослойные | Фибриновые пленки |
| Неполноценные пленки | Коллаген: пластины, губки |
| Пленки-распылители | Коллаген/капролактон |
| Пенопласты | Ламинат |
| Губки | Выращенные эпидермальные клетки |
| Гели | Коллаген/эпидермальные клетки |
| Сложные и двуслойные | Аутокожа |
| Пена/пленка | Аллокожа |
| Полиуретан/пленка | Ксенокожа |
| Велюр/пленка | Амнион |
Тема 6
Тема 7
Опухоли костей
Время 2 часа
Опухоли костей могут быть первичными (они растут из тканей, составляющих кость – собственно кость, хрящевая ткань, элементы костного мозга, сосуды, нервы, соединительная ткань) и вторичные – метастатические опухоли.
Метастатические опухоли - это гематогенные метастазы в кость из опухолей других органов. В кости метастазируют опухоли молочных желёз, лёгких, предстательной железы, почек. В анамнезе у таких больных часто есть операция по поводу опухоли.
При опухоли почки первичный очаг в почке часто бывает небольшим, а метастаз вначале бывает один. Он по величине значительно больше первичной опухоли почки. В этих случаях выполняется операция на почке и удаляется метастаз. Больной наблюдается дальше в онкологическом диспансере, получает химиотерапию, периодически наблюдается (сцинтеграфия!). Рецидива на месте удалённого метастаза и метастазов в другие органы часто не бывает несколько лет.
При метастазах опухоли молочной железы, лёгких, предстательной железы болей в месте метастаза может и не быть или они очень незначительные. Первым симптомом метастаза часто бывает патологический перелом при незначительной по силе травме – больной сел в постели, перекинув бедро через край её, споткнулся о порог, коврик и т.п. На лицо все признаки перелома – невозможность опоры, деформация сегмента, боли в месте перелома, патологическая подвижность, укорочение конечности.
Больных доставляют в травматологический стационар. Выполняют рентгеновские снимки – находят перелом кости. На снимках при паталогическом переломе виден дефект в торцах отломков – метастаз.
 В анамнезе у этих больных лечение по поводу опухоли и часто операция.
В анамнезе у этих больных лечение по поводу опухоли и часто операция.
Больным с паталогическом перелом показана операция - внутренний остеосинтез блокируемым стержнем или пластиной и винтами. Ткань метастаза вычерпывается костной ложечкой и отправляется на гистологическое исследование. Дефект после удаления метастаза заполняется костным цементом для бÓльшей прочности фиксации.
Когда больной сможет передвигаться, то в онкологическом диспансере, выполняется сцинтеграфия для выявления других возможных метастазов. Больной наблюдается хирургом-онкологом, не получает химиотерапию..
Первичные опухоли костей
Они классифицируются в зависимости от вида ткани, из которой опухоль растёт в кости.
Классификация первичных опухолей костей (Женева, 1972г.) Она выделяет 9 групп первичных опухолей костей.
Костообразующие опухоли
1.1. Доброкачественные -
- остеома (губчатая, компактная, на широком основании, на узком основании). Локализуется чаша в метафизарном отделе кости. При удалении не повредить ростовую зону. Лучше не удалять. Компактная остеома часто растёт из плоских костей – лопатка, стенки придаточных пазух черепа.
- Остеидостеома. Это единственная доброкачественная опухоль кости, сопровождаемая болями, но они проходят на несколько часов от анальгетиков. Могут локализоваться в любом отделе кости (к крыше вертлужной впадины, в шейке бедра, в кортикальном слое диафиза). Чаще – диафиз кости. Кортикальный слой веретенообразно утолщается, в центре округлое просветление – сама опухоль. Просветление в центре хорошо видно на КТ. Краевая резекция кортикала кости с опухолью приводит к полному выздоровлению, но кость ослабляется (рисунок), может быть патологический перелом, потому следует выполнить костную пластику краевого дефекта диафиза и накостный остеосинтез.
- Остеобластома (по С.Т.Зацепину (2001г.) это гигантская остеодостеома).
1.2. Злокачественные костообразующие опухоли –
- остеогенная саркома (литическая форма и остеобластическая форма).
- параоссальная саркома.
Хрящеобразующие опухоли
2.1 Доброкачественные
- хондрома (энхондрома – расположена внутри кости (кисть, метафизы длинных костей; экхондрома - расположена снаружи кости ( чаще это кость таза),
- хондробластома,
- хондромиксойдная фиброма.
2.2. Злокачественные хрящеобразующие опухоли
- ходросаркома.
3. Гигантоклеточная опухоль - остеобластокластома, бурая опухоль.
Многие ортопеды считают её злокачественной опухолью.
Она растёт из одного очага, чаще это метафиз длинной кости, не сопровождается сильными болями. Прорастая надкостницу, она настолько истончает её, что больной при ощупывании ломает истончённую кость, слышен хруст и появляется кровоизлияние, цветущее как подкожная гематома – от фиолетового через синий, зелёный в жёлтый цвет, опухоль на разрезе имеет вид цветущей гематомы (потому и называется бурая опухоль).
Поскольку сильной боли не бывает, то пациент обращается к врачу, когда метафиз длинной кости уже значительно разрушен. Стремясь сохранить сустав и конечность, выполняют экскохлеацию опухоли (вычерпывают её острой костной ложечкой), обжигают стенки коагуляцией или жидким азотом и тампонируют её ауто- или аллокостью. При регенерации трансплантатов наступает их злокачественное перерождение и гематогенные метастазы.
До того, как появились специальные опухолевые протезы суставных концов длинных костей (бедро, голень, плечо), я не раз выполнял экскохлеацию остеобластокластомы и тампонаду образующейся полости в метафизе после обжигания стенок коагуляцией или жидким азотом (Н.П. Демичев, Астрахань) костным цементом. Цемент полимеризуясь при застывании нагревается до 90°, убивая неудалённые клеточки опухоли. Я не видел рецидивов после таких операций.
Они все злокачественные
4.1. Саркома Юинга
4.2. Ретикулосаркома
4.3. Лимфосаркома
4.4. Миеломная болезнь
Сосудистые опухоли
5.1. Доброкачественные – гемаенгиома (чаще позвонки, патологические переломы, бывает у 70% здоровых людей), лимфангиома, гломангиома
5.2. Промежуточные – гемангиоперецитома, гемангиоэндетелиома: они могут рецидивировать после удаления и подвергаться злокачественному перерождению
5.3. Злокачественные – ангиосаркома, лимфосаркома
Неклассифицируемые опухоли
Когда несколько независимых гистологов не могут отнести диагностируемую опухоль ни к одной из вышеперечисленных групп. Эти опухоли все злокачественные.
Остеогенная саркома (ОС)
Одна из наиболее часто встречающихся форм первичных злокачественных опухолей костей. Поражает 90% молодой возраст. Наиболее частые локализации (рис. )
 Первый клинический симптом - боль, чаще (локализация!) боль в коленном суставе. Обычно больной и врач при первых посещениях связывают её с травмой. Эта боль очень беспокоит больного. Она есть и ночью. Ночью даже сильнее. Не снимается анальгетиками.
Первый клинический симптом - боль, чаще (локализация!) боль в коленном суставе. Обычно больной и врач при первых посещениях связывают её с травмой. Эта боль очень беспокоит больного. Она есть и ночью. Ночью даже сильнее. Не снимается анальгетиками.
Сустав не изменён. Общее состояние удовлетворительное, t° – N, кровь не изменена.
Опухоль в месте роста опухоли и нарушение функции сустава появляются много позднее.
Различают два вида поражения - быстроразвивающаяся ОС - острое начало, резкие боли и быстрый летальный исход; и медленно развивающаяся опухоль, с менее выраженными клиническими проявлениями.
Средние сроки генерализации ОС 7 – 8 месяцев.
По мере роста опухоль пальпируется и видна на глаз, ткани над ней напряжены, кожа над опухолью блестит, мелкие вены расширены. Появляется ограничение функции сустава – контрактура и хромота. Развивается атрофия мышц. Появляется недомогание, слабость, t°, похудание. Очень нарушается сон из-за ночных болей.
Со стороны крови появляется лейкоцитоз, ускоряется СОЭ, увеличивается анемия. При литической форме ОС может быть паталогический перелом.
При отказе от ампутации (это бывает часто, так как и сам молодой больной и его родители цепляются за любую «соломинку», но только бы сохранить конечность) растущая опухоль разрушает кожу, возникает над ней зловонная кровоточащая язва.
Рентгенологическая картина ОС определяется морфологическими особенностями опухоли, локализацией и темпом роста.
Выделяют остеолитическую (много чаще) и остеобластическую (реже) формы ОС.
В начале заболевания в метафизе кости центрально или ближе к кортикальному слою появляется участок лизиса округлой формы, не имеющий чётких границ (!!!) с окружающей костью. Он растёт (увеличивается в  ), разрушает кортикальный слой.
), разрушает кортикальный слой.
Растущая опухоль оттесняет надкостницу, и та, испытывая напряжение растяжением (открытие Илизарова) регенерирует в остеофит, имеющий на RÖ-снимке вид «козырька» (рис. на доске, RÖ-снимок).
Другим рентгенологическим симптомом, свидетельствующим о распространении опухоли за пределы кости являются спикулы - тонкие игольчатые обызвествления, расположенные перпендикулярно к оси кости. Часто вокруг кости при остеобластической форме ОС кроме спикул видны участки хлопьевидного и облаковидного уплотнения.
Ведущим в диагностике ОС является трепанбиопсия.
Лечение ОС никогда не бывает радикальным, так как к моменту постановки диагноза уже имеются гематогенные метастазы. Потому больному необходимо исследовать лёгкие и выполнить сцинтеграфическое исследование скелета для обнаружение метастазов ОС в другие кости.
Поскольку по времени установления диагноза уже имеются гематогенные метастазы, то ни ампутация, ни экзартикуляция конечности не являются радикальными операциями, и не имеют поэтому такой же прогноз, как резекция поражённого суставного сегмента кости с замещением его протезом.
Возможность выполнения органосохраняющих операций и их равноценность с ампутацией доказали своими многочисленными исследованиями С.Т. Зацепин и его сотрудники в ЦИТО.
Перед резекцией поражённого суставного конца кости проводят 2 курса химиотерапии. При гистологическом исследовании удалённой опухоли определяется реакция опухолевых клеток на использованный до операции химиопрепарат. После операции больной получает ещё 5-6 курсов химиотерапии.
Применение комбинированного лечения - хирургического и химиотерапии позволяет продлить жизнь больного до 5 – 6 лет, а иногда и больше. (RÖ-граммы).
Хондросаркома
Хондросаркома -хрящеобразующая злокачественная опухоль кости. Она может возникать как первичная и в результате озлокачествления доброкачественной хрящевой опухоли.
По частоте хондросаркома стоит на втором месте после остеогенной саркомы, но развивается более медленно – средние сроки генерализации составляют 23 – 24 месяца.
Частота локализации как и при ОС (рис.). первый симптом - боли в коленном или плечевом суставе, которые объясняются травмой или синовитом. Назначают физио- и тепловые процедуры, грея растущую опухоль.
Диагностика и лечение как при остеогенной саркоме.
Лучевая терапия бесперспетивна.
До и после операции проводят курсы химиотерапии.
 Саркома Юинга и ретикулосаркома
Саркома Юинга и ретикулосаркома
Это очень злокачественные опухоли, растущие из элементов костного мозга. Средний срок генерализации процесса 8-9 месяцев.
Эти опухоли чаще поражают метадиафизарные отделы длинных трубчатых костей и кости таза.
Клиническая картина саркомы Юинга и ретикулосаркомы протекает неоднотипно и приходится проводить дифференциальную диагностику не только с остеогенной саркомой, но и с остеомиелитом, так как кроме боли и припухлости наблюдается общее недомогание и температурная реакция.
В отличии от других злокачественных опухолей кости они растут не из одного очага, а поражают метадиафиз на значительном протяжении. Часто бывает паталогический перелом.
Рентгенологическая картина: мелкоочаговая деструкция кости, слоистый периостит. На этом фоне может быть и крупный очаг деструкции, иногда встречается и симптом «козырька» (С.Т. Зацепин, 2001г.).
При поражении плоских костей и костей таза рентгенологическая картина может быть сложной и многообразной - очаг деструкции, вздутие кости, внекостный компонент опухоли. Непременно следует выполнить сцинтеграфию. Порой трудно дифференцировать саркому Юинга и ретикулосаркому с остеомиелитом. Решающее значение имеет трепанбиопсия.
Лечение. Наиболее распространённой до сих пор остаётся лучевая терапия. Всем больным также проводится системная химиотерапия андриамицином, циклофероном, винкристином (8-9 циклов с интервалами один месяц). Примерно 70% пролеченных комбинированным способом живут более 3-х лет.
В настоящее время всё более расширяются показания к оперативному удалению опухоли в случае ранней диагностики и, конечно, при отсутствии метастазов (обязательно провести сцинтеграфию скелета). Кость замещается протезом. До и после операции проводится химиотерапия.
Второй час лекции – демонстрация рентгеновских снимков.
Очевидное - невероятное
(Демонстрация больного на 476-м заседании общества травматологов и ортопедов)
Профессор В.В. Ключевский (зав. кафедрой травматологии , ортопедии и ВПХ ЯГМУ, ректор профессор А.В. Павлов)
Лобзичев Максим, 12 лет, житель г. Углича, обратился в клинику по поводу опухоли правого коленного сустава и верхнего отдела голени, боли в колене. Ночных болей не было (!). направлен на лечение в Российскую детскую клиническую больницу – РДКБ г. Москва.
При госпитализации 26.04.2004г. (из подробной выписки истории болезни) - зона правого коленного сустава в в/3 голени увеличена в окружности на 3 см за счёт опухоли, исходящей из в/3 большеберцовой кости. Опухоль циркулярно (!) охватывает кость, занимает подколенную ямку, плотная при пальпации, умеренно болезненная, несмещаемая. Рутинные анализы и рентгенограмма лёгких без особенностей. УЗИ внутренних органов без патологий. Рентгенография правой голени: проксимальный отдел большеберцовой кости изменён за счёт исходящей из неё опухоли. МРТ: поражение большеберцовой кости опухолью в проксимальном отделе с распространением в диафиз без вовлечения коленного сустава. УЗ-ангиосканирование - отчётливая заинтересованность в опухолевый процесс передней и задней большеберцовых артерий и вен. Денситометрия скелета - гиперфиксация РФП (изотопа) в проксимальном отделе большеберцовой кости (414%). 20.04. 2004г. трепанбиопсия большеберцовой кости и костно-мозговой полости (костный мозг не изменён). Гистологический диагноз от 13.05.2004г. (в РОНЦ АМН и РДКБ): остеогенная саркома (!).
14.05.2004г. – первый курс химеотерапии - фарморубицин 30 мг/м – 33 мг 1,2 и 3 день в/в капельно и цитопластин 120 мг/м – 65 мг 4-й день в/в капельно. После первого курса мягкотканый компонент опухоли не определяется, отмечено его уплотнение. Со стороны опухоли большеберцовой кости положительная динамика.
4.06, 25.06, 19.07 и 16.08 2004г. – ещё 4 курса химиотерапии. Рентгенологически со стороны опухоли дальнейшая положительная динамика. Сканирование - снижение гиперфиксации РФП до 150% в зоне опухоли. УЗ-ангиосканирование - кровоток по сосудам голени не нарушен.
16.09.2004г. операция – резекция верхнего сегмента большеберцовой кости с опухолью, пластика дефекта аутотрансплантатом из м/берцовой кости той же ноги. Её дистальный конец введен в канал большеберцовой кости на 3 см. Проксимальный конец установлен в сформированное ложе между мыщелками бедренной кости. Фиксация аппаратом Илизарова из 4-х колец (два – на бедро, одно - на большеберцовую кость и одно – на трансплантат м/берцовой кости).
После операции проведён курс химиотерапии. Перенёс его очень тяжело.
Госпитализировался для контроля лечения и обследования на возможность рецидива и метастаз 07.12.2004г., 07.04.2005г., и 11.07.2005г. 18.07.2005г. аппарат Илизарова снят. Гипсовая повязка до ягодичной связки со стопой. 02.03.2006г. она заменена на ортез, изготовленный в ЦИТО.
Во время лечения правая нога стала короче левой на 7 см (удалена верхняя ростковая зона большеберцовой кости).
01.10.2007г. госпитализирован в в ортопедическое отделение РДКБ, где выполнена операция по поводу укорочения ноги – остеотомия в н/3 правой бедренной кости. Наложен аппарат Илизарова: два кольца через дистальную половину большеберцовой кости, 3 кольца на бедренную кость , косая остеотомия бедренной кости. С 18.10.2007 г. начаты сеансы дистракции. Выписан домой. Аппаратом работала мама.
В 2008 г. выполнена костая аллопластика в зону регенерата. Достигнуто сращение. Нога удлинена на 5 см.
Обследован. Данных за рецидив опухоли и метастазы нет.
Осмотрен в клинике15.10.2016г. Возраст 24 года.
После удаления опухоли прошло 12 лет(!). Ходит в ортезе лёгкой фиксации , прихрамывает на правую ногу. Выраженная мышечная атрофия правого бедра (разница в окружности 4 см). движений в коленном суставе нет. В голеностопном суставе полные, сила сгибания и разгибания стопы S =D = 5 баллов, чувствительность на стопе сохранена. Пульсация артерий стопы S =D. Правая нога короче левой на 2 см.
На рентгенограмме полное сращение бедренной кости с торцом головки малоберцовой. Малоберцовая кость вся равномерно утолщена, хороший костный канал.
Закончил школу, экономический ВУЗ. Работает по специальности. Не женат.
Очевидно, у пациента имела место параоссальная остеогенная саркома. Она характеризуется длительным течением (более 10 лет), отсутствием или не выраженным болевым синдромом, не склонна к раннему метастазированию. Поводом для обращения к врачу ортопеду часто бывает то, что больной отмечал необычное утолщение кости в сравнении со здоровой. Опухоль растёт циркулярно вокруг кости. Клиника Майо (США) опубликовала 37 наблюдений параоссальной саркомы. Они рекомендовали высокую ампутацию конечности, так как в конечном итоге опухоль проявляет себя как злокачественная.
Я, работая ортопедом с 1968 года (48 лет), ни разу не видел больного с параоссальной саркомой.
Цель демонстрации
Показать положительный 12-летний результат успешного комбинированного лечения остеогенной саркомы, успешное применение доступной для российских клиник органосохраняющей операции замещения дефекта верхнего сегмента большеберцовой кости малоберцовой костью, обеспечение сращения её методом Илизарова.
Поздравяем московских коллег онкологического и ортопедического отделений Российской детской клинической больницы с успешным лечением остеогенной саркомы большеберцовой кости у мальчика 12 лет.
Профессор В.В. Ключевский
Тема 1
Содержание травматологии, ортопедии и военно-полевой хирургии. История отечественной травматологии и ортопедии. История нашей кафедры. Социальные аспекты специальности. Классификация травм. Профилактика травматизма. Организация оказания травматологической помощи в России.
Время: 2 часа
Травматология. Trauma – повреждение, logos – наука. Это повреждение любых органов и систем от любых внешних воздействий.
До 1967 года в нашей стране травматология входила в состав общей хирургии и сводилась к лечению повреждений опорно-двигательной системы, то есть костей, суставов, связок.
В нашей стране только профессор Валентина Валентиновна Гориновская (ГИДУВ г. Москва, кафедра ВПХ институт СМП им. Склифосовского – заведующая травматологическим отделением) в 1937 году (!) опубликовала руководство «Основы травматологии», где изложила повреждение любых органов и систем от любых внешних воздействий. Эта книга была переиздана в 1953 году в двух томах. Но, когда в 1967 году был издан Приказ МЗ СССР о выделении травматологической помощи из общей хирургии, а это – создание травматологических и ортопедических отделений в республиках, регионах, в НИИ, кафедр травматологии и ортопедии при медицинских институтах и институтах усовершенствования врачей, то стали в большинстве городов страны создаваться клиники и отделения, занимающиеся лечением только повреждений ОДС.
Наша кафедра травматологии, ортопедии и ВПХ была создана 1 сентября 1968 года по приказу ректора института Георгия Викторовича Стовичека. На заведование кафедрой был приглашён д.м.н. Николай Константинович Митюнин (1920 – 1977 г.г.), который по окончании Пермского медицинского института в 1941 году был отправлен в действующую армию и всю ВОВ служил ведущим хирургом Мед СБ действующей армии Северо-Западного фронта. После окончания войны работал военным хирургом группы госпиталей ограниченного контингента войск в Германии, стал там кандидатом медицинских наук (его кандидатская диссертация посвящена остеосинтезу переломов спицами Киршнера), а потом он по конкурсу в 1960 г. был избран на должность заведующего травматологическим отделением Ленинградского НИИ скорой помощи им. И.И. Джанелидзе, где в 1966 году выполнил докторскую диссертацию по остеосинтезу переломов длинных костей стержнями из титановых сплавов прямоугольного сечения. Он хорошо знал любые повреждения как военно-полевой хирург, потому наша клиника, созданная вначале на базе травматологического отделения Ярославской железнодорожной больницы, а потом в КБ СМП им. Н.В. Соловьёва, с первых дней работы под руководством Н.К. Митюнина стала заниматься лечением больных с любым повреждением любых органов и систем, а не только травмой ОДС.
Поэтому наша клиника сейчас, имея 11 специализированных отделений в КБ СМП им. Н.В. Соловьёва, оказывает медицинскую помощь населению г.Ярославля и сельских районов с любым повреждением любых органов и систем.
Вот поэтому и руководство, написанное коллективом кафедры под моей редакцией, называется «Хирургия повреждений». Оно издано трижды в 1999г., 2004г. и 2013г. общим тиражом 11 тыс. 500 экз. Второе издание нашего руководства и будет вашим учебником при изучении травматологии.
Ортопедия - второй раздел нашей специальности. Это слово произошло из двух слов - orthos – прямой и pais - дитя. В 1741 г. французский профессор- хирург Andry издал книгу «Ортопедия как искусство предупреждения и исправления деформаций тела у детей средствами, доступными отцам и матерям и всем тем лицам, которым приходиться воспитывать детей». Andry и предложил эмблему новой специальности – кривое дерево, привязанное для исправления этой кривизны к прямой жерди. Эмблема Andry стала эмблемой травматологии и ортопедии во всех странах мира.
Очень хорошее определение ортопедии дал в начале прошлого века профессор Санкт-Петербургского ВМА Роман Романович Вреден - «Ортопедия является той отраслью хирургии, которая занимается изучением, профилактикой и лечением всевозможных деформаций конечностей и позвоночника, как врождённых, так и приобретённых в связи с различными паталогическими процессами и травмами».
В ортопедию входят:
- врождённые и приобретённые деформации ОДС у детей и взрослых (в том числе и послетравматические);
- костно-суставной туберкулёз;
- опухоли костей;
- обменные заболевания скелета;
- деформирующие артрозы;
- асептические некрозы.
И ещё одна составляющая нашей специальности, с которой мы должны познакомить Вас за четыре недели пребывания на нашей кафедре - это военно-полевая хирургия.
Военно-полевая хирургия – это лечение повреждений в условиях военных действий. Характер военных действий за последние десятилетия после Великой Отечественной войны 1941 – 1945 г.г. очень изменился, очень изменилась помощь раненым на этапах медицинской эвакуации. И мы непременно коснёмся этого в соответствующем разделе нашей лекции.
История травматологии и ортопедии
Травматология – древнейший раздел медицины. Безусловно в первую очередь первобытные люди оказывали помощь при повреждениях.
Мумифицированные трупы (древний Египет) обнаруживают правильно сросшиеся переломы, следы лечебных трепанаций черепа.
В древнейшем произведении Гомера «Илиада» описаны проникающие ранения груди, есть слово врач, описана остановка кровотечения присыпанием раны порошком.
Гиппократ (ΙѴ век до н.э.) подробно описал переломы и вывихи, изложил приёмы закрытой репозиции (аппараты – вороты), приём вправления вывиха пяткой в плечевом суставе по Гиппократу; иммобилизация повреждённого сегмента шинами из сухой кожи, щепы, свинца.
В России лечением переломов и вывихов занимались костоправы – люди, не имеющие медицинского образования. В 1651 году в Москве царём Алексеем Михайловичем (отцом Петра Ι) была открыта Костоправная школа. В ней дети ремесленников, умеющие читать и писать, обучались костоправному искусству 7 лет. Получали удостоверение, в котором было написано «знает в совершенстве».
В России в начале 18 века в крупных городах стали открываться госпиталя для лечения последствий боевых повреждений, а при них - медико-хирургические школы. Солдатских детей, умеющих читать и писать, обучали подлекарскому искусству. Окончивших школы направляли в полки. Это были первые военные фельдшера.
Ефим Осипович Мухин (1766 – 1850г.г.) окончил Екатериноградскую медико-хирургическую школу, служил фельдшером в войсках А.В.Суворова, потом преподавал в Екатериноградской школе, потом в Московской медико-хирургической академии анатомию на свежих трупах.
В 1806 году Е.О. Мухин издал на русском языке учебник «Первые начала костоправной науки». Эта книга была первым учебником по травматологии. По ней травматологию изучал и Н.И.Пирогов.
В 1798г. в г. Санкт-Петербурге была открыта медикохирургическая Академия. Курс о повязках, бандажах и машинах хирургических преподавал Христиан Христианович Соломон (1767 – 1857г.г.). он опубликовал работы: «Практические замечания о лечении переломов костей конечностей», «Некоторые замечания о вывихах», «О переломах шейки бедра». И это всё в дорентгеновскую эпоху!
В дорентгеновскую эпоху в середине 19 века в мировой травматологической практике сформировались три основных метода лечения переломов:
1937г. - James (США), постоянное накожное вытяжение (Бандергейер – 1989г. Германия);
1851г. врачи Матиссен и Вандерлоо (Голландия) – гипсовые повязки;
1854г. – Н.И.Пирогов в журнале «Военно-полевая хирургия» - «Использование гипсовых повязок для транспортной и лечебной иммобилизации переломов на театре военных действий».
1865г. американский хирург GaiLand выполнил остеосинтез ложного сустава бедренной кости полым круглым стержнем, перед введением его рассверливал костный канал.
Через 20 лет появились сообщения об остеосинтезе переломов в России – А.А.Троянов, 1887г.; В.И.Кузмин, 1892г., Н.В. Склифосовский, 1913г.
Бурное развитие наша специальность получила после открытия рентгеновских Х-лучей в 1895г. в начале 20 века. Тогда же в России сформировались три травматологические школы - Санкт-Петербургская, Харьковская и Московская.
С 1895 г. в Санкт-Петербургской МВА курс ортопедии начал вести профессор Г.И.Турнер. 1900г. в МВА была открыта кафедра военной травматологии и ортопедии, а в 1913г. на улице Боткина, 13 (рядом с Финляндским вокзалом) на средства меценатов построена и открыта клиника военной травматологии и ортопедии на 60 коек, которая до сих пор является основной базой кафедры (сейчас 240 коек). По инициативе Г.И.Турнера в Санкт-Петербурге открыт приют для детей с врождёнными заболеваниями скелета, который с 1931г. преобразован в Институт восстановления трудоспособности физически дефектных детей. Сейчас это НИИ детской травматологии и ортопедии им. Г.И.Турнера.
Вторым создателем Санкт-Петербургской школы травматологии и ортопедии является профессор МВА Роман Романович Вреден Он в 1907 г. возглавил в Санкт-Петербурге новый большой (на 40 коек) травматологический госпиталь с палатами для больных, реабилитационным залом, протезной мастерской и библиотекой. Этот госпиталь в 1924 г. был переименован в травматологический институт. Р.Р. Вреден руководил им до конца своей жизни (1934г.). Сейчас этот институт носит имя Р.Р.Вредена. Его возглавляет профессор Рашид Муртузалиевич Тихилов, бывший сотрудник кафедры военной травматологии и ортопедии МВА им. Кирова.
Харьковская школа травматологов-ортопедов создана в 1907 г. Горнопромышленники юга России в Харькове открыли ортопедический институт для долечивания травм, полученных шахтёрами на производстве. Директором института пригласили обрусевшего немца профессора Карла Фёдоровича Вегнера. Он внедрил постоянное вытяжение в России, опубликовал в 1923 году руководство по травматологии, которое было первым учебником в России. В Харьковском НИИ травматологии и ортопедии сформировались такие крупнейшие травматологи-ортопеды нашей страны как М.И.Ситенко, Я.Г.Дубров, В.Д.Чаклин, А.А.Корж.
Сейчас этот крупнейший НИИ травматологии и ортопедии Украины возглавляет профессор Николай Алексеевич Корж. Он не раз бывал в Ярославле, мы с ним дружим.
Московская школа травматологов-ортопедов организована в начале
20-х годов 20 века. Создателями её являются два профессора - Николай Николаевич Приоров и Валентина Валентиновна Гориневская. Московская школа создана позднее Санкт-Петербургской и Харьковской, так как ведущие московские хирурги и в первую очередь Сергей Сергеевич Юдин, главный хирург НИИ скорой помощи им. Н.В. Склифосовского считали, что травматология и ортопедия должны быть в составе общей хирургии.
В.В.Гриневская возглавляла травматологическое отделение в институте скорой помощи им. Н.В. Склифосовского и кафедру военно-полевой хирургии в институте усовершенствования врачей, а Н.Н.Приоров стал в 1921году директором Московского лечебно-протезного института, который в 1941г. был переименован в Центральный НИИ травматологии и ортопедии - ЦИТО.
В 1961 году Н.Н.Приоров неожиданно умер. Директором ЦИТО был приглашён детский ортопед Мстислав Васильевич Волков.
В 1963 г. М.В.Волков провёл в Москве первый съезд травматологов-ортопедов СССР и стал главным травматологом-ортопедом Советского Союза.
В 1967 г. вместе с министром здравоохранения СССР хирургом академиком АМН СССР Борисом Васильевичем Петровским издали Приказ о выделении травматологической службы из общей хирургии. Были определены коечные нормативы ортопедической и травматологической помощи в регионах, созданы кафедры травматологии, ортопедии и ВПХ в медицинских институтах, травматологические пункты в крупных городах.
История кафедры травматологии и ортопедии в Ярославском медицинском университете
Кафедра создана с 1 сентября 1968 года. До этого травматологию, ортопедию и ВПХ преподавали на кафедре госпитальной хирургии доценты Николай Васильевич Терентьев, Иван Григорьевич Бабенин, ассистент Владимир Васильевич Катанский.
Первым заведующим кафедрой по приказу ректора Георгия Викторовича Стовичека был назначен Николай Константинович Митюнин. В 1973 году (февраль) он по Приказу МЗ РФ был переведён на должность заместителя директора по научной работе в Курганский НИИ экспериментальной и клинической травматологии и ортопедии. Исполнять обязанности заведующего кафедрой стал доцент Николай Николаевич Соловьёв, а с 1 сентября 1976 года – доктор медицинских наук Вячеслав Васильевич Ключевский. Он заведовал кафедрой до 1.09.1017г. – 41 год. С 1 сентября 2017г. Приказом ректора Университета заведующим кафедрой был назначен профессор Игорь Иванович Литвинов.
Клинической базой кафедра в 1968 – 1970 г.г. было травматологическое отделение железнодорожной больницы г. Ярославля, а с 1 сентября 1970 г. – клиническая больница скорой медицинской помощи г. Ярославля с двумя 60-коечными травматологическими отделениями - 1-е отделение – повреждение опорно-двигательной системы и 2-е отделение - нейрохирургия и травма позвоночника, осложнённая повреждением спинного мозга.
С самого начала своей работы в клинике кафедра занималась лечением любых повреждений любых органов и систем. Эта первая особенность нашей кафедры. За прошедшие 45 с лишним лет КБ СМП им. Н.В. Соловьёва превратилась в единый для г. Ярославля и Ярославской области ортопедо-травматологический центр с 11-ю специализированными отделениями и травматологическим пунктом. Центр круглосуточно и ежедневно принимает больных с любыми повреждениями как городских, так и сельских жителей.
Вторая особенность нашей кафедры – за прошедшие годы работы мы выработали единые рациональные Протоколы лечения самых разнообразных травм. Они изложены в изданном на кафедре руководстве «Хирургия повреждений» и в книге «Протоколы диагностики и лечения изолированных механических повреждений и политравмы на этапах эвакуации», т.1500 экз., 17,6 п.л. В 2018 г. – второе издание 3 тыс. экз.
Эти протоколы разосланы по всем ФАПам, участковым и районным больницам нашего Ярославского–Костромского– Вологодского медицинского региона, подарены каждому у частнику XΙ съезда травматологов и ортопедов России.
Третья особенность нашей кафедры - мы сформировали новое направление в хирургии - антиотравматологию. Это, во-первых, лечение изолированных и сочетанных повреждений магистральных сосудов. Совместно с бригадой сосудистых хирургов, возглавляемых академиком Ю.В.Новиковым, мы оказываем помощь таким больным. Во время операции первичной хирургической обработки выполняется остеосинтез перелома, и после этого восстанавливается магистральный кровоток. В 1983г. на кафедре оперативной хирургии и нашей кафедре выполнена докторская диссертация Владимира Константиновича Миначенко – 834 клинических наблюдений изолированных и сочетанных повреждений магистральных сосудов (222 - в сочетании с открытыми и закрытыми переломами). В 1972 году в стенах нашей КБ СМП им Н.В.Соловьёва впервые в мире выполнена успешно реплантация оторваной нижней конечности на уровне коленного сустава (больной Юрий Ерохин, 18 лет).
Антиотравматология – это, во-вторых, изучение нарушений периферического кровообращения при переломах различных сегментов.
Мы доказали, что чем меньше мягких тканей в сегменте конечности (плечо, предплечье, кисть, бедро, голень, стопа), тем большее значение имеет внутрикостное кровообращение, и тем более переломы костей этих маломягкотканых сегментов сказываются на артериальном кровоснабжении и венозном оттоке с периферии. Мы обосновали новый приём первичной лечебной иммобилизации переломов костей стопы и голеностопного сустава – подвешивание конечности с поднятой стопой к надкроватной раме (кандидатская диссертация Ю.А.Фелимендикова).
Антиотравматология – это, в-третьих, немедикаментозная профилактика венозных тромбозов конечностей и тромбоэмболии у больных с переломами из-за местной гипокинезии и позиционных нарушениях венозного оттока (создание модифицированной шины Белера с возможностью дозированного поднятия голенной рамы).
Антиотравматология – это, в-четвёртых, изучение нарушений кровообращения при травматическом шоке, травмах груди (синдром сдавления груди).
Дата: 2019-07-30, просмотров: 523.