Простое вещество азот — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2), из которого на три четверти состоит земная атмосфера.
В технике азот получают фракционной перегонкой жидкого воздуха. В лаборатории азот получают нагреванием смеси крепких растворов хлорида аммония и нитрита натрия: NH4Cl + NaNO2 = N2 + 2H2O + NaCl или разложением нитрита аммония при нагревании: NH4NO2 = N2 + 2H2O
Наиболее чистый азот получается при термическом разложении азидов металлов, например: 2NaN3 = 2Na + 3N2
Лабораторный способ получения:
N4NO2 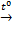 N2+ 2H2O3
N2+ 2H2O3
CuO+2NH3  3Cu+3H2O+N2
3Cu+3H2O+N2
Химическое строение молекулы азота характеризуется исключительной прочностью, несравнимой ни с какими другими двухатомными молекулами. Особая устойчивость молекулярного азота во многом определяет химию этого элемента. И кратность, и порядок связи в молекуле азота равны трем. Все это является причиной очень большой величины энтальпии диссоциации молекул азота и высокой их термической устойчивости Молекула азота состоит из 2 атомов. Оба атома в молекуле азота крепко связаны. Этим объясняется малая химическая активность свободного азота. При обычных условиях азот не реагирует ни с металлами ( кроме лития), ни с металлоидами. При повышении температуры химическая активность азота увеличивается главным образом по отношению к металлам. Молекула N2 прочна Е=9,49КДЖ/моль
При комнатной температуре азот взаимодействует только с литием, с образованием нитрида лития: N2 + 6Li = 2Li3N,(СО -3) с другими металлами азот взаимодействует при нагревании: N2 + 3Ca = Ca3N2. В реакциях взаимодействия азота с металлами, азот проявляет окислительные свойства, также окислительные свойства он проявляет при взаимодействии с водородом (при нагревании, повышенном давлении и в присутствии катализатора): N2 + 3H2 = 2NH3. Азот также взаимодействует и с другими неметаллами, проявляя при этом восстановительные свойства: N2+O2 = 2NO(энергия разряд), (СО = +2) N2 + 3F2 =2NF3.(СО= +3) Существуют и другие соединения азота с электроотрицательными элементами, но они являются неустойчивыми, и многие из них, особенно хлористый азот и йодистый азот, взрывчаты.
N2 + 3H2 = 2NH3,
NH3 нитрид водорода(аммиак) при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта) выделяется при гниении, проявляет основные свойства
NН4Cl+ КОН 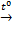 KCl+ NH4OH( разлагается NH3 и H2O)
KCl+ NH4OH( разлагается NH3 и H2O)
NH3 +Н2О  NH4OH
NH4OH
NH3H2O=NH4+ +OH- К дис = 1,7*10(-3)
Слабый кислотные св-ва
2NH3 +2Na=2NH3Na
Оксонитрид азота(I) (оксид диазота, закись азота, окись азота, веселящий газ) Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Закись азота является озоноразрушающим веществом, а также парниковым газом.
Закись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 °C и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, так как при температурах более 300 °C нитрат аммония разлагается со взрывом: 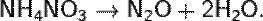
Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой: 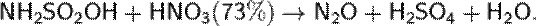
В химической промышленности закись азота является побочным продуктом и для её разрушения используют каталитические конвертеры, так как выделение в виде товарного продукта, как правило, экономически нецелесообразно. Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:


При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя: 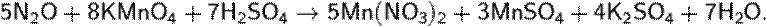
При нагревании N2O разлагается: 
NO — несолеобразующий оксид азота. В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет. Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации около 17 кДж/моль. Жидкий оксид азота(II) на 25 % состоит из молекул N2O2, а твёрдый оксид целиком состоит из них.
В лаборатории:
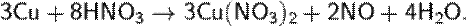
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
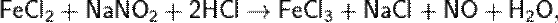
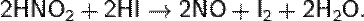
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (катализаторов):

Химические свойства:
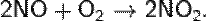


N2O3 — жидкость синего цвета (при н. у.), бесцветный газ (при стандартных условиях), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C
Получение:
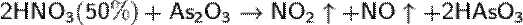
При пропускании электрического разряда через жидкий воздух N2O3 можно получить в виде порошка голубого цвета:
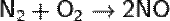

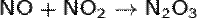
Химические свойства:
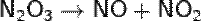
Являясь азотистым ангидридом, при взаимодействии с водой N2O3 даёт азотистую кислоту: и её соли
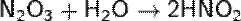
 N O2 — газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
N O2 — газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
Получение
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
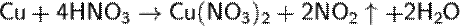
термическим разложением нитрата свинца
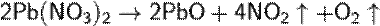
Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 - окислитель:



При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
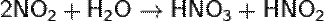
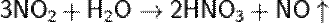
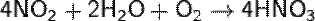


N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Получение
Путём дегидратации азотной кислоты HNO3 с помощью P2O5:


Пропуская сухой хлор над сухим нитратом серебра:
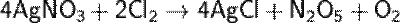

Химические свойства:
Типичный кислотный оксид. N2O5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
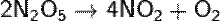
Растворяется в воде с образованием азотной кислоты (обратимая реакция):
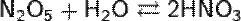
Растворяется в щелочах с образованием нитратов:

Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:

Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:

б) с основаниями:
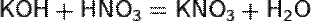
в) вытесняет слабые кислоты из их солей:
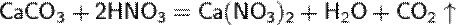
Азотная кислота в любой концентрации проявляет свойства кислоты окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Как кислота-окислитель, HNO3взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
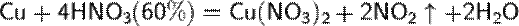
Разбавленная HNO3
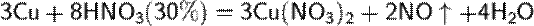
б) с металлами, стоящими в ряду напряжений левее водорода:

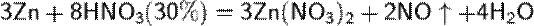
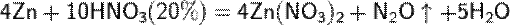
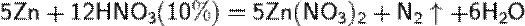
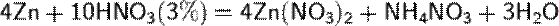
При увеличение концентрации кислоты 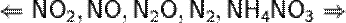 увеличение активности металла
увеличение активности металла
соль азотной кислоты, содержит однозарядный анион NO3−. Нитраты получают действием азотной кислоты HNO3 на металлы, оксиды, гидроксиды, соли. Практически все нитраты хорошо растворимы в воде. Нитраты устойчивы при обычной температуре. Соли азотной кислоты при нагревании разлагаются, причём продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:
левее Mg (кроме Li) При разложении образуют нитриты и кислород;

от Mg до Cu (включая Li) Дают при разложении оксид металла, NO2 и кислород.
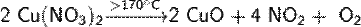
после Cu Образуют свободный металл, NO2 и кислород.
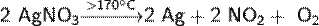
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры: Температура ниже 270°C:
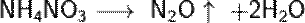
Температура выше 270 °C, или детонация:
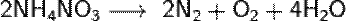 .
.

Соединения с отрицательными степенями окисления. Нитриды (ковалентные и ионные). Аммиак, КО и OВ характеристика, реакции замещения. Амиды. Аммиакаты. Свойства аминокислот как производных аммиака. Ион аммония и его соли, кислотные свойства, термическое разложение. Гидразин и гидроксиламин. КО и OВ характеристика. Азотистоводородная кислота и азиды.
Степень окисления - это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что соединения состоят только из ионов.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, причём знак ставится перед числом:-1, -2, +3, в отличии от заряда иона, где знак ставится после числа.
Степени окисления металлов в соединениях всегда положительные, высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключая некоторые элементы: золото Au+3 (I группа), Cu+2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru.
Степени неметаллов могут быть как положительными так и отрицательными, в зависимости от того с каким атомом он соединён: если с атомом металла то всегда отрицательная, если с неметаллом-то может быть и +, и - ( об этом вы узнаете при изучении ряда электроотрицательностей). Высшую отрицательную степень окисления неметаллов можно найти, вычтя из 8 номер группы, в которой находится данный элемент, высшая положительная равна числу электронов на внешнем слое ( число электронов соответствует номеру группы).
(-1)- F,{ Cl, Br, I-если соединены с водородом или металлами}
(-2) - O,{ S, Se, Te-в соединениях с водородом и металлами}
(-3) - {N, P, As}-в соединениях с водородом и металлами
Нитриды— соединения азота с менее электроотрицательными элементами, например, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4).
Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Строение
В зависимости от типа химической связи между атомами нитриды подразделяются на ионные, ковалентные и металлоподобные (ионно-ковалентно-металлические).
Ионная связь наблюдается а нитридах металлов I и II групп Периодической системы. Состав этих нитридов отвечает обычным валентным соотношениям. Эти нитриды подвергаются гидролизу с выделением аммиака, обладают высоким электрическим сопротивлением, у них наблюдаются полупроводниковые свойства).
Ковалентными нитридами являются нитриды бора, кремния, алюминия, галлия, индия. Ковалентные нитриды являются диэлектриками и полупроводниками с широкой запрещенной зоной.
Переходные металлы образуют нитриды с преимущественной металлической связью. Эти вещества обладают значительной твёрдостью и хрупкостью, высокой электропроводностью, высокими температурами плавления, большой энтальпией образования.
Аммиа́к— NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта)
Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4
Комплексобразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
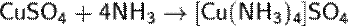
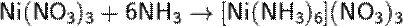
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Реакции замещения водорода менее характерны для аммиака, чем реакции присоединения. Однако при высоких температурах он способен замещать свои водороды на металл, например, по реакции:
2 Аl + 2 NH3 = 2 AlN + 3 H2 + 389 кДж.
Амидами называют производные кислот, в которых гидроксильная группа заменена на аминогруппу. Амиды можно рассматривать также как ацильные производные аминов. 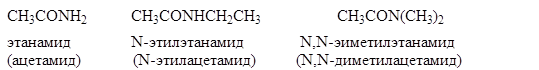
Большинство амидов представляет собой бесцветные кристаллические вещества. Низшие гомологи растворимы в воде. Из-за наличия межмолекулярных водородных связей у них относительно высокие температуры кипения.
Аммиакаты — продукты взаимодействия солей с аммиаком, комплексные соединения. Аммиакаты различаются как по составу [Ag(NH3)2]+, [Ni(NH3)4]2+, так и по устойчивости в водных растворах, используются в аналитической химии для обнаружения и разделения ионов металлов.
Аминокислоты – это производные углеводородов, в молекуле которых содержатся карбоксильная –СООН и аминогруппа – NH2.
| CH2COOH | NH2 | α-аминоуксусная (аминоэтановая) кислота (в биохимии – глицин, гликокол) |
| СН3CHCOOH | NH2 | a-аминопропионовая (2-аминопропановая) (в биохимии- аланин |
| СН3CHСН2COOH | NH2 | b-аминомасляная кислота (3-аминобутановая) |
По физическим свойствам – это бесцветные кристаллические вещества, хорошо растворимые в воде. Многие - сладкие на вкус.
Получают аминокислоты путем гидролиза белковых веществ или из галогенопроизводных карбоновых кислот:
R-CH-COOH + NH3 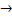 R-CH-COOH + HCl R-CH-COOH + HCl
|
В кристаллах и в водных растворах аминокислоты существуют в виде биполярных ионов, за счет перехода протона от карбоксильной группы к аминогруппе:
 CH2COOH = СН2СОО¯
CH2COOH = СН2СОО¯
| | +
NH2 NH3
биполярный ион
Не действует на индикатор, но проводит электрический ток.
Аминогруппа придает основные свойства, а карбоксильная – кислотные, поэтому аминокислоты - это амфотерные электролиты-амфолиты.
Свойства аминокислот как производных аммиака.
1. Аминокислоты как основания:
NH2-CH2-COOH+HCl=NH3Cl-CH2-COOH
Дата: 2019-07-30, просмотров: 751.