Важнейшим кислородным соединением кремния является диоксид кремния SiO2 (кремнезем), имеющий несколько кристаллических модификаций.
Низкотемпературная модификация (до 1143 К) называется кварцем. Кварц обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидностями кремнезема являются халцедон, опал, агат,. яшма, песок. [5, 322]
Кремнезем химически стоек; на него действуют лишь фтор, плавиковая кислота и растворы щелочей. Он легко переходит в стеклообразное состояние (кварцевое стекло). Кварцевое стекло хрупко, химически и термически весьма стойко. Отвечающая SiO2 кремниевая кислота не имеет определенного состава. Обычно кремниевую кислоту записывают в виде xH2O-ySiO2. Выделены кремниевые кислоты: H2SiO3 (H2O-SiO2) - метакремниевая (три-оксокремниевая), H4Si04 (2H20-Si02) - ортокремниевая (тетра-оксокремниевая), H2Si2O5 (H2O * SiO2) - диметакремниевая.
Кремниевые кислоты - плохо растворимые вещества. В соответствии с менее металлоидным характером кремния по сравнению с углеродом H2SiO3 как электролит слабее Н2СОз. [4,467 - 468]
Отвечающие кремниевым кислотам соли-силикаты-в воде нерастворимы (кроме силикатов щелочных металлов). Растворимые силикаты гидролизуются по уравнению
2SiOз2-+H20=Si2O52-+20H-.
Концентрированные растворы растворимых силикатов называют жидким стеклом. Обычное оконное стекло-силикат натрия и кальция-имеет состав Na20-CaO-6Si02. Его получают по реакции
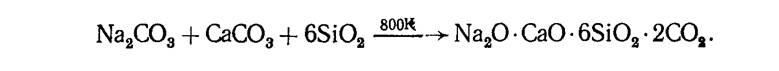
Известно большое разнообразие силикатов (точнее, оксосиликатов). В строении оксосиликатов наблюдается определенная закономерность: все состоят из тетраэдров Si04, которые через атом кислорода соединены друг с другом. Наиболее распространенными сочетаниями тетраэдров являются (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), которые как структурные единицы могут объединяться в цепочки, ленты, сетки и каркасы (рис 4).
Важнейшими природными силикатами являются, например, тальк (3MgO * H20-4Si02) и асбест (SmgO*H2O*SiO2). Как и для SiO2, для силикатов характерно стеклообразное (аморфное) состояние. При управляемой кристаллизации стекла можно получить мелкокристаллическое состояние (ситаллы). Ситаллы характеризуются повышенной прочностью.
Кроме силикатов в природе широко распространены алюмосиликаты. Алюмосиликаты - каркасные оксосиликаты, в которых часть атомов кремния заменена на трехвалентный Аl; например Na12 [ (Si, Al) 04] 12.
Для кремниевой кислоты характерно коллоидное состояние при воздействии на ее соли кислот H2SiO3 выпадает не сразу. Коллоидные растворы кремниевой кислоты (золи) при определенных условиях (например, при нагревании) можно перевести в прозрачную, однородную студнеобразную массу-гель кремниевой кислоты. Гели - высокомолекулярные соединения с пространственной, весьма рыхлой структурой, образованной молекулами Si02, пустоты которой заполнены молекулами H2O. При обезвоживании гелей кремниевой кислоты получают силикагель - пористый продукт, обладающий высокой адсорбционной способностью.
Оксид кремния (IV) (кремнезем) — наиболее распространенное в земной коре соединение, составляющее в виде различных минералов 12% ее массы. Различают кристаллический и аморфный кремнезем. Простейшая формула оксида кремния (IV) — SiO2. Он кристаллизуется в атомной решетке.
1) Кристаллический кремнезем — в виде минерала кварца и его разновидностей (горный хрусталь, халцедон, агат, яшма, кремень); кварц составляет основу кварцевых песков, широко используемых в строительстве и в силикатной промышленности.
2) Аморфный кремнезем — в виде минерала опала состава SiO2•nН2О; землистыми формами аморфного кремнезема являются диатомит, трепел (инфузорная земля); примером искусственного аморфного безводного кремнезема может служить силикагель, который получают из метасиликата натрия:
Na2SiO3+2HCl=2NaCl+H2SiO3
Силикагель имеет развитую поверхность, поэтому хорошо адсорбирует влагу.
Силикаге́ль представляет собой высушенный гель, образующийся из перенасыщенных растворов кремниевых кислот (nSiO2·mH2O) при pH > 5—6. Твёрдый гидрофильный сорбент.
Получение
Получается при подкислении растворов силикатов щелочных металлов с последующей промывкой и высушиванием образовавшегося геля:
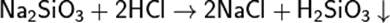
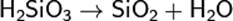
Кремниевые кислоты. SiO2 является ангидридом ряда кремниевых кислот
Кремниевая кислота построена из тетраэдрических структурных звеньев (в каждом таком звене атом кремния находится в центре тетраэдра, а по вершинам расположены атомы кислорода). Структурные звенья, объединяясь в цепи, образуют более устойчивые поликремниевые кислоты:
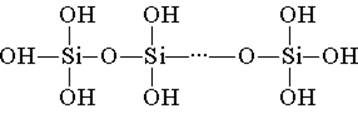
Состав такого соединения можно выразить формулой (H2SiO3)n. Однако обычно кремниевую кислоту изображают формулой H2SiO3. H2SiO3 — кислота очень слабая, в воде мало растворима. При нагревании легко распадается аналогично угольной кислоте:
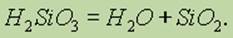
Все кремниевые кислоты очень слабые (слабее угольной).
Силикаты. Соли всех кремниевых кислот называют силикатами, хотя, как правило, в учебной литературе под силикатами подразумевают соли метакремниевой кислоты. Их состав обычно изображают формулой в виде соединений оксидов элементов. Например, силикат кальция CaSiO3 можно выразить так: СаО× SiO2.
Силикаты состава R2О× nSiO2, где R2O — оксиды натрия или калия, называются растворимым стеклом, а их концентрированные водные растворы — жидким стеклом. Наибольшее значение имеет натриевое растворимое стекло.
При стоянии на воздухе растворы силикатов мутнеют, так как находящийся в воздухе оксид углерода (IV) вытесняет кремниевую кислоту из ее солей:
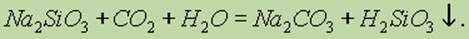
Кремниевая кислота практически нерастворима в воде — это свойство используют как качественную реакцию на ион SiO32- .
Силикаты получают сплавлением оксида кремния с щелочами или карбонатами:
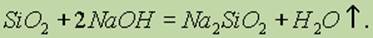
Растворимость кремневой кислоты и скорость ее растворения зависят от нескольких факторов, из которых важнейшие — взятая модификация двуокиси кремния, степень ее дисперсности и температура. При встряхивании с водой геля кремневой кислоты равновесие растворимости устанавливается за несколько часов, в случае кварца нужны многие месяцы и даже годы.
СИЛИКАТЫ ПРИРОДНЫЕ — класс минералов, солей кремниевой, изо- и гетерополикремниевых кислот. На долю силикатов природных приходится до 75% массы земной коры и около 25% минеральных видов. В природе известно свыше 700 силикатов природных, включая важнейшие породообразующие минералы (полевые шпаты, пироксены, амфиболы, слюды и др.)
Алюмосиликаты — группа природных и синтетических силикатов, комплексные анионы которых содержат кремний и алюминий. Примеры комплексных анионов: [AlSiO4]−, [AlSi4O10]−, [Al2Si3O10]2−. В качестве катионов выступают Na+, K+, Mg2+, Ca2+, а иногда Ba2+ и Li+.
Природные алюмосиликаты являются наиболее распространёнными минералами, на их долю приходится до 50 % массы земной коры. К ним относятся полевые шпаты (альбит, ортоклаз, анортит), глинистые минералы и слюды.
Цеолиты — это водные алюмосиликаты кальция, натрия, калия, бария и некоторых других элементов. В группу цеолитов входит более сорока минералов, которые различаются и по составу (в особенности по количеству молекул воды в кристаллогидрате), и конечно же по физическим и химическим свойствам. Но практически у всех представителей этой группы минералов есть общее свойство — они хорошие сорбенты, обладают ионообменными свойствами, способны изменять подвижность отдельных ионов и работать молекулярными ситами. А сравнительно недавно эти минералы нашли совершенно неожиданное применение — их стали использовать в сельском хозяйстве.
Кремнийорганические соединения — соединения, в молекулах которых имеется связь между атомами кремния и углерода. Кремнийорганические соединения иногда называют силиконами, от латинского названия кремния «силициум». Кремнийорганические соединения используются для производства смазок, полимеров, резин, каучуков, кремнийорганических жидкостей и эмульсий. Кремнийорганические соединения применяются в косметике, бытовой химии, лакокрасочных материалах, моющих средствах. Отличительной особенностью продукции на основе кремнийорганических соединений от продукции на основе обычных органических соединений являются, как правило, более высокие эксплуатационные качества и характеристики, а также безопасность применения человеком. Кремнийорганические полимеры могут использоваться для изготовления форм в кулинарии. Полимеризация кремнийорганических компаундов и герметиков безопасна для человека и не требует вытяжки.
СИЛОКСАНЫ - соединения, содержащие в молекуле чередующиеся атомы кремния и кислорода. Наибольшее имеют высокомолекулярные силоксаны - полиорганосилоксаны; см. Кремнийорганические полимеры.
Силико́ны (полиорганосилоксаны) — кислородосодержащие высокомолекулярные кремнийорганические соединения с химической формулой [R2SiO]n, где R = органическая группа (метильная, этильная или фенильная). Сейчас этого определения придерживаются уже крайне редко, и в «силиконы» объединяются также полиорганосилоксаны (например силиконовые масла типа ПМС, гидрофобизаторы типа ГКЖ или низкомолекулярные каучуки типа СКТН) и даже кремнийорганические мономеры (различные силаны), стирая различия между понятиями «силиконы» и «кремнийорганика».
В медицинской практике применяют кремний (IV) SiC – карборунд для шлифовки пломб и пластмассовых протезов. Диоксид кремний SiO2 входит в состав силикатных цементов.
86. Элементы подгруппы германия. Общая характеристика. Устойчивость водородных соединений. Соединения с галогенами типа ЭГ2 и ЭГ4, поведение в водных растворах. Оловохлористоводородная кислота. Оксиды. Оксид свинца(IV) как сильный окислитель. Амфотерность гидроксидов. Растворимые и нерастворимые соли олова и свинца. OВ реакции в растворах. Химизм токсического действия соединений свинца. Применение в медицине свинецсодержащих препаратов (свинца(II) ацетат, свинца(II) оксид). Химические основы использования соединений олова и свинца в анализе фармпрепаратов.
Германий, олово, свинец – электронные аналоги. Валентными являются 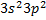 -электроны. Вряду Ge , Sn , Pb уменьшается роль внешней s-электронной пары в образовании химических связей. Так, если для германия наиболее характерна степень окисления +4, то для свинца +2.
-электроны. Вряду Ge , Sn , Pb уменьшается роль внешней s-электронной пары в образовании химических связей. Так, если для германия наиболее характерна степень окисления +4, то для свинца +2.
Изменение степени окисления в ряду C - Si - Ge - Sn - Pb можно объяснить вторичной периодичностью в различии энергии ns- и np-орбиталей (немонотонное изменение радиусов атомов, энергии ионизации, сродства к электрону).
Содержание германия в земной коре 1,5 · 10–4 % по массе. Он относится к рассеянным элементам, в природе в свободном виде не встречается. Содержится в виде примесей в силикатах, различных рудах, углях, торфе, нефти, в термальных водах и водорослях. Компактный германий — вещество серебристого цвета с металлическим блеском, кристаллическая решётка устойчивой модификации. Диамагнитен. Обладает полупроводниковыми свойствами. Хрупок, не поддаётся холодной и горячей обработке.
Германий устойчив к действию воздуха, воды, О2, соляной кислоты и разбавленной H2SO4, медленно реагирует с концентрированной Н2SO4.
Реагирует с царской водкой и HNO3 с образованием на поверхности плёнки GeO2.
Слабо реагирует с растворами едких щелочей, в присутствии Н2О2 — легко, при этом образуются соли — германаты.
Олово Sn содержится в земной коре в количестве 8 · 10–3 % по массе. Самородное олово в природе не встречается. Известны 16 минералов олова, наиболее важен касситерит.
Олово — серебристо-белый блестящий металл, обладающий незначительной твёрдостью, большой пластичностью, ковкостью и легкоплавкостью. Ниже 13,2°С устойчива a-модификация [серое олово], выше 13,2°С — b-модификация [белое олово].
При обычных условиях олово устойчиво к химическим воздействиям. Заметное окисление олова на воздухе наблюдается при 150°С и выше. Тонкая поверхностная плёнка оксидов делает олово устойчивым и по отношению к воде. В разбавленной HCl олово растворяется очень медленно, в концентрированной — быстро, с образованием хлорооловянных кислот.
С разбавленной H2SO4 олово почти не реагирует, с концентрированной H2SO4 взаимодействует медленно.
В разбавленной HNO3 олово растворяется с образованием нитрата Sn(NO3)2. Концентрированная HNO3 энергично взаимодействует с оловом, давая нерастворимую в воде b-оловянную кислоту.
Олово очень хорошо растворяется в царской водке. С растворами щелочей медленно реагирует даже на холоду, при этом в растворе образуются гидроксостаннат-ионы [Sn(OH)6]2–.
Свинец Pb. Свойства соединений олова и свинца во многом похожи. Олово (II) и свинец (II) оксиды SnO и PbO амфотерны так же, как и соответствующие гидроксиды Sn(OH)2 и Pb(OH)2.
Соли Pb2+ — ацетат, нитрат — хорошо растворимы в воде, малорастворимы хлорид и фторид, практически нерастворимы сульфат, карбонат, сульфид. Все соединения свинца (II), в особенности растворимые, ядовиты.
Для германия, как аналога С и Si, характерна способность образовывать германоводороды (GeH4 — моногерман, Ge2H6 и Ge3H8).
Гидрид GeH4 — бесцветный газ, растворяется в воде и полярных органических растворителях.
Гидриды германия и олова выделяются при действии разбавленных кислот на германиды и станиды:
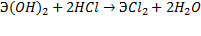
Дата: 2019-07-30, просмотров: 458.