Чистая азотная кислота – бесцветная жидкость, при -42oС застывающая в прозрачную кристаллическую массу.
Азо́тная кислота́ (HNO 3 ) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Кислота ядовита.
На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары её образуют с влагой воздуха мелкие капельки тумана. Азотная кислота не отличается прочностью. Уже под влияние света она постепенно разлагается:
4HNO3 = 4NO2↑ + O2↑ + 2H2O.
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Получение азотной кислоты
Азотная кислота образуется в результате действия окислителей на азотистую кислоту:
5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O.
Безводная азотная кислота может быть получена перегонкой при пониженном давлении концентрированного раствора азотной кислоты в присутствии P4O10 или H2SO4 в полностью стеклянном оборудовании без смазки в темноте. Промышленный процесс производства азотной кислоты основан на каталитическом окислении аммиака над нагретой платиной:
NH3 + 2O2 = HNO3 + H2O.
Химические свойства Азотной кислоты :
Азотная кислоты принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью диссоциирует на ионы. Её соли носят название нитраты.
HNO3↔H+ + NO3—.
Характерным свойством азотной кислоты является её ярко выраженная окислительная способность. Азотная кислота – один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор – в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO3, ярко разгорается.
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы – в оксиды.Концентрированная азотная кислота пассивирует некоторые металлы. При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется диоксид азота. В случае более активных металлов – железа, цинка – образуется оксид диазота. Сильно разбавленная азотная кислота взаимодействует с активными металлами – цинком, магнием, алюминием – с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Cu + HNO3 (conc) = Cu(NO3)2 + NO2↑ + H2O;
Cu + HNO3 (разб.) = Cu(NO3)2 + NO↑ + H2O;
Mg + HNO3 (разб.) = Mg(NO3)2 + N2O↑ + H2O;
Zn + HNO3 (разб.) = Zn(NO3)2 + NH4NO3 + H2O.
При действии азотной кислоты на металлы водород, как правило, не выделяется.
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Смесь, состоящая из 1 объема азотной и 3-4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото. Действие её объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила, NOCl:
HNO3 + 3HCl = Cl2 + 2H2O + NOCl.
Нитраты азотной кислоты :
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы и некоторые соединения неметаллов, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния (исключая литий):
{\displaystyle {\mathsf {2KNO_{3}\rightarrow 2KNO_{2}+O_{2}}}}2KNO3→2KNO2+O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью (а также литий):
{\displaystyle {\mathsf {4Al(NO_{3})_{3}\rightarrow 2Al_{2}O_{3}+12NO_{2}+3O_{2}}}}4AL(NO3)3→2AL2O3+12NO2+O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
{\displaystyle {\mathsf {2AgNO_{3}\rightarrow 2Ag+2NO_{2}+O_{2}}}}2AgNO3→2Ag+2NO2_O2
г) нитрат аммония:
{\displaystyle {\mathsf {NH_{4}NO_{3}\rightarrow N_{2}O+2H_{2}O}}}NH4NO3→N20+2H2O
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
{\displaystyle {\mathsf {Fe+3KNO_{3}+2KOH\rightarrow K_{2}FeO_{4}+3KNO_{2}+H_{2}O}}}Fe+3KNO3+2KOH→K2FeO4+3KNO2+H2O
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
3KNO3+8Al+5KOH+18H2O→3NH3↑+8К [Al(OH)4]
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4
Применение Азотной кислоты :
Азотная кислота – одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Производство азотной кислоты:
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
4 NH3+5O2-4NO +6H20
2NO+O2-2NO2
4NO2+O2+2H2O-4HNO3
Все три реакции — экзотермические, первая — необратимая, остальные — обратимые[5]. Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется[6].Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса
Применение :
· в производстве минеральных удобрений;
· в военной промышленности (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);
· крайне редко в фотографии — разбавленная — подкисление некоторых тонирующих растворов[7];
· в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише);
· в производстве красителей и лекарств (нитроглицерин);
· в ювелирном деле — основной способ определения золота в золотом сплаве;
· в основном органическом синтезе (нитроалканы, анилин, нитроцеллюлоза, тротил)
Действие на организм :
Азотная кислота ядовита. По степени воздействия на организм относится к веществам 3-го класса опасности. Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м. Рейтинг NFPA 704 для концентрированной азотной кислоты: опасность для здоровья: 4, огнеопасность: 0, нестабильность: 0.
91.
Фосфор. Общая характеристика:
Фосфор(Р)- химический элемент15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатитCa5(PO4)3 (F,Cl,OH), фосфорит ( Сa3(PO4)2 ) и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Получение :
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
{\displaystyle {\mathsf {2Ca_{3}(PO_{4})_{2}+10C+6SiO_{2}\rightarrow P_{4}+10CO+6CaSiO_{3}}}} 2Ca3(PO4)2+10C+6SiO2→P4+10CO+6CaSiO3 или Ca 3 (PO 4 ) 2 + 3SiO 2 +5C = 3CaSiO 3 +5CO+2P.
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
4 HPO 3+10 C → P 4+2 H 2 O +10 CO
Химические свойства :
Фосфор легко окисляется кислородом:
4P+3O2→2P2O5 ( С избытком кислорода )
4 P +3 O 2→2 P 2 O 3(при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
2P+3Ca→Ca3P2
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
2P+3S→P2S3
2P+5Cl2→2PCl5
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
Ca3P2+6H20→ 2PH3+3Ca(OH)2
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — РH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
8P+12H2O→5PH3+3H3PO4
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования
4P+3KOH+3H2O→PH3+3KH2PO2
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
2P+5H2SO4→2H3PO4+5SO2+2H2O
3P+5HNO3+2H20→3H3PO4+5NO
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P+5KCLO3→5KCL+3P2O5
Аллотропические модификации фосфора, их химическая активность
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все существующие аллотропные модификации фосфора пока (2016 г.) до конца не изучены. Традиционно различают четыре его модификации: зеленовато-белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
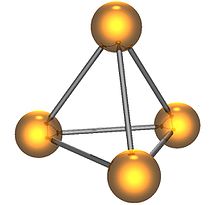
Молекула белого фосфора
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра[6]. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде ,но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой[7].
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей.При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10.
Так как фосфор реагирует с водой лишь при температуре свыше 500 градусов по Цельсию, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция)
Красный фосфор
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8⋅106 Па.
Металлический фосфор
При 8,3⋅1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25⋅1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
{\displaystyle {\mathsf {3KNO_{3}+8Al+5KOH+18H_{2}O\rightarrow 3NH_{3}\uparrow +8K[Al(OH)_{4}]}}}
92. Фосфиды. Фосфин. Сравнение с соответствующими соединениями азота.
Фосфи́ды — бинарные соединения фосфора с другими менее электроотрицательными химическими элементами, в которых фосфор проявляет отрицательную степень окисления.
Получение
Большинство фосфидов представляют собой соединения фосфора с типичными металлами, которые получаются прямым взаимодействием простых веществ:
Na + P(красн.) → Na3P + Na2P5 (200 °C)
Фосфид бора можно получить как прямым взаимодействием веществ при температуре около 1000 °C, так и реакцией трихлорида бора с фосфидом алюминия:
BCl3 + AlP → BP + AlCl3 (950 °C)
Химические свойства :
Фосфиды металлов — неустойчивые соединения, которые разлагаются водой и разбавленными кислотами. При этом получается фосфин и, в случае гидролиза, — гидроксид металла, в случае взаимодействия с кислотами — соли.
Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3
Ca3P2 + 6HCl → 3CaCl2 + 2PH3
При умеренном нагревании большинство фосфидов разлагаются. Плавятся под избыточным давлением паров фосфора.
Фосфид бора BP, наоборот, тугоплавкое (tпл. 2000 °C, с разложением), весьма инертное вещество. Разлагается только концентрированными кислотами-окислителями, реагирует при нагревании с кислородом, серой, щелочами при спекании.
Фосфин :
РН3 - — бесцветный ядовитый газ (при нормальных условиях). Чистый фосфин не имеет запаха, но образцы технического продукта обладают неприятным запахом, похожим на запах тухлой рыбы.
Физические свойства :
Бесцветный газ. Плохо растворяется в воде, образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства[2]. При низких температурах образует твёрдый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0,142 нм, ∠HPH = 93,5°). Дипольный момент составляет 0,58 Д, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
2P4+2Ca(OH)2+6H2O→2PH3+3Ca(H2PO2)2
Также его можно получить воздействием воды или кислот на фосфиды:
Ca3P2 +6H2O→2PH3↑+3Ca(OH)2
MgP2+6HCl→2PH3↑+3MgCl2
Химические свойства :
Фосфин сильно отличается от своего аналога, аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H−P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
2PH3→2P+3H2
На воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
PH3+2O2→H3PO4
Проявляет сильные восстановительные свойства:
PH3+3H2SO4→H2(PHO2)+3SO2↑+3H2O
PH3+8HNO3→H3PO4+8NO↑+4H2O
PH3+2I2+2H2O→H(PH2O2)+4HI
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+(аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
PH3+HCl→PH4Cl
PH3+HI→PH4I
Соли фосфония, как и сам фосфин, являются сильными восстановителями.
Токсичность
Фосфин очень ядовит, негативно воздействует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2—4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу. В крови человека содержание фосфина не более 0,001 мг/л.
93. Соединения фосфора в положительных степенях окисления.
Фосфор может существовать в виде простого вещества– неметалла, а как известно, степень окисления неметаллов в элементарном состоянии равна нулю.При нагревании фосфор окисляет почти все металлы, образуя фосфиды, в которых его степень окисления равна (-3):Mg3P-32, P-3H3.В качестве соединений фосфора, в которых он проявляет степень окисления равную (+1) можно рассматривая производные фосфинат-иона ([P+1O2H2]—), например его водородное производное – фосфиновую кислоту (H[P+1O2H2]).Для фосфора характерна степень окисления (+3): P+3Cl3, P+3Br3, P+32O3, H2[P+3O3H] (фосфоновая кислота).Фосфор проявляет степень окисления (+5) в соединениях с галогенами, кислородом, серой и азотом (P+5Cl5, P+52O5, P+52S5, P+53N5), а также в соединениях смешанного типа (H3P+5O4, P+5OCl3, P+52O3S2, P+5ON, P+5NCl2 и т.д.).
Оксиды фосфора :
Р4О6 и Р4О10 – кислотные оксиды, имеют молекулярное строение, являются твердыми веществами (tпл(Р4О6)=23,8°С, молекулярная модификация Р4О10 возгоняется при 3590С, а полимерная модификация плавится при 580°С), оба растворяются в воде, давая гидроксиды, являющиеся кислотами, фосфористой и ортофосфорной, соответственно. Оксид фосфора (V) очень гигроскопичен, поглощает влагу из воздуха, поэтому используется в качестве осушителя, а также в качестве водоотнимающего средства:
Р2О5 + HNO3 = HPO3 + N2O5
При этом образуется метафосфорная кислота или полифосфорные кислоты – (HPO3)3-4. Оксид фосфора (III), в котором фосфор находится в промежуточной степени окисления, способен к реакциям дальнейшего окисления и к реакциям диспропорционирования, например:
P4O6 + 2O2 = P4O10 P4O6 + 6H2O (гор) = 3H3PO4 + PH3↑
При 210°С в атмосфере Н2 происходит реакция 5P4O6 = 2P4 + 3P4O10. Оксид фосфора (V) окислительными свойствами не обладает, а сам может быть получен при окислении фосфора в безводных условиях, например, при термическом разложении некоторых солей:
6P + 5KClO3 = 3P2O5 + 5KCl
Дата: 2019-07-30, просмотров: 402.