Свойства азотистоводородной кислоты. Чистая безводная азостистоводородная кислота представляет собою бесцветную, легко подвижную, обладающую острым запахом жидкость плотностью 1,10, температура кипения которой 37° С и 35,7° С ; в любых соотношениях кислота смешивается с водой и спиртом.
Азотистоводородная кислота имеет рН = 4,67. Уксусная кислота в значительной степени вытесняется азотистоводородной кислотой из уксуснокислых солей аммония, кадмия, хрома, кобалта, никеля, ртути и натрия, при этом образуются соответствующие азиды. Подобное действие производит HN3 на мышьяковистые соли кальция, меди, железа и калия. Азиды кадмия, свинца, меди и марганца не растворяются в HN3.
Для азотистоводородной кислоты, кроме кислотной функции, характерна также окислительная функция. Взаимодействие ее с HI сопровождается выделением и образованием продуктов восстановления HN3 — азота и аммиака. Восстановительная функция для HN3 не характерна, но с некоторыми сильными окислителями она все же взаимодействует. В частности, азотистая кислота быстро окисляет HN3:
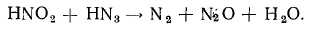
Безводная азотистоводородная кислота как в жидком, так и в парообразном состоянии, исключительно чувствительна к внешним воздействиям и взрывается с чрезвычайной силой. Еще в своих первых работах Курциус обращал внимание на большую чувствительность азотистоводородной кислоты и опасность обращения с ней.
Азиды химические соединения, содержащие одну или несколько групп — N3, производные азотистоводородной кислоты HN3.
К неорганическим А. относятся соли HN3 [например, А. натрия NaN3, А. свинца Pb(N3)2], галогеназиды (например, хлоразид CIN3) и др. Большинство неорганических А. взрывается при лёгком ударе или трении даже во влажном состоянии; таков, например, Азид свинца, применяющийся как инициирующее взрывчатое вещество. Исключение составляют NaN3 и др. соли щелочных и щёлочноземельных металлов. Исходным материалом для получения др. солей HN3, а также самой кислоты обычно служит А. натрия, получаемый пропусканием закиси азота через расплавленный амид натрия:
NaNH2 + ON2 = NaN3+H2O.
Все органические А., алкильные и арильные (общей формулы RN3) или ацильные ( 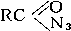 2) N3.
2) N3.
Соединения Азота в положительных степенях окисления :
Соединения с Металлами : Их получают непосредственным взаимодействием простых веществ с металлами при высокой температуре. s-Элементы групп IA и IIA (щелочные и щелочноземельные металлы) образуют солеподобные соединения состава Ме3Э, Ме3Э2. Эти соединения легко разлагаются водой и кислотами:
Mg3N2 + 6H2O = 2NH3 + 3Mg(OH)2,
d- и f-Элементы образуют соединения переменного состава, часто нестехиометрического состава, не разлагающиеся водой и кислотами. Эти соединения характеризуются металлическими или полупроводниковыми свойствами.
Соединения с Галогенами : Они имеют состав ЭГ3 и ЭГ5 (кроме азота). ЭГ3 и ЭГ5 – газы, жидкости или твёрдые вещества с низкими температурами плавления. Исключение составляет BiГ3 – твёрдое вещество с высокой температурой плавления.
NГ3, кроме NF3, - чрезвычайно взрывчатые вещества.
Оксиды :
Для азота известны оксиды, в которых азот проявляет степени окисления от +1 до +5, для Р, AS, Sb, Bi известны оксиды со степенью окисления элемента +3 и +5.
Оксиды Азота : Азот образует шесть оксидов, степень окисления азота в которых меняется от +1 до +5: N2O, NO, N2O3, NO2, N2O5. Все оксиды азота – окислители, особенно сильный окислитель N2O5.
При непосредственном взаимодействии азота с кислородом образуется только оксид азота (II) – NO (реакция идет при очень высокой температуре), остальные оксиды получают косвенным путем. N2O и NO – несолеобразующие оксиды.
Оксид азота (I) N2O («веселящий газ», закись азота) – бесцветный газ со слабым приятным запахом и сладковатым вкусом, температура плавления –910С, температура кипения –880С, термически неустойчив, плохо растворяется в воде, малореакционноспособный (не реагирует с разбавленными кислотами, щелочами, гидратом аммиака, кислородом).
Установлено, что молекула оксида азота (I) имеет линейное строение:
О = N += N ‾
что соответствует sp-гибридизации валентных орбиталей центрального атома. Они образуют две σ-связи. Оставшиеся негибридизованными одноэлектронные рy и pz атомные орбитали участвуют в образовании двух π-связей: одной двухцентровой N – N связи и другой трехцентровой делокализованной N --- N --- O связи. Следовательно центральный атом азота четырехвалентен, а концевой – двухвалентен.
Реакции получения N2O:
NH4NO3 → N2O + 2H2O (190 – 2450C),
4Ca + 10HNO3 (конц.) = N2O + 4Ca(NO3)2 + 5H2O,
8Al + 30HNO3 (разб.) = 3N2O + 8Al(NO3)3 + 15H2O,
2NaNO3 + (NH4)2SO4 = 2N2O + Na2SO4 + 4H2O (3000C),
2KNO3 + (NH4)2SO4 = 2N2O + K2SO4 + 4H2O (3000C).
При температуре выше 5000С оксид азота (I) разлагается:
2N2O = 2N2 + O2.
Оксид азота (I) может проявлять свойства окислителя для элементов, реагирующих с кислородом:
N2O + H2 = N2 + H2O, (150 – 2000C),
6N2O + P4 = 6N2 + P4O6 (6000C),
2N2O + C (графит) = 2N2 + CO2, (450 – 6000C),
N2O + Mg = N2 + MgO.
С сильными окислителями N2O может проявлять свойства восстановителя:
N2O + H2SO4 (конц., гор.) = 2NO ↑ + SO2 ↑ + H2O.
Оксид азота (I) используется в медицине для ингаляционного наркоза. Вдыхание небольших количеств этого газа вызывает состояние, сходное с опьянением, отсюда его название «веселящий газ». Большие количества вызывают состояние наркоза.
Оксид азота (II) NO (монооксид азота) – бесцветный газ, температура плавления –1640С, температура кипения –1510С, очень устойчив к нагреванию, плохо растворяется в воде, не реагирует с водой, разбавленными кислотами, щелочами что подтверждает свойства несолеобразующего оксида.
Реакции получения NO:
N2 + O2 = 2NO (20000C, катализа
NH3 + 5O2 = 4NO + 6H2O (8000C, катализатор),
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO ↑ + 4H2O,
Fe +4HNO3 (разб.) = NO ↑ + Fe(NO3)3 + 2H2O,
В химических реакциях оксид азота (II) может быть восстановителем и окислителем, так как атом азота в оксиде имеет промежуточную степень окисления:
2NO + O2 = 2NO2,
NO + O3 = NO2 + O2,
2NO + Cl2 = 2NOCl,
2NO + 2H2 = N2 + 2H2O,
2NO + C (графит) = N2 + CO2 (5000C),
10NO + 4P (красн.) = 5N2 + P4O10 (150 – 2000C),
2NO + 2H2S = N2 + 2S + 2H2O (3000C),
2NO + 4Cu = N2 + 2Cu2O (5000C).
В настоящее время установлено, что NO обязательно синтезируется в организме человека с помощью фермента NO-синтазы из аминокислоты аргинина. Время жизни NO в клетках организма составляет порядка секунды, но их нормальное функционирование невозможно без NO. Это простое соединение обеспечивает в организме человека расслабление гладких мышц сосудов, регуляцию работы сердца, эффективную работу иммунной системы, передачу нервных импульсов и т.д. Есть предположения, что NO играет важную роль в обучении и запоминании. За открытие синтеза NO в организме и исследование его физиологической роли Р. Фурчготт, Л. Игнарро и Ф. Мурад в 1988 г. были удостоены Нобелевской премии.
Однако NO может оказывать и токсическое действие на организм человека, объясняется это тем, что этот оксид образует комплексное соединение с катионом гемоглобина HHbNO. Устойчивость этого соединения в 60 раз больше, чем устойчивость оксигемоглобина. В этом причина токсичности NO.
Оксид азота (III) N2O3 (азотистый ангидрид) – синяя жидкость, термически неустойчивая. При комнатной температуре на 90% разлагается на NO и NO2 (N2O3 = NO + NO2) и окрашивается в бурый цвет (NO2), не имеет температуры кипения, так как NO испаряется первым. В твердом состоянии белое или голубоватое вещество с ионным строением. В газе имеет молекулярное строение ON — NO2. Оксид проявляет кислотные свойства, реагирует с водой, щелочами.
Реакции получения N 2 O 3:
NO+N2O3↔N2O
Реакции:
3N2O3 + H2O (гор.) = 2HNO3 + 4NO ↑,
N2O3 + 2NaOH (разб.) = 2NaNO2 + H2O.
Триоксид азота энергично реагирует с кислородом:
2N2O3 + O2 = 2N2O4 (- 100C).
Оксид азота (IV) NO2– ядовитый бурый газ. Молекула этого оксида имеет угловую форму и кратность связи, равную 1.5 (отсюда ясно, что такая связь является промежуточной между одинарной и двойной связью).
Реакции получения диоксида азота:
2NO + O2 = 2NO2,
2Pb(NO3)2 = 2PbO + 4NO2 + O2 (t › 2000C),
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Реакции:
NO2 взаимодействует с горячей водой, образуя азотную кислоту, и с растворами щелочей, образуя соли азотной и азотистой кислоты:
3NO2 + H2O (гор.) = 2HNO3 + NO ↑
При растворении NO2 в воде образуются две кислоты: азотная и азотистая:
NO2 + H2O = HNO2 + HNO3
А при растворении диоксида азота в растворе щелочи получаются соли двух кислот – азотистой и азотной:
2NO2 + 2NaOH (разб.) =NaNO3 + NaNO2 + H2O
Если растворение NO2 в воде проводить в присутствии кислорода, то происходит образование азотной кислоты:
4NO2 + O2 + 2H2O =4HNO3.
Диоксид азота очень сильный окислитель, вызывает коррозию металлов:
2NO2 + 7H2 = 2NH3 + 4H2O (кат. Pt),
2NO2 + 2S = N2 + 2SO2,
10NO2 + 8P = 5N2 + 2P4O10,
2NO + 4Cu = N2 + 4CuO (5000C).
Дата: 2019-07-30, просмотров: 408.