Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей. Например, для гидроксида и оксида алюминия:
а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2О3 + 3H2SO4 = Al2(SO4)3 + 3H2O
б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O (в расплаве)
Al2О3 + 2NaOH(т) = 2NaAlO2 + H2O (в расплаве)
В реакциях (а) Al(OH)3 и Al2О3 проявляют свойства оснóвных гидроксидов и оксидов, то есть они подобно щелочам реагируют с кислотами и кислотными оксидами, образуя соль, в которой алюминий является катионом Al3+.
Напротив, в реакциях (б) Al(OH)3 и Al2О3 выполняют функцию кислотных гидроксидов и оксидов, образуя соль, в которой атом алюминия AlIII входит в состав аниона (кислотного остатка) AlО2−.
Сам элемент алюминий проявляет в этих соединениях свойства металла и неметалла. Следовательно, алюминий - амфотерный элемент.
Подобные свойства имеют также элементы А-групп - Be, Ga, Ge, Sn, Pb, Sb, Bi и другие, а также большинство элементов Б-групп - Cr, Mn, Fe, Zn, Cd и другие.
Например, амфотерность цинка доказывают такие реакции:
а) Zn(OH)2 + N2O5 = Zn(NO3)2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
б) Zn(OH)2 + Na2O = Na2ZnO2 + H2O
ZnO + 2NaOH(т) = Na2ZnO2 + H2O
Если амфотерный элемент имеет в соединениях несколько степеней окисления, то амфотерные свойства наиболее ярко проявляются для промежуточной степени окисления.
Например, у хрома известны три степени окисления: +II, +III и +VI. В случае CrIII кислотные и оснóвные свойства выражены примерно в равной степени, тогда как у CrII наблюдается преобладание оснóвных свойств, а у CrVI - кислотных свойств:
CrII → CrO, Cr(OH)2 → CrSO4
CrIII → Cr2O3, Cr(OH)3 → Cr2(SO4)3 или KCrO2
CrVI → CrO3, H2CrO4 → K2CrO4
Очень часто амфотерные гидроксиды элементов в степени окисления +III существуют также в мета-форме, например:
AlO(OH) - метагидроксид алюминия
FeO(OH) - метагидроксид железа (орто-форма "Fe(OH)3" не существует).
Амфотерные гидроксиды практически нерастворимы в воде, наиболее удобный способ их получения - осаждение из водного раствора с помощью слабого основания - гидрата аммиака:
Al(NO3)3 + 3(NH3 · H2O) = Al(OH)3↓ + 3NH4NO3 (20 °C)
Al(NO3)3 + 3(NH3 · H2O) = AlO(OH)↓ + 3NH4NO3 + H2O (80 °C)
В случае использования избытка щелочей в обменной реакции подобного типа гидроксид алюминия осаждаться не будет, поскольку алюминий в силу своей амфотерности переходит в анион:
Al(OH)3(т) + OH− = [Al(OH)4]−
Примеры молекулярных уравнений реакций этого типа:
Al(NO3)3 + 4NaOH(избыток) = Na[Al(OH)4] + 3NaNO3
ZnSO4 + 4NaOH(избыток) = Na2[Zn(OH)4] + Na2SO4
Образующиеся соли относятся к числу комплексных соединений (комплексных солей): они включают комплексные анионы [Al(OH)4]− и [Zn(OH)4]2−.
Названия этих солей таковы:
Na[Al(OH)4] - тетрагидроксоалюминат натрия
Na2[Zn(OH)4] - тетрагидроксоцинкат натрия
Продукты взаимодействия оксидов алюминия или цинка с твердой щелочью называются по-другому:
NaAlO2 - диоксоалюминат(III) натрия
Na2ZnO2 - диоксоцинкат(II) натрия
Подкисление растворов комплексных солей этого типа приводит к разрушению комплексных анионов.
Например: 2Na[Al(OH)4] + CO2 = 2Al(OH)3↓ + NaHCO3
Для многих амфотерных элементов точные формулы гидроксидов низвестны, поскольку из водного раствора вместо гидроксидов выпадают гидратированные оксиды, например MnO2 · nH2O, Sb2O5 · nH2O.
Амфотерные элементы в свободном виде взаимодействуют как с типичными кислотами, так и со щелочами:
2Al + 3H2SO4(разб.) = Al2(SO4)3 + H2↑
2Al + 6H2O + 4NaOH(конц.) = 2Na[Al(OH)4] + 3H2↑
В обеих реакциях образуются соли, причем рассматриваемый элемент в одном случае входит в состав катиона, а во втором - в состав аниона.
Большинство солей двухвалентных катионов нерастворимы в воде: SnCl2, PbF2, PbCl2, PbBr2, PbI2, SnS, PbS, PbSO4. Нитраты и ацнтаты хорошо растворимы в воде.
Хлорид олова (II) проявляет восстановительные свойства и служит реактивом на Hg2+ и Hg22+ в качественном анализе:
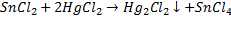
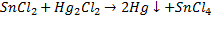
Ионы свинца, поступившие в организм, соединяются с сульфгидрильными и другими функциональными группами ферментов и некоторых других жизненно важных белковых соединений. Соединения свинца тормозят синтез порфирина, вызывают нарушение функций центральной и периферической нервной системы. Около 90 % ионов свинца, поступивших в кровь, связываются эритроцитами
Отмечены случаи бытовых отравлений свинцом, имеющие место при употреблении консервов, изготовленных в недоброкачественно луженной и эмалированной посуде.
Использование ацетата в медицине.
В медицине применяют водный раствор ацетата свинца («свинцовая примочка») в качестве наружного противовоспалительного и вяжущего средства при воспалительных заболеваниях слизистых оболочек и кожи, а также ушибах и синяках.
РЬО (входит в состав пластыря свинцового простого).
Дата: 2019-07-30, просмотров: 362.