Актвированный уголь. Применяют как адсорбирующее и детоксицирующее средство при диспепсии, метеоризме, пищевых интоксикациях, отравлениях алкалоидами, солями тяжелых металлов. Назначают внутрь в таблетках.
Гидрокарбонат натрия (NаНСО3). Применяют внутрь при повышенной кислотности желудочного сока как антацидное средство, при язвенной болезни желудка и двенадцатиперстной кишки. Наружно как антисептическое средство в водных растворах для полосканий, промываний.
Карбоген (смесь газов 7% СО2 и 93% О2). Применяется в хирургической практике для стимуляции дыхания во время наркоза. Жидкая углекислота (СО2) обладает свойством хорошо растворять липофильные вещества (жиры, липиды, каротин, хлорофилл, растительные и жирные масла и др.), что широко используется для их экстракции из лекарственных растений. Полученные СО2-экстракты используются как лекарственные средства.
85. Кремний. Общая характеристика. Основное отличие от углерода: отсутствие пи-связи в соединениях. Силициды. Соединения с водородом (силаны), окисление и гидролиз. Тетрафторид и тетрахлорид кремния, гидролиз. Гексафторосиликаты. Кислородные соединения. Оксид кремния(IV). Силикагель. Кремневая кислота. Силикаты. Растворимость и гидролиз. Природные силикаты и алюмосиликаты, цеолиты. Кремнийорганические соединений. Силиконы и силоксаны. Использование в медицине соединений кремния.
Кремний Si, химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086. Для кремния также характерна sp3-гибридизация электронных орбиталей. На внешнем электронном слое атома кремния есть валентные 3d-орбитали ( 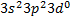 )
)
Кремний после кислорода — самый распространенный элемент в земной коре. В отличие от углерода в свободном состоянии кремний в природе не встречается. Наиболее распространенными его соединениями являются оксид кремния (IV) SiO2 и соли кремниевых кислот — силикаты. Они образуют оболочку земной коры. Соединения кремния содержатся в организмах растений и животных. По химическим свойствам кремний, как и углерод, является неметаллом, но его неметалличность выражена слабее, так как он имеет больший атомный радиус
Кремний. образует соединения почти со всеми металлами - силициды (не обнаружены соединения только с Bi, Tl, Pb, Hg). Получено более 250 силицидов, состав которых (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si и др.) обычно не отвечает классическим валентностям. Силициды отличаются тугоплавкостью и твёрдостью; наибольшее практическое значение имеют ферросилиций (восстановитель при выплавке специальных сплавов, см. Ферросплавы) и силицид молибдена MoSi2 (нагреватели электропечей, лопатки газовых турбин и т. д.).
Силан. При действии на силициды соляной кислоты получают простейшее водородное соединение кремния силан SiH4: 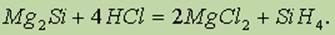
Силан — ядовитый газ с неприятным запахом, самовоспламеняется на воздухе
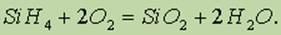
Дата: 2019-07-30, просмотров: 553.