Карбонаты превращаются в гидрокарбонаты при пропускании через их раствор или взвесь углекислого газа:
CaCO3+H2O+CO2=Ca(HCO3)2.
Обратное превращение происходит при нагревании:
Ca(HCO3)2=tCaCO3⏐↓⏐+H2O+CO2↑.
Диоксид углерода легко поглощается растворами щелочей, при этом образуется соответствующий карбонат, а при избытке СО2 – гидрокарбонат:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3↓ + CO2 = Ca(HCO3)2
Карбонаты и гидрокарбонаты натрия и кальция применяют в медицинской практике в качестве антацидных средств (нейтрализующих кислоты).
При нагревании гидрокарбонаты легко разлагаются:
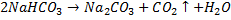
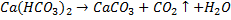
Соединения углерода с галогенами и серой. Четыреххлористый углерод, фосген, фреоны, сероуглерод и тиокарбонаты. Цианаты и тиоцианаты. Физические и химические свойства, применение.
Галогениды углерода по составу – вполне неорганические вещества, но своей низкой реакционной способностью похожи на органические соединения. Эти вещества применяют в холодильных установках и аэрозольных баллонах в качестве легко испаряющихся жидкостей, а также как растворители.
Хлорид углерода получают по реакции:
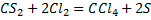
Уголь с хлором непосредственно не реагирует, хлор может только адсорбироваться на угле. Хлорид углерода – тяжелая ядовитая жидкость с запахом, похожим на запах хлороформа. Применяется как растворитель. В обычных условиях 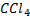 практически не реагирует с водой и этим резко отличается от быстро гидролизующихся хлоридов других неметаллов. Однако при длительном кипячении с водой гидролиз
практически не реагирует с водой и этим резко отличается от быстро гидролизующихся хлоридов других неметаллов. Однако при длительном кипячении с водой гидролиз 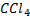 все же наблюдается и идет необходимо:
все же наблюдается и идет необходимо:
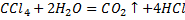 ,
, 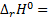 - 62,9 кДж
- 62,9 кДж
CCl 4 – четыреххлористый углерод – растворитель многих органических веществ, негорюч.
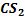 – сероводород – растворитель неорганических (P, S, I2) и органических веществ.
– сероводород – растворитель неорганических (P, S, I2) и органических веществ.
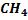 – метан, природный газ – топливо и реагент для получения ряда вещества (водорода, метанола, сажи и др.).
– метан, природный газ – топливо и реагент для получения ряда вещества (водорода, метанола, сажи и др.).
Производные метаны: дифтордихлорметан 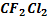 – фреон-12,
– фреон-12, 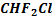 – фреон-22 – известные хладоагенты.
– фреон-22 – известные хладоагенты.
Биологическая роль углерода. Химические основы использования неорганических соединений углерода в медицине и фармации.
Биологическая роль углерода
Особенность атома углерода (равенство числа валентных орбиталей и числа валентных электронов, их близость к ядру и способность образовывать прочные углеродные связи) послужила причиной, что именно углерод является основой многочисленных органических соединений. С биологической точки зрения углерод является органогеном номер один. По содержанию в организме человека (21,15%) углерод относится к макроэлементам. Он входит в состав всех тканей и клеток в форме белков, жиров, углеводов, витаминов, гормонов. Роль углерода в процессах биосинтеза органических веществ огромна.
Круговорот углерода в природе обусловлен переходом неорганического углерода в органический и наоборот. В клетках растений (хлоропластах) под действием солнечной энергии и хлорофилла происходит синтез органических веществ:
6nCO2 + 5nH2O 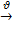 (C6H10O5)n + 6nO2, DH>0
(C6H10O5)n + 6nO2, DH>0
В организме человека и животных происходит обратный процесс при тканевом дыхании:
(C6H10O5)n + 6nO2 ® 6nCO2 + 5nH2O, DH<0
Система Н2СО3–НСО3- является главной буферной системой плазмы крови, обеспечивающей поддержание кислотно-основного гемостаза (постоянного значения рН крови порядка 7,4).
Дата: 2019-07-30, просмотров: 737.