GeF4 –газ, GeCl4 – жидкость, SnCl4 – жидкость, PbCl4 – жидкость, SnBr4 – твердый, GeI4 - твердый
1. Гидролизуются ЭГ4 + 6H2O = 4HF + H2 [Э(OH)6 ]
2. Вступают в реакции комплексообразования ЭГ4 + 2HГ = H2 [ЭГ6 ]
Оба свойства обусловлены координационной ненасыщенностью Э
PbCl4 чрезвычайно неустойчив и в присутствии воды претерпевает внутримолекулярное окисление-восстановление: PbCl4 → PbCl2 + Cl2
SnCl4 + 2HCl → H2[SnCl6 ], Оловохлористоводородная кислота.
H2[ SnCl6 ] + 2KOH → K2[SnCl6 ] + 2H2O.
Соединения с галогенами типа ЭГ2 –типичные соли.
В водных растворах гидролизуются, причем GeГ2 – полностью:
SnCl2 + H2O↔SnOHCl2 +HCl
GeCl2 + H2O→Ge(OH)2 +2HCl
При взаимодействии хлорида хлорида олова (II) c соляной кислотой образуется оловохлористоводородная кислота:
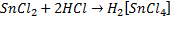
ОКСИДЫ
Классификация
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
ОКСИДЫ:
Несолеобразующие: CO, N2O, NO
Солеобразующие:
Основные - это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2
Na2O; MgO; CuO
Амфотерные (обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды
ZnO; Al2O3; Cr2O2; SnO2
Кислотные - это оксиды неметаллов и металлов со степенью окисления от +5 до +7
SO 2 ; SO 3 ; P 2 O 5 ; Mn 2 O 7 ; CrO 3
Основным оксидам соответствуют основания,
кислотным – кислоты,
амфотерным – и те и другие
Получение
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 → 2MgO
4P + 5O2 → 2P2O5
S + O2 → SO2
2CO + O2 → 2CO2
2CuS + 3O2 → 2CuO + 2SO2
CH4 + 2O2 → CO2 + 2H2O
4NH3 + 5O2 –кат. → 4NO + 6H2O
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 –t°→ CuO + H2O
(CuOH)2CO3 –t°→ 2CuO + CO2 + H2O
2Pb(NO3)2 –t°→ 2PbO + 4NO2 + O2
2HMnO4 –t°;H2SO4(конц.) → Mn2O7 + H2O
Химические свойства
Основные оксиды
1. Взаимодействие с водой
(Образуется основание):
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
2. Взаимодействие с кислотой или основанием:
(При реакции с кислотой образуется соль и вода)
MgO + H2SO4 –t°→ MgSO4 + H2O
CuO + 2HCl –t°→ CuCl2 + H2O
Кислотные оксиды
1. Взаимодействие с водой
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Образуется кислота:
SO3 + H2O → H2SO4
P2O5 + 3H2O → 2H3PO4
2. Взаимодействие с кислотой или основанием
При реакции с основанием образуется соль и вода
CO2 + Ba(OH)2 → BaCO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Амфотерные оксиды взаимодействуют
с кислотами как основные:
ZnO + H2SO4 → ZnSO4 + H2O
с основаниями как кислотные:
ZnO + 2NaOH → Na2ZnO2 + H2O
(ZnO + 2NaOH + H2O → Na2[Zn(OH)4])
3. Взаимодействие основных и кислотных оксидов между собой приводит к солям.
Na2O + CO2 → Na2CO3
4. Восстановление до простых веществ:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
P2O5 + 5C → 2P + 5CO
РbО2 практически не раств. в воде, раств. в р-рах щелочей с образованием гидроксоплюмбатов(IV), напр. Nа2[Рb(ОН)6]; при сплавлении с основными оксидами образует плюмоаты типа Na4PbO4; сильный окислитель: при нагр. с H2SO4 реагирует с выделением О2, а с соляной-С12, при растирании с S или красным P воспламеняется.
Получают РbО2 окислением Рb(ОСООСН3)2 хлорной известью, электрохим. окислением солей Рb(II), разложением Рb3О4 в HNО3.
Используют РbО2 в свинцовых аккумуляторах и как окислитель (напр., как компонент головок спичек).
Оксиды:
· Монооксиды: GeO, SnO, PbO (←) Увеличение восстановительных свойств
(→) Амфотеры с усилением основных свойств
· Диоксиды GeO2, SnO2, PbO2 (←) Увеличение окислительных свойств
(→) Амфотеры с усилением кислотных свойств
· Смешанные Pb3O4 - свинцовый сурик
Оксиды GeO и SnO, в отличие от PbO, при сильном нагревании подвергаются реакции диспропорционирования:
2GeO → GeO2 + Ge
2SnO → SnO2 + Sn
3PbO2 → Pb3O4 + O2
Оксид свинца ( IV ) представляет собой коричневый порошок. Это очень сильный окислитель. Происходит возгорание порошка серы или красного фосфора, растертых с PbO2. В растворе в щелочной среде оксид свинца (IV) окисляет Cr (III) до Cr (VI):

Дата: 2019-07-30, просмотров: 430.