2. Образование пептидов (реакция поликонденсации) – это специфическая реакция аминокислот.
H2N-CH2-COOH + NH2-CH-COOH → H2N-CH2-CO-NH-CH-COOH + H2O
-СO-NH- пептидная или амидная связь.
a-аминокислоты – исходные вещества для синтеза белков живого организма.
Гидразин и гидроксиламин
Продуктом замещения одного из водородов аммиака на гидроксильную группу является гидроксиламин (NH2OH). Он образуется при электролизе азотной кислоты (с ртутным или свинцовым катодом) в результате восстановления HNO3 по схеме
HNO3 + 6 Н2 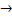 2 Н2О + NH2OH
2 Н2О + NH2OH
Гидразин и гидроксиламин.
Расплавленный NH2OH является хорошим растворителем некоторых солей. С водой он образует гидрат гидроксиламина NH2OH×Н2О, характеризующийся слабо выраженными основными свойствами. В сочетании с дымящейся HNO3соединение это иногда используется как реактивное топливо.
С кислотами гидроксиламин дает соли гидроксиламмония [NH3OH]+, например [NH3OH]Cl, [NH3OH]NO3, [NH3OH]2SO4
NH2OH + HCl = [NH3OH]Cl
Соли гидроксиламмония – устойчивые бесцветные кристаллические вещества, растворимые в воде.
В ряду H2O2 - NH2OH-N2H4 окислительная активность падает, а восстановительная возрастает. Так, если для H2O2 наиболее характерны окислительные свойства, а для N2H4 – восстановительные, то NH2OH в щелочной среде является сильным восстановителем:
-1 0
2 NH2OH + I2 + 2 KOH = N2 + 2 KI + 4H2O
восстановитель
-1 -3
2 NH2OH + 4 FeSO4 + 3 H2SO4 = 2 Fe2 (SO4)3 + ( NH4)2SO4 + 2 H2O
окислитель
Как и пероксид водорода, NH2OH легко разлагается (в особенности при нагревании) по механизму диспропорционирования:
-1 -3 0
3 NH2OH = H3N + N2+ 3H2O
Разбавленные водные растворы солей гидроксиламина довольно устойчивы, тогда как крепкие быстро разлагаются с образованием NH3, N2 и N2O. Такой распад сильно ускоряется в присутствии платиновой черни.
Окислители обычно переводят гидроксиламин либо в N2O (например, HNO3), либо в N2 (например, V2O5, HOCl).
Для гидроксиламина довольно характерна и окислительная функция. Например, он способен окислять Fe(OH)2 до Fe(OH)3. Эта окислительная функция более отчетливо выражена в кислой среде, тогда как наиболее характерна для гидроксиламина восстановительная – в щелочной.
Наиболее важным продуктом частичного окисления аммиака является гидразин (N2H4), образующийся по реакции
2 NН3 + NaOCl = Н2О + N2H4 + NaCl
Гидразин – хороший ионизирующий растворитель. С водой и спиртом он смешивается в любых соотношениях. Водные растворы его показывают щелочную среду:
N2H4…НОН = N2H5+ + OH-
N2H5+…HOH = N2H6+2 + OH-
Являясь донором двух электронных пар, гидразин с кислотами образует два ряда гидразоний-производных, представляющих собой соли, например [N2H5]Cl, [N2H6]Cl2, [N2H6]SO4.
Гидразин – эндотермическое соединение. Гидразин и производные гидразоний-ионов значительно менее устойчивы, чем аммиак и производные аммония.
Гидразин – сильный восстановитель:
-2 0
4 KMnO4 + 5 N2H4 + 6 H2SO4 = 5 N2 + 4 MnSO4 + 2 K2SO4 + 16 H2O
Свободный гидразин способен присоединять молекулу воды, давая гидрат гидрозина – N2H4•Н2О. Последний представляет собой бесцветную жидкость и является слабым основанием (К=1×10-6). Присоединение второй молекулы воды идет уже с трудом. Присоединяя молекулы кислот, гидразин может образовывать два ряда солей, например N2H4•НCl и N2H4•2НCl. В продажу обычно поступает малорастворимый сульфат N2H4•Н2SO4 .
В отличие от аммиака гидразин является эндотермичным соединением. Пары его способны сгорать фиолетовым пламенем по реакции:
N2H4 + О2 = 2 Н2О + N2 + 128 ккал
На этом основано использование гидразина в качестве реактивного топлива.
С металлическим натрием гидразин взаимодействует по схеме:
2 Na +2 N2H4 = 2 NaN2H3 + H2
Образующийся гидразинид натрия представляет собой весьма взрывчатое твердое вещество желтого цвета, хорошо растворимое в избытке гидразина.
В водных растворах гидразин восстанавливает иод до иодистого водорода, соли ртути и серебра – до металлов, соли меди – до ее закиси. Сам он при этом окисляется до свободного азота, но основной процесс обычно осложняется побочными реакциями. Полностью до N2 гидразин может быть окислен лишь в строго определенных условиях. Окислительная функция у него почти отсутствует, но действием очень сильных восстановителей (водорода в момент выделения) он все же может быть восстановлен до аммиака.
Азотистоводородные кислоты и азиды
При взаимодействии гидразина с азотистой кислотой по схеме:
N2H4 + HNO2 = 2 H2O + HN3
образуется азотистоводородная кислота (H-N=N≡N), представляющая собой бесцветную летучую жидкость с резким запахом.
По силе азотистоводородная кислота близка к уксусной, а по растворимости солей азидов похожа на соляную.
Исходным продуктом для получения азидов является NaNN2, который получают действием N2O на NaNH2 при 2000 С:
NaNH2 + O=N≡N → NaNN2 + H2O
Ион NH2- - окислитель. По окислительным свойствам НNN2 напоминает НNO3. Так, если при взаимодействии с металлами НNO3 дает оксид азота (II) и воду, то НNN2 образует N2 («нитрид азота») и NH3:
+5 0
Cu + 3HNN2 = Cu(NN2)2 + N2+ NH3
+5 +2
Cu + 8HNО3 = 3Cu(NО3)2 + NО + 4H2О
Смесь HNN2 и HCl, подобно царской водке – сильный окислитель за счет образующегося хлора:
2 HNN2 + 3 HCl = NH4Cl + Cl2 + N2
Подобно самой HN3, некоторые азиды при нагревании или при ударе сильно взрываются. На этом основано применение азида свинца [Pb(N3)2] в качестве детонатора, т.е. вещества, взрыв которого вызывает мгновенное разложение других взрывчатых веществ.
Оксиды азота
Для азота известны оксиды, по составу формально отвечающие всем его валентностям от единицы до пяти. Их формулы:
N2O – оксид азота I, закись азота (веселящий газ)
Представляет собой твердое вещество. Обладает наркотическим действием, вызывает сначала судорожный смех, затем потерю сознания.
Аммоний (свободный радикал) – атомная группа (или радикал) состава NH4, не существующая в свободном виде. Аммоний (свободный радикал), так же как и короткоживущие свободные радикалы, склонен к рекомбинации и как атом водорода образует молекулу водорода.Аммоний (свободный радикал) можно стабилизировать замораживанием или в матрице в виде амальгамы.
Аммоний (катион) – положительно заряженный полиатомный ион с химической формулой NH4+. Аммоний (катион) с противоионом образуют соли аммония, аммониевые соединения, последние входят в большой класс ониевых соединений.
Аммо́ний (лат. Ammonium) — многоатомный неорганический катион, продукт протонирования аммиака. В соединениях играет роль одновалентного металла. Химическая формула — NH4+. При растворении аммиака в растворах кислот происходит реакция протонирования:
NH3 + H+ = NH4+
Ион аммония является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра. Размер иона — 1,43 Å[6].
Существует также короткоживущий свободный радикал аммония с формулой NH4[7]
Свойства солей аммония
Большинство солей аммония — бесцветные кристаллические вещества, хорошо растворимые в воде и легко разлагающиеся при нагревании с выделением газов.
 Прочность солей аммония сильно различается. Если записать реакцию аммиака с кислотами следующим образом:
Прочность солей аммония сильно различается. Если записать реакцию аммиака с кислотами следующим образом:
NH3 + Н+X− → [NH4]+X−,
то чем сильнее кислотный остаток Х− удерживает катион Н+, тем труднее происходит прямой процесс и легче — обратный. Поэтому, чем меньше константа диссоциации кислоты, тем менее устойчива её аммонийная соль. Так, соль сильной кислоты HCl хлорид аммония NH4Cl вполне стабилен при комнатной температуре, а соль слабой угольной кислоты в этих условиях заметно разлагается.
Аммониевые соли летучих кислот при нагревании разлагаются, выделяя газообразные продукты, которые при охлаждении вновь образуют соль:
NH4Cl → NH3 + HCl → NH4Cl
Если соль образована нелетучей кислотой, то нагреванием можно удалить NH3:
NH4H2PO4 → Н3PO4 + NH3
Если анион соли аммония содержит атом-окислитель, то при её нагревании происходит реакция внутримолекулярного окисления-восстановления, например:
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
NH4NO3 → N2O + 2H2O
Со́ли аммо́ния — соли, содержащие аммоний, NH4+; по строению, цвету и другим свойствам они похожи на соответствующие соли натрия. Все соли аммония хорошо растворимы в воде и полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии на них щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются. Получают их при взаимодействии аммиака или гидроксида аммония с кислотами.
Термическое разложение. Соли аммония при нагревании на пламени обычной газовой горелки в фарфоровой чашке или тигле разлагаются и улетучиваются (термическое разложение). При этом следует избегать чрезмерного нагревания и прокаливания ввиду того, что соли калия и натрия при температуре больше 8000C начинают улетучиваться или сплавляться с материалом тигля.
Дата: 2019-07-30, просмотров: 535.