С менее электроотрицательными, чем он сам, элементами углерод дает карбиды. Поскольку для углерода характерно образовывать гомоцепи, состав большинства карбидов не отвечает степени окисления углерода –4. По типу химической связи можно выделить ковалентные, ионно-ковалентные и металлические карбиды.
Ковалентные карбиды кремния SiC и бора B4C – полимерные вещества, характеризующиеся очень высокой твердостью, тугоплавкостью и химической инертностью.
Простейшим ковалентным карбидом является метан СН4 – химически весьма инертный газ; на него не действуют кислоты и щелочи, однако он легко загорается, и его смеси с воздухом чрезвычайно взрывоопасны. Метан – основной компонент природного (60–90%) рудничного и болотного газа. Богатые метаном газы используются как топливо и сырье для химического производства.
Углерод образует многообразные перкарбиды , например, некоторые простейшие углеводороды – этан С2Н6, этилен С2Н4, ацетилен С2Н2.
Ионно-ковалентные карбиды – кристаллические солеподобные вещества. При действии воды или разбавленной кислоты они разрушаются с выделением углеводородов. Поэтому карбиды подобного типа можно рассматривать как производные соответствующих углеводородов. Производные метана – метаниды, например, карбиды Ве2С и АlС3. Они разлагаются водой, выделяя метан:
АlС3 + 12Н2О = 4Al(ОН)3 + 3СН4↑
Из солеподобных перкарбидов наиболее изучены ацетилиды типа М2+1С2, М+2С2 и М2+3(С2)3. Имеющий наибольшее значение ацетилид кальция СаС2(называемый карбидом) получают нагреванием СаО с углем в электропечах:
СaO + 3C = CaC2 + CO
Ацетилиды более или менее легко разлагаются водой с образованием ацетилена:
СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑
Эта реакция используется в технике для получения ацетилена.
Металлическими являются карбиды d-элементов IV–VIII групп. Чаще всего встречаются карбиды среднего состава МС (TiC, ZrC, HfC, VC, NbC, ТаС), М2С (Мо2С, W2С), М3С (Мn3С, Fe3С, Со3С). Металлические карбиды входят в состав чугунов и сталей, придавая им твердость, износоустойчивость и другие ценные качества. На основе карбидов вольфрама, титана и тантала производят сверхтвердые и тугоплавкие сплавы, применяемые для скоростной обработки металлов.
Углерод(II). Оксид углерода(II), его КО и OВ характеристика, свойства как лиганда, химические основы его токсичности. Цианистоводородная кислота, простые и комплексные цианиды. Химические основы токсичности цианидов.
Производные углерода (II) – это СО, СS, HCN.
Оксид углерода (II) СО (угарный газ) образуется при сгорании углерода или его соединений в недостатке кислорода, а также в результате взаимодействия оксида углерода (IV) с раскаленным углем.
СО2 + С ↔ 2СО
В молекуле СО имеется тройная связь. При нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии. Монооксид углерода из-за наличия неподеленных пар электронов у углерода и кислорода является лигандом и образует прочные комплексы с d -элементами – карбонилы: 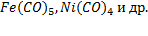
Естественный уровень СО в атмосфере 0,01-0,9 мг/м3. В атмосферу СО попадает в составе вулканических и болотных газов, в результате лесных и степных пожаров, выделения микроорганизмами, растениями, животными и человеком и др.
Оксид углерода, быстро проходит через альвеолярно-капиллярную мембрану,растворяется в плазме крови, диффундирует в эритроциты и вступает в химическое взаимодействие как с окисленым гемоглобином 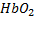 , так и с восстановителем
, так и с восстановителем 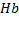 :
:
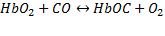
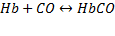
Образующийся карбонилгемоглобин не способен присоединять к себе кислород. Вследствие этого не возможен перенос кислорода от легких к тканям. Происходит смерть организма как при удушье.
Древесина – специально обработанная, образует активный уголь, служащий как адсорбент, в медицине используются таблетки «карболен».
Синильная кислота HCN 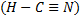 . При высокой температуре, например, в электрической дуге, углерод может соединяться с азотом, образуя бесцветный газ дициан
. При высокой температуре, например, в электрической дуге, углерод может соединяться с азотом, образуя бесцветный газ дициан 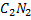 . Дициан имеет сходство с галогенами. Подобно им, он образует с водородом HCN , получившее название циановодорода, или синильной кислоты. HCN – бесцветная, очень летучая жидкость, кипящая приблизительно при 270С и обладающая характерным запахом горького миндаля. В водным растворе она подвергается протолизу. Синильная кислота и ее соли – цианиды – сильные яды, действующие смертельно даже в ничтожных дозах (меньше 0,05 г).
. Дициан имеет сходство с галогенами. Подобно им, он образует с водородом HCN , получившее название циановодорода, или синильной кислоты. HCN – бесцветная, очень летучая жидкость, кипящая приблизительно при 270С и обладающая характерным запахом горького миндаля. В водным растворе она подвергается протолизу. Синильная кислота и ее соли – цианиды – сильные яды, действующие смертельно даже в ничтожных дозах (меньше 0,05 г).
Цианиды, попадая в организм, блокируют один из железосодержащих дыхательных ферментов (цитохромоксидазу), вызывая состояние “тканевой гипоксии”. Оно сопровождается удушьем, нарушениями работы сердца, судорогами, параличами.
Дата: 2019-07-30, просмотров: 757.