С водородом бор не реагирует. Бороводороды или бораны получают косвенным путём. Их известно несколько десятков с общей формулой ВхНу. Простейший член этого ряда ВН3 – боран – существует только выше 1000С в равновесии с другими, более сложными гидридами. При стандартных условиях ему соответствует – диборан – В2Н6. В молекуле диборана два атома водорода расположены между двумя атомами бора и участвуют в трёхцентровых взаимодействиях В – Н – В, возникающих в результате перекрывания двух sp3-гибридных орбиталей двух атомов бора и s-орбитали атома водорода. Трёхцентровая связь менее прочна, чем «нормальные» связи, и диборан при нагревании диссоциирует:
В2Н6 = 2ВН3 ∆Н = 150 кДж/моль.
Существует ещё большое число более сложных бороводородов (В4Н10, В6Н10, В10Н14). Кроме трёхцентровых связей В – Н – В в сложных боранах реализуются трёхцентровые связи В – В – В и двухцентровые В – В . В результате возникают довольно сложные структуры.
Локализованные двухцентровые донорно-акцепторные связи между атомом бора и какими-либо донорными молекулами прочнее, чем трёхцентровые двухэлектронные связи в гидриде, поэтому ВН3 охотно присоединяет донорные частицы. Например, ׃NH3 и другие. Наиболее важными являются продукты присоединения иона ׃Н‾. В эфирных или других неводных растворителях легко идёт реакция:
2LiH + B2H6 = 2LiBH4
Образующийся гидридоборат лития – боранат лития – твёрдое кристаллическое вещество, имеющее ионное строение [Li+][BH4‾]. Соединения, содержащие ион BH4‾ , в известной мере подобны солям аммония:
Н:‾ + ВН3 → Н:‾ ==> ВН3 → ВН4‾
Все гидриды бора очень реакционноспособные вещества, при обычных условиях бурно реагирующие с водой, галогенами, часто самовозгорающиеся на воздухе:
В2Н6 + 3О2 = В2О3 + 3Н2О; В4Н10 + 11Cl2 = 4BCl3 + 10HCl;
В2Н6 + 6Н2О = 2H3BO3 + 6H2;
Большинство боранов имеет отвратительный запах и очень ядовиты.
Подобным образом ведут себя соединения МВН4:
КВН4 + 4Н2О = КОН + H3BO3 + 4Н2
Все они являются сильными восстановителями и используются при синтезе различных органических соединений в неводных средах.
Галогениды
Все элементы рассматриваемой группы образуют соединения со всеми галогенами типа ЭГ3.
Галогениды бора активно взаимодействуют с водой, при этом образуя две кислоты – борную и галогенводородную:
ВГ3 + 3НОН = Н3ВО3 + 3НГ
Вещества, реагирующие с водой с образованием двух кислот, одна из которых галогенводородная, называются галогенангидридами.
Все галогениды склонны к реакциям присоединения частиц, обладающих донорными свойствами. Например:
ВF3 + :PBr3 → Br3P: ==>
BF3 → Br3P∙ ВF3
Реакция присоединения иона галогена особенно характерна для фторида бора. В результате при его гидролизе образуется тетрафторборная кислота:
4ВF3 + 3H2O = H3BO3 + 3HBF4
Поскольку в ионе ВF4‾ и бор и фтор валентнонасыщены, ковалентная связь этой частицы с водородом невозможна, и фторборная кислота существует только как совокупность ионов в растворе. Но её соли имеющие ионные кристаллические решетки, фторобораты щелочных и щелочноземельных металлов вполне устойчивы.
Остальные галогениды и галогенборатытные анионы быстро и полностью гидролизуются даже на холоду:
BCl3 + 3H2O = H3BO3 + 3HCl ∆H0 = -85 кДж/моль
Что резко отличает их от галогенидов углерода.
Оксид бора и борная кислота
С кислородом бор реагирует только при нагревании, образуя единственный оксид В2О3. В В2О3 атом бора имеет вакантную орбиталь, а атом кислорода – две неподелённые пары электронов. В результате создаются идеальные условия для донорно-акцепторного взаимодействия, которое гораздо более эффективно в полимерной структуре, чем в
изолированной молекуле. Поэтому молекулы В2О3 существуют только в газовой фазе при температуре 20000С, при обычных условиях В2О3 твёрдое полимерное вещество, построенное из тетраэдров ВО4, в которых все атомы кислорода являются мостиковыми.
Оксид бора легко и обратимо реагирует с водой, образуя борную кислоту:
В2О3 + 3Н2О = Н3ВО3
Борная кислота – твёрдое вещество, заметно растворимое в воде (5г/100 г воды при 200С) и некоторых органических растворителях. Кристаллы борной кислоты имеют слоистую структуру, в которой молекулы связаны прочными водородными связями.
Особенностью борной кислоты является то, что её кислотные свойства определяются не диссоциацией с отщеплением протона, а образованием гидроксокомплекса с участием вакантной р-орбитали:
Н3ВО3 + Н2О = В(ОН)4‾ + Н+
Н3ВО3 очень слабая кислота (Ка = 1∙10-9), является акцептором ионов ОН-. Нормальные (средние) бораты могут быть получены только сплавлением кислоты со щелочами или основными оксидами и отвечают простейшей формуле М(ВО2)n, где М катион n-зарядный. Например: Са(ВО2)2.
Из растворов, получаемых при нейтрализации борной кислоты, не образуются ортобораты, содержащие ион (ВО3)3_, а получаются тетрабораты, метабораты или соли других полиборных кислот. Наиболее распространённой из них является бура (или гептаоксотетраборат натрия) Na2B4O7 ∙ 10H2O:
4 Н3ВО3 + 2NaOH + 3H2O = Na2B4O7 ∙ 10H2O
Под действием кислот на раствор буры реакция протекает в обратном направлении:
Na2B4O7 + H2SO4 + 5H2O = Na2SO4 + 4H3BO3
Всё, сказанное выше, говорит о том, что оксид бора и борная кислота резко отличаются по свойствам от оксидов и гидроксидов азота и углерода.
Эфиры борной кислоты (бораты) получаются взаимодействием спиртов с борным ангидридом или с борной кислотой (обязательным условием успешного применения борной кислоты является удаление воды, выделяющейся в процессе реакции)
Наличие вакантной орбитали у атома бора приводит к образованию донорно-акцепторной связи О → В, что невозможно ни в соединениях углерода, ни в соединениях азота. Именно поэтому оксиды углерода и азота газообразны, а оксид бора – труднолетучее вещество.
Качественной реакцией на Н3ВО3 и соли борных кислот является взаимодействие с концентрированной серной кислотой и метанолом при
нагревании. При этом образуется борнометиловый эфир В(ОСН3)3, который при поджигании горит очень красивым яркозелёным пламенем.
В заключение отметим, что доза в 5 г В(ОН)3 может привести к смерти человека; очень малые дозы, периодически вводимые в организм, вызывают сильное исхудание.
Однако широкое применение находит борная кислота и осорбенно бура. Она используется в медицине как дезинфицирующее средство, а также в стекольной и керамической промышленности.
Вопрос №78. Алюминий. Общая характеристика. Простое вещество и его химическая активность. Разновидности оксида алюминия. Применение в медицине. Амфотерность гидроксида. Алюминаты. Ион алюминия как комплексообразователь. Безводные соли алюминия и кристаллогидраты. Особенности строения.Галиды. Гидрид алюминия и аланаты.Квасцы.Физико-химические основы применения алюминия в медицине и фармации.
Алюминий
В основном состоянии атом алюминия имеет конфигурацию 3s23p1. У атома алюминия имеется один неспаренный электрон и две вакантные р-АО. Даже в валентном состоянии 3s13p2 одна из р-АО остаётся вакантной, кроме того у него незаполнены 3d-АО. Всё это создаёт условия для значительного донорно-акцепторного взаимодействия.
Алюминий – серебристо-белый металл, Тпл= 6600С, Ткип= 23270С. Плотность 2,7 г/см3. Алюминий очень мягок, легко вытягивается в проволоку и прокатывается в фольгу. На воздухе алюминий покрывается тончайшей плёнкой Al2O3 (~10-5 мм), плёнка отличается большой прочностью. Оксид очень твёрд, прочно связан с поверхность металла, вода с ним не реагирует, а кислород через него практически не диффундирует. Поверхностный слой оксида надёжно защищает ме6талл от дальнейшего окисления. Чем металл чище, тем прочнее защитный слой на его поверхности.
Несмотря на наличие защитной оксидной плёнки, реакционная способность алюминия велика. При стандартных условиях металл реагирует с галогенами, кислородом, серой, водой:
2Al + 3Cl2 = 2AlCl3; 4Al + 3O2 = 2Al2O3; 2Al + 3S = Al2S3;
2Al + 6H2O = 2Al(OH)3 + 3H2 (металл освобождён от оксидной плёнки).
Алюминий легко растворяется в соляной и разбавленной серной кислотах:
2Al + 6HCl = 2AlCl3 + 3H2↑; 2Al + 3H2SO4(РАЗБ.) = Al2(SO4)3 + 3H2↑.
Но концентрированная серная и азотная кислоты его пассивируют, упрочняя оксидную плёнку на его поверхности. При нагревании эти кислоты взаимодействуют с алюминием:
Al + 6HNO3(конц.) = Al(NO3)3 + 3NO2 + 3H2O,
8Al + 30HNO3(очень разб.) = 8Al(NO3)3 + 3NH4NO3 + 9H2O;
2Al + 6H2SO4(конц.) = Al2(SO4)3 + 3SO2
Алюминий взаимодействует как с расплавами, так и с водными растворами щелочей. Во всех случаях выделяется водород, однако состав, образующихся солей различен. В водных растворах образуются комплексные гидроксосоли с разным числом гидроксогрупп и молекул воды во внутренней сфере комплекса. Обычно это записывают в упрощённой форме в виде тетрагидроксокомплекса:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)3] + 3H2↑
Роль окислителя в этом случае выполняют молекулы воды, а щёлочь создаёт среду:
Al0 – 3e → Al+3 │2
2H+ + 2e → H20 │3
[Фактически растворение алюминия в щелочах протекает в три стадии:
А) растворение оксидной плёнки: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4];
Б) взаимодействие Al с водой: 2Al + 6H2O → 2Al(OH)3 ↓ + 3H2↑;
В) взаимодействие Al(OH)3 со щелочью: Al(OH)3 + NaOH → Na[Al(OH)4].]
Подобным образом алюминий растворяется в водных растворах карбонатов щелочных металлов (среда щелочная); довольно энергично он разЪедается раствором NH4OH.
При сплавлении со щелочами алюминий образует метаалюминаты:
2Al + 6NaOH (крист.) = 2NaAlO2 + 2Na2O + 3H2↑.
Соединения с водородом
Al с водородом непосредственно не реагирует, хотя известно твёрдое полимерное соединение AlH3 – алан. В этом соединении, как и в В2О6, существуют трёхцентровые связи, но координационное число алюминия равно 6. Выше 1000С AlH3 разлагается на простые вещества. Гидрид алюминия бурно реагирует с водой:
AlH3 + 3H2O = 3H2↑ + Al(OH)3
Известны его производные – аланаты, имеющие ионное строение, например KAlH4 – аланат калия – К+[AlH4‾]. Ион AlH4‾ , подобно иону ВН4‾, является продуктом координации иона Н‾ молекулой AlH3:
H:1- +
AlH3 → H:1- ==>
AlH3 → AlH4‾
Аланаты – реакционноспособные вещества, используемые как сильные восстановители:
KAlH4 + 4H2O = KOH + Al(OH)3 + 4H2↑
Оксид
С кислородом алюминий образует единственное устойчивое соединение Al2O3: 4Al(тв) + 3О2 = 2Al2O3 ∆H = - 1676 кДж.
Al2O3 – очень твёрдое, тугоплавкое соединение, практически не растворимо в воде. Тпл= 20720С, Ткип= 35000С. Известны три его модификации: α, β и γ . Чаще встречается α-форма Al2O3 – корунд. Его структура отвечает гексагональной плотнейшей упаковке атомов О, в которой ⅔ октаэдрических пустот заняты атомами Al.
Химическая активность Al2O3 зависит от условий его получения. Наименее активен оксид прокалённый при температуре ≈10000С. Такой оксид не поглощает воду, не реагирует с кислотами и растворами щелочей, в растворимое состояние может быть переведён только сплавлением со щелочами или карбонатами.
Полученный разложением Al(OH)3 при 200 – 3000С по реакции
2Al(OH)3(крист.) → Al2O3 (крист.) + 3Н2О (газ)
Оксид алюминия хорошо поглощает воду (химически с ней не взаимодействует), проявляет ярко выраженные амфотерные свойства, т.е. реагирует как с кислотами, так и со щелочами, карбонатами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Al2O3 + 2NaOH(крист.) = 2NaAlO2 + H2O↑
Al2O3 + Na2CO3 = 2NaAlO2 + CO2↑
При сплавлении с основными окситдами Al2O3 образует метаалюминаты:
Al2O3 + MgO = Mg(AlO2)2
Прокаливание Al2O3 с коксом сопровождается образованием карбида алюминия:
2Al2O3 + 9С = Al4C3 + 6CO↑
Гидроксид алюминия
Al(OH)3 – белое студенистое или кристаллическое вещество, практически не растворимое в воде.
Гидроксид алюминия, как и оксид алюминия, обладает ярко выраженными амфотерными свойствами, это слабый амфотерный электролит. В щелочных растворах существует в виде
тетрагидроксоалюминат-иона [Al(OH)4]1-, в кислых – в виде гидратированных ионов [Al(H2O)6]3+.
Наиболее высока химическая активность свежеосаждённого рыхлого Al(OH)3. С сильными кислотами Al(OH)3 образует соли, в которых ион Al3+ входит в состав катионной части соли:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Растворы или расплавы щелочей с гидроксидом алюминия образуют соли, в которых ион Al3+ находится в анионной части соли:
Al(OH)3 + КОН = К[Al(OH)4]
Al(OH)3 + OH‾ = [Al(OH)4]1-
Al(OH)3 + KOH(крист.) = KAlO2 + 2H2O↑
Ионы алюминия не образуют аммиачных комплексов, поэтому некоторая растворимость Al(OH)3 в избытке концентрированного раствора аммиака обусловлена образованием тетрагидроксоалюмината аммония:
Al(OH)3 + NH3∙H2O = NH4[Al(OH)4]
Al(OH)3 лучше получать обменными реакциями с гидроксидом аммония, т.к. при умеренных концентрациях образующийся Al(OH)3 в избытке реактива не растворяется.
Отметим, что катион [Al(H2O)6]3+ существует и в кристаллах, поэтому многочисленные соли алюминия кристаллизуются из водных растворов в виде кристаллогидратов. Например: AlCl3∙6H2O, Al(NO3)3∙9H2O и т.д. Из растворов, содержащих одновременно сульфаты калия и алюминия, выделяются кристаллы KAl(SO4)∙12H2O. Подобного рода соли содержащие Ме1+ и Ме3+ получили названия квасцов.
Галиды – это группа минералов, формирующих естественные соли и включающие флюорит (фтористый кальций) , халит (поваренную соль) , сильвит (хлорид калия) и аммиачную соль (нашатырный спирт) .
Галиды алюминия ( кроме A1F3) растворимы почти во всех органических растворителях, причем определение их молекулярных весов в таких растворах дает различные результаты.
Общая характеристика углерода. Аллотропические модификации углерода. Типы гибридизации атома углерода и строение углеродосодержащих молекул. Углерод как основа всех органических молекул. Физические и химические свойства простых веществ. Активированный уголь как адсорбент.
Характеристика углерода
· Положение в ПС: IVA-группа
· Электронная формула: 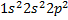
· Возможные степени окисления -4; 0; +2; +4
· В живом организме углерод находится в степени окисления +4
· Углерод - неметалл
· Углерод устойчив по отношению к воздуху и воде.
· Углерод образует малополярные связи с водородом, кислородом, азотом и серой.
· Молекулы, содержащие C-C связи, могут иметь линейное, разветвленное или циклическое строение, отсюда образование громадного числа биомолекул.
Углерод встречается в виде четырех аллотропных модификаций: алмаз, графит, карбин и фуллерен 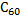 , отвечающий трем типам гибридизации.
, отвечающий трем типам гибридизации.
o При 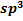 -гибридизации атомных орбиталей образуется тетраэдрическая структура алмаза. Алмаз характеризуется высокой твердостью, химической инертностью и широко используется как абразивный материал. При специальной огранке алмазов получают бриллианты.
-гибридизации атомных орбиталей образуется тетраэдрическая структура алмаза. Алмаз характеризуется высокой твердостью, химической инертностью и широко используется как абразивный материал. При специальной огранке алмазов получают бриллианты.
o При 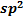 -гибридизации образуется плоская структура, причем, оставшиеся негибридизованные p-электроны ответственны за электронную проводимость. Между слоями возникает вандерваальсовское взаимодействие. Такую слоистую структуру имеет графит. Графит характеризуется мягкостью, поэтому используется как твердая смазка. Он используется также для изготовления электродов, как футеровочный материал в ряде аппаратов и как замедлитель нейтронов в ядерных реакторах. При обычной температуре весьма инертен. При высоких температурах непосредственно взаимодействует с многими металлами и неметаллами (водородом, кислородом, фтором, серой). Типичный восстановитель; реагирует с водяным паром, концентрированной азотной и серной кислотами, оксидами металлов. В «аморфном» состоянии (уголь, кокс, сажа) легко сгорает на воздухе. В 1985 г. появилось сообщение о синтезе сферической структуры фуллерена
-гибридизации образуется плоская структура, причем, оставшиеся негибридизованные p-электроны ответственны за электронную проводимость. Между слоями возникает вандерваальсовское взаимодействие. Такую слоистую структуру имеет графит. Графит характеризуется мягкостью, поэтому используется как твердая смазка. Он используется также для изготовления электродов, как футеровочный материал в ряде аппаратов и как замедлитель нейтронов в ядерных реакторах. При обычной температуре весьма инертен. При высоких температурах непосредственно взаимодействует с многими металлами и неметаллами (водородом, кислородом, фтором, серой). Типичный восстановитель; реагирует с водяным паром, концентрированной азотной и серной кислотами, оксидами металлов. В «аморфном» состоянии (уголь, кокс, сажа) легко сгорает на воздухе. В 1985 г. появилось сообщение о синтезе сферической структуры фуллерена 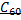 , состоящего из 60 атомов углерода углерода, позднее были синтезированы другие фуллерены
, состоящего из 60 атомов углерода углерода, позднее были синтезированы другие фуллерены 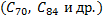 . Они представляют собой замкнутые структуры с
. Они представляют собой замкнутые структуры с 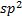 -гибридизованными атомами углерода. Негибридизованные π-электроны – делокализованные , как в молекуле бензола. Форма фуллерена
-гибридизованными атомами углерода. Негибридизованные π-электроны – делокализованные , как в молекуле бензола. Форма фуллерена 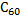 напоминает форму футбольного мяча, а
напоминает форму футбольного мяча, а 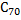 – форму дыни. Кристаллы фуллеренов можно отнести к молекулярному типу, в них молекулы фуллеренов находятся в узлах кристаллической решетки. Фуллерен
– форму дыни. Кристаллы фуллеренов можно отнести к молекулярному типу, в них молекулы фуллеренов находятся в узлах кристаллической решетки. Фуллерен 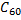 возгоняется при 800оC. В последнее время удалось ввести во внутреннюю сферу фуллерена ионы некоторых металлов.
возгоняется при 800оC. В последнее время удалось ввести во внутреннюю сферу фуллерена ионы некоторых металлов.
o При -гибридизации образуется карбин. Это черный порошок, плотность которого ниже, чем у графита. Он химически активнее графита. Имеются разновидности связей в карбине: 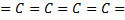 и
и 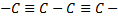
Атомы углерода, составляющие основу структуры органических соединений, всегда являются четырехвалентными. Они способны соединяться не только с атомами других элементов, но и между собой, образуя углеродные цепи различного вида: как открытые, так и замкнутые (циклические); как прямые, так и разветвленные. В зависимости от числа связей, затрачиваемых атомами углерода на соединение друг с другом, цепи могут быть насыщенными (с ординарными связями) или ненасыщенными (с кратными — двойными и тройными — связями).
Древесный уголь, в отличие от графита и алмаза, обладает замечательным свойством, называемым адсорбцией. Адсорбция – поглощение газообразных или растворённых веществ поверхностью твёрдого вещества. Если древесный уголь нагревать без доступа воздуха в специальной печи, то он сохраняет тонкопористость, которая досталась ему от древесины, и к тому же имеет большую поверхность, которая способна поглощать при обычных условиях газообразные или растворённые вещества. Такой уголь называется активированным.
Активированный уголь применяют для очистки питьевой воды (в фильтрах), сахара, жиров и мёда от посторонних примесей. В аптеках активированный уголь продаётся в виде таблеток под названием «Карболен». Его применяют для очищения желудочно- кишечного тракта от продуктов брожения и других растворённых веществ. В 1915 году российский учёный Н.Д.Зелинский предложил применять активированный уголь в противогазах для защиты органов дыхания от вредных газов.
Дата: 2019-07-30, просмотров: 807.