Основные этапы развития представлений о существовании и строении атомов.
Представление об атомах как неделимых мельчайших частицах веществ возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К концу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье, великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона была доказана реальность существования атомов.
| В 1897 году Дж.Томпсон открыл электроны и предложил первую модель атома, представив атом как положительно заряженный сгусток материи, в который вкраплено столько электронов, что превращает его в электрически нейтральное образование Положительно заряженных частиц внутри атома модель Томсона не предполагала. | 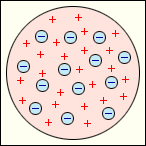
|
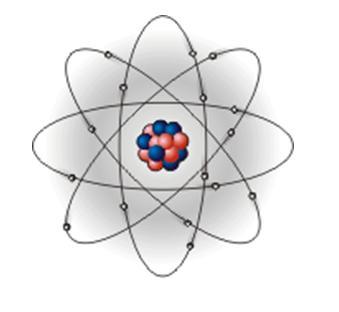
| В 1911 г. английским физиком Э. Резерфордом при исследовании движения альфа-частиц в газах и других веществах была обнаружена положительно заряженная часть атома. В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Поскольку масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой. Предложенная Резерфордом планетарная модель атома легко объясняет явления отклонения альфа-частиц. Планетарная модель атома не объясняла устойчивости атомов. |
| Первая попытка построить качественно новую — квантовую — теорию атома была предпринята в 1913 г. Н.Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров и ядерную модель атома Резерфорда. В основу своей теории атома Бор положил следующие постулаты. Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией hν=En-Em, равной разности энергий соответствующих стационарных состояний. |
Версия 2
1) Кусочки материи.
Демокрит полагал, что свойства того или иного вещества определяются формой, массой, пр. характеристиками образующих его атомов: у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с дружкой, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.
2) «Пудинг с изюминками» (модель Томсона) .
Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Эта модель не объясняет сериальный характер излучения атома.
3) Атом, типа Сатурна. 1904 год. Хентара Нагаока. Маленькое положительное ядро, вокруг которого, по орбиталям, вращаются электроны.
4) Планетарная модель атома. 1911 год. Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой скорее некоторое подобие планетной системы, то есть что электроны движутся вокруг положительно заряженного тяжёлого ядра, расположенного в центре атома. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает. Постулаты Бора показали, что для описания атома классическая механика неприменима.
Спектры атомов как источник информации об их строении.
атомные спектры
Всякий спектр представляет собой развертку, разложение излучения на его компоненты. Для получения спектра используется специальный прибор-спектрометр. На рис. 1.8 схематически изображен полный спектр электромагнитного излучения. Обратим внимание на то, что видимый свет составляет только небольшую часть всего спектра электромагнитного излучения. Видимый свет может служить примером непрерывного излучения. В непрерывном излучении содержится излучение со всеми длинами волн в пределах некоторого диапазона. Его спектр называется непрерывным (сплошным) спектром. Примером спектра такого типа является известное всем природное явление-радуга.
Когда пучок непрерывного излучения, например белый свет, пропускают через газообразный образец какого-либо элемента, в прошедшем через образец пучке света недостает излучения с определенными длинами волн. Спектр этого, поглощенного образцом, излучения называется атомным спектром поглощения. Длины волн излучения, поглощенного атомами образца, обнаруживаются по темным линиям на фоне непрерывного спектра.
Если элементы в их газообразном состоянии нагревать до высоких температур или пропускать через них электрический разряд, они испускают излучение с определенными длинами волн. Спектр такого излучения называется атомным спектром испускания или атомным эмиссионным спектром
Вопрос №25. Квантово-механическая модель строения атомов. Электронные формулы и электронноструктурные схемы атомов.
В основе современной теории строения атома лежат следующие основные положения:
Дата: 2019-07-30, просмотров: 875.