В силу наличия у микрочастиц волновых свойств невозможно в каждый момент времени точно фиксировать их положение в пространстве и определять с любой точностью скорость их движения. Чем точнее мы измеряем один параметр, тем больше неопределенность в другом. Принцип неопределенности сформулирован Гейзенбергом (1927 г.) и имеет математическое выражение
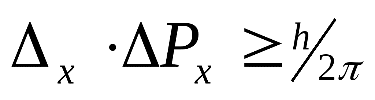
| где Δх – неопределенность положения частицы по оси х, ΔРх = Δ(m·υ) – неопределенность составляющей импульса по оси х. |
Из формулы видно, что чем меньше значение Δх , т.е. чем определеннее положение частицы, тем больше ΔРх, т.е. тем неопределеннее ее импульс. Неопределенность в свойствах микрообъектов проявляется тем в большей степени, чем в большей степени выражена его волновая функция (чем меньше его масса). Поэтому неопределенность в положении электрона значительно больше, чем неопределенность в положении ядра атома.
ЭЛЕКТРОН В АТОМЕ НЕ ДВИЖЕТСЯ ПО ОПРЕДЕЛЕННЫМ ТРАЕКТОРИЯМ, А МОЖЕТ НАХОДИТСЯ В ЛЮБОЙ ЧАСТИ ОКОЛОЯДЕРНОГО ПРОСТРАНСТВА, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Вероятность нахождения электрона в разных местах околоядерного пространства можно определить с помощью уравнения Шредингера
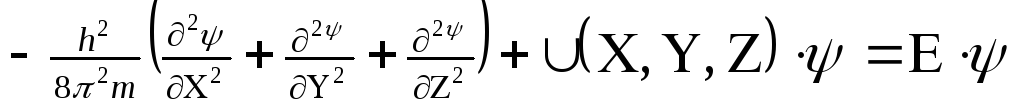
| где h – постоянная Планка, m – масса электрона, U – потенциальная энергия, Е – полная энергия, ψ – волновая (пси) функция |
Первый член уравнения
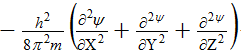 соответствует кинетической энергии частицы (Ек) с массой m. При короткой записи Ек описывается оператором Лапласа
соответствует кинетической энергии частицы (Ек) с массой m. При короткой записи Ек описывается оператором Лапласа 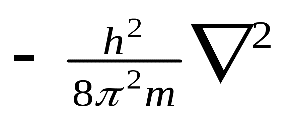
где - 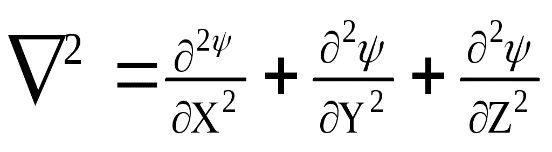 оператор Лапласа.
оператор Лапласа.
Упрощенный вид уравнения Шредингера
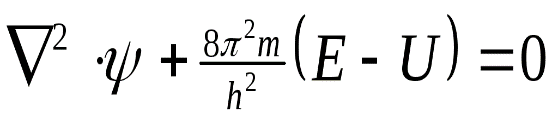
Решение этого уравнения связано с большими математическими трудностями. Точное решение оно имеет для атома водорода и для одноэлектронных частиц. Для сложных атомов уравнение Шредингера может быть решено только приблизительно. Решая его находят энергию электрона, а также функцию координат электрона X, Y, Z и времени τ: 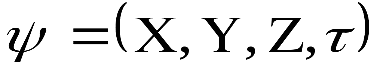
Волновая функция ψ представляет собой амплитуду трехмерной электронной волны. Причем она имеет как положительные, так и отрицательные значения. Квадрат модуля волновой функции 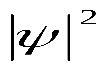
характеризует вероятность нахождения электрона в некотором объеме. Эту величину называют также электронной плотностью. Если в соответствии с уравнением Шредингера получим, что
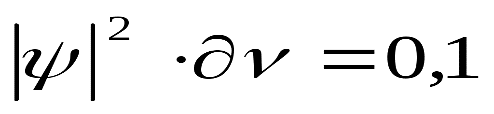
| где - определенный объем, то это значит, что в данном объеме электрон находится 0,1 времени, а 0,9 – в другом месте, т.е. можно утверждать, что электронная плотность в данном объеме равна 0,1. |
Совокупность мест пространства, где 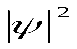 имеет максимальное значение называют электронной орбиталью.
имеет максимальное значение называют электронной орбиталью.
Таким образом, электронной орбиталью или электронным облаком называется часть околоядерного пространства, в котором вероятность пребывания электрона максимальна.
Поверхность, охватывающая ядро атома, за пределами которой вероятность пребывания электрона исчезающее мала, называют граничной поверхностью орбитали, которая и передает форму самой орбитали.
4. ЯДРА АТОМОВ СОСТОЯТ ИЗ ПРОТОНОВ И НЕЙТРОНОВ (общее название - нуклоны).
Число протонов в ядре равно порядковому номеру элемента в таблице Д.И. Менделеева, а сумма протонов и нейтронов его атомному числу.
Массовое число (А), заряд ядра (Z), равный числу протонов, и число нейтронов (N) связаны соотношениями: Z = А – N, N = А – Z, А = Z + N.
Атомы с одинаковыми Z, но разными А и N, называют изотопами.
Электронные формулы и электронноструктурные схемы атомов.
Электроны в атоме распределяются в соответствии со значениями их четырех квантовых чисел и с учетом следующих правил (или принципов):
Принцип минимальной энергии и правило Клечковского. “Атомные орбитали заполняются электронами в порядке повышения энергии их уровней”. Клечковский, предложивший данный принцип, рассчиттывал энергию атомных орбиталей как сумму главного и орбитального квантового квантовых чисел (n+l). При одинаковых энергиях этой суммы первой заполняется орбиталь с меньшим значением главного квантового числа
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f 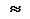 5d < 6p < 7s < 5f
5d < 6p < 7s < 5f 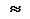 6d..
6d..
Мне кажется, что стоит вписать свой пример
| Элемент | Заполнение орбитали |
Принцип Паули “В атоме не бывает двух электронов, описываемых набором одинаковых квантовых чисел”. Из этого принципа вытекают важные следствия:
1) на одной атомной орбитали может находиться не более двух электронов;
2) спины электронов должны быть разными на одной АО. Если электроны находятся на разных АО, то спины могут совпадать. 
Правило Гунда: “В пределах одного незавершенного подуровня электроны располагаются по одному в свободных АО, ориентируя свои спины параллельно”, т.е. по абсолютному значению должно быть так, чтобы спин электронов в сумме в подуровне был максимален.
Например, атом азота имеет три электрона, находящиеся на 2р-подуровне. Согласно правилу Гунда, они должны располагаться поодиночке на каждой из трех 2р-орбиталей. При этом все три электрона должны иметь параллельные спины: 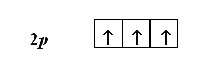

Вопрос №26. Периодический закон (ПЗ) Д.И. Менделеева и его трактовка на основе квантово-механической теории строения атомов.
Формулировка периодического закона, данная Д.И. Менделеевым, гласила: свойства химических элементов находятся в периодической зависимости от атомных масс этих элементов.
Современная формулировка гласит: свойства химических элементов находятся в периодической зависимости от заряда ядра этих элементов.Такое уточнение потребовалось, поскольку к моменту установления Менделеевым периодического закона еще не было известно о строении атома. После выяснения строения атома и установления закономерностей размещения электронов по электронным уровням стало ясно, что периодическая повторяемость свойств элементов связана с повторяемостью строения электронных оболочек.
Вопрос №27. Структура Периодической системы элементов (ПСЭ): периоды, группы, семейства, s-, p-, d-, f классификация элементов (блоки). Длиннопериодный и короткопериодный варианты ПСЭ. Периодический характер изменения свойств атомов элементов: радиус, энергия ионизации, энергия сродства к электрону, относительная электроотрицательность (ОЭО). Определяющая роль внешних электронных оболочек для химических свойств элементов. Периодический характер изменения свойств простых веществ, оксидов и водородных соединений элементов.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами.
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.8 групп
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
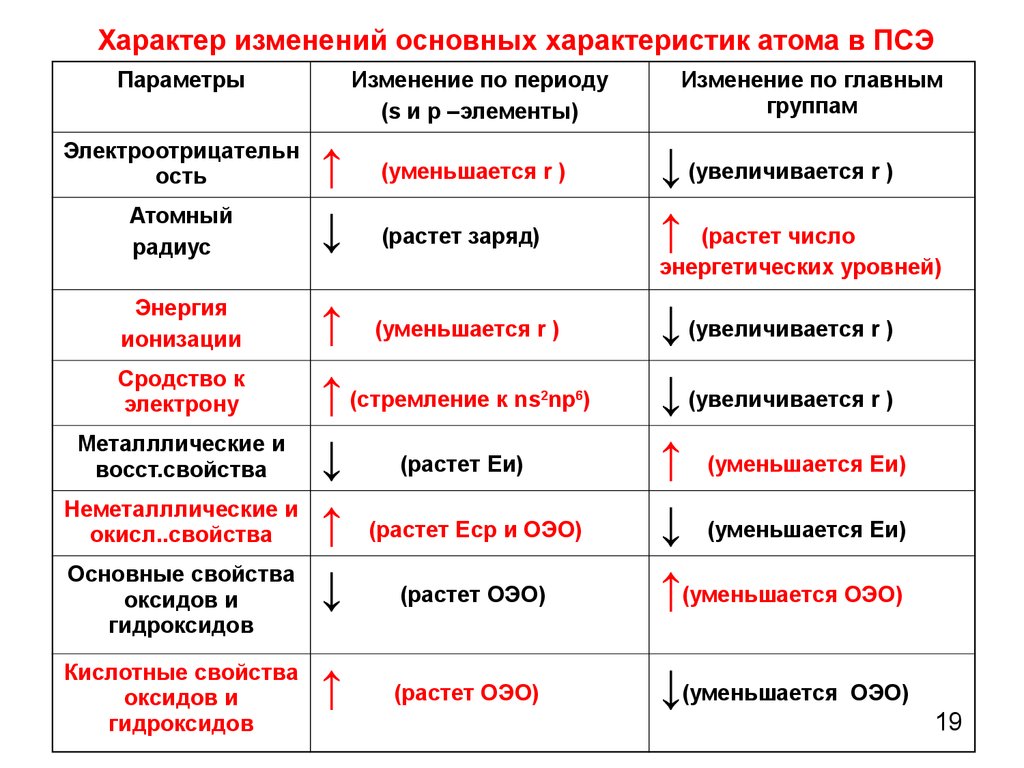
| Изменение некоторых характеристик элементов в периодах слева направо: | Изменение некоторых характеристик элементов в группе сверху вниз: |
| заряд ядер атомов увеличивается; | заряд ядер атомов увеличивается; |
| радиус атомов уменьшается; | радиус атомов увеличивается; |
| электроотрицательность элементов увеличивается; | число энергетических уровней (электронных слоев) атомов увеличивается (равно номеру периода); |
| количество валентных электронов увеличивается от 1 до 8 (равно номеру группы); | число электронов на внешнем слое атомов одинаково (равно номеру группы); |
| высшая степень окисления увеличивается (равна номеру группы); | прочность связи электронов внешнего слоя с ядром уменьшается; |
| число электронных слоев атомов не изменяется; | электроотрицательность уменьшается; |
| металлические свойства уменьшается; | металличность элементов увеличивается |
| неметаллические свойства элементов увеличивается. | неметалличность элементов уменьшается. |
| Энергия ионизации увеличивается | Энергия ионизации увеличивается |
| Сродство к электрону увеличивается. | Сродство к электрону уменьшается |
| Электроотрицательность увеличивается | Электроотрицательность уменьшается. |
В зависимости от строения электронных оболочек атомов все элементы периодической системы делят на четыре семейства: s-, p-, d- и f-элементы.
К семейству s-относят химические элементы, в атомах которых происходит заполнение электронами s-подуровня внешнего уровня. К ним относятся первые два элемента каждого периода.
Элементы, у которых происходит заполнение электронами p-подуровня внешнего уровня, принадлежат к p-элементам. К ним относятся последние шесть элементов каждого периода.
Семейство d-элементов включает переходные элементы, у которых заполняется d-подуровень второго снаружи уровня. К ним относятся элементы больших периодов, расположенных между s- и p-элементами.
У семейства f-элементов происходит заполнение f-подуровня третьего снаружи уровня. К ним относятся лантаноиды и актиноиды.
S-элементы
Химия этих элементов относительно проста. Ее важнейшие черты сводятся к следующим основным положениям:
1) все элементы данного семейства являются в большей или меньшей степени типичными металлами, а их соединения проявляют основные свойства;
2) в водных растворах s-элементы существуют в виде простых катионов с постоянным зарядом;
3) как щелочные, так и щелочноземельные металлы химически весьма активны, хоть и в неодинаковой степени;
4) типичные элементы этого семейства — литий и бериллий — по своим свойствам во многом отличаются от своих групповых аналогов.
P-элементы
Семейство р-элементов объединяет элементы, проявляющие преимущественно неметаллический или амфотерный характер, а их соединения в большинстве случаев имеют кислотные свойства. В отличие от s-элементов, здесь, в силу особенностей электронного строения атомов, наблюдается большее разнообразие степеней окисления, а проявления химической индивидуальности элементов и их соединений значительно богаче.
D-элементы
Для d-элементов характерны как металлические, так и неметаллические свойства, среди которых в первую очередь следует назвать их ярко выраженную склонность к образованию комплексных соединений. Не менее важной особенностью этих элементов является чрезвычайно широкое многообразие их валентных состояний, вытекающее из особенностей электронной структуры атомов. В рядах d-элементов часто проявляется внутренняя периодичность свойств.
F-элементы
У элементов второй побочной подгруппы III группы (лантаноиды иактиноиды) последними заполняются атомные f-орбитали еще более глубокого (n-2) энергетического уровня, т.е. (n-2) f-орбитали. Эти элементы называются f-элементами или элементами f-электронного семейства или редкоземельными элементами. Для них, также как и для d-элементов характерны промежуточные химические свойства и близкие значения атомных характеристик (электроотрицательность меняется от 1,2 до 1,5). f-элементы могут проявлять различные валентности при образовании химических соединений.
Главный принцип построения Периодической системы - выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом). Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы - 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство. Номер группы в Периодической системе определяет число валентных электронов а атомах элементов. При этом в группах, обозначенных буквой А, содержатся элементы, в которых идет заселение s- и р-подуровней - s-элементы (IA- и IIA-группы) и р-элементы (IIIA-VIIIA-группы), а в группах, обозначенной буквой Б, находятся элементы, в которых заселяются d-подуровни - d-элементы.
На внешних электронных оболочках( энергетических уровнях) находятся валентные электроны, т.е. электроны определяющие валентность элемента. Это распространяется для элементов главных подгрупп; исходя из этого элементы и располагаются в определенных группах. Например у натрия на последнем энергетическом уровне 1 электрон, он расположен в 1 группе, его валентность равна одному. У серы -6 электронов и она находится в 6группе.По количеству электронов на последнем энергетическом уровне можно определить это металл или неметалл. У металлов от одного до 3 электронов( исключение В), а у неметаллов расположено больше 3. Для неметаллов можно определить и низшую валентность. Например азот расположен в 5 группе, значит на последнем энергетическом уровне у него 5 электронов. Делаем вывод, что его высшая валентность( валентность с кислородом) равна 5, а низшая =3( от 8 отнимаем номер группы),кроме того это неметалл
Вопрос №28. Типы химических связей и физико-химические свойства соединений с ковалентной, ионной и металлической связью. Экспериментальные характеристики связей: энергия связи, длина, направленность. Экспериментальная кривая потенциальной энергии молекулы водорода (двухэлектронная химическая связь по Гайтлеру – Лондону на примере молекулы водорода).
Химическая связь представляет собой сложное электростатическое взаимодействие, сопровождающееся перестройкой электронных оболочек атомов
Различают внутримолекулярные связи (ковалентная, ионная, металлическая)
Ковалентная связь – это связь, которая образуется за счет образования общих электронных пар.
Характеристики хим связи.
1 – кратность связей – между 2мя атомами возможна только 1 сигма-связь, но наряду с ней между теми же атомами могут быть пи и дельта-связь, что приводит к образованию кратных связей. Кратность определяется числом общих электронных пар.
2 – длина связи – межъядерное расстояние в молекуле, чем больше кратность, тем меньше ее длина.
3 – прочность связи – это количество энергии необходимое для ее разрыва
4 – насыщаемость ковалентной связи проявляется в том, что одна атомная орбиталь может принимать участие в образовании только одной к.с. Это свойство определяет стехиометрию молекулярных соединений.
5 – направленность к.с. в зависимости от того, какую форму и какое направление имеют электронные облака в пространстве при их взаимном перекрывании могут образовываться соединения с линейной и угловой формой молекул.
| пример |
Различают два механизма образования ковалентной связи: I. Обменный когда два взаимодействующих атома предоставляют по одному неспаренному электрону для образования связи. II. Донорно - акцепторный когда один из взаимодействующих атомов предоставляет неподеленную пару электронов (донор), а второй вакантную атомную орбиталь (акцептор)
Ионная связь- возникает между атомами, разница в электроотрицательности которых, составляет больше 1,9. В ионных соединениях атомы более электроотрицательных элементов (неметаллов) дополняют свой внешний энергетический уровень до октета за счет электронов атомов менее электроотрицательных элементов (металлов), у которых предвнешний уровень становится внешнем уровнем.
Механизм образования ионной связи: а) образование ионов взаимодействующих атомов; б) образование молекулы за счет притяжения ионов.
Ненаправленность и ненасыщенность ионной связи
Силовые поля ионов равномерно распределяются во всех направлениях поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении. В этом заключается ненаправленность ионной связи. Взаимодействие 2х ионов противоположного знака не приводит к полной взаимной компенсации их силовых полей. Поэтому у них сохраняется способность притягивать ионы и по другим направлениям, т.е. ионная связь характеризуется ненасыщенностью. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона).
| пример |
Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их валентных электронов.
Связь сильно делокализована и не обладает направленностью и насыщенностью , т.к. валентные электроны равномерно распределены по кристаллу. Наличие свободных электронов обусловливает существование общих свойств металлов: непрозрачность, металлический блеск, высокая электро и теплопроводность, ковкость и пластичность.
Параметры ковалентной связи Параметрами ковалентной связи являются длина, энергия, валентный угол и полярность.
Энергия связи (Есв ) равна работе, которую необходимо затратить на разрыв связи, и измеряется в кДж/моль. Длина связи (dсв) определяется межъядерным расстоянием. Валентный угол – это угол, образованный направлениями двух соседних связей.
Напрвленность Химические связи характеризуются определенной направленностью в пространстве. Причем согласно квантово – механической теории, в зависимости от формы атомной орбитали, ориентация орбиталей в пространстве различная.
Согласно концепции гибридизации орбитали центрального атома, участвующие в образовании σ – связей, выравниваются по форме и энергии.
При sp – гибридизации гибридизуется одна s – и одна p – орбиталь, при этом образуются две гибридные орбитали
180 гр линейная При sp2 – гибридизации гибридизуется одна s – и две p – орбитали, при этом образуются три гибридные орбитали. Угол между направлением этих орбиталей составляет 120гр треугольник При sp3 – гибридизации гибридизуется одна s – и три p – орбитали, при этом образуются четыре гибридные орбитали. 109028' тетраэдр
При sp3d2– гибридизации гибридизуется одна s – , три p – и две d - орбитали, при этом возникает шесть гибридных орбиталей 90 гр октаэдр
В 1927 году В.Гейтлер и Ф.Лондон произвели приближенный расчет молекулы водорода. Вначале они рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга и выразили зависимость волновой функции рассматриваемой системы от координат. Далее они предположили, что найденная зависимость сохраняется и при сближении атомов водорода. В результате они получили уравнения, позволяющие найти зависимость потенциальной энергии системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов.
| Изображение на примере атома водорода |
Вопрос №29. Описание молекулы методом валентных связей (МВС). Механизм образования ковалентной связи. Насыщаемость ковалентной связи. Направленность ковалентной связи как следствие условия максимального перекрывания орбиталей. Сигма и пи-связи и их образование при перекрывании s-, p- и d-орбиталей. Кратность связей в методе валентных связей. Поляризуемость и полярность ковалентной связи. Эффективные заряды атомов в молекулах. Полярность молекул.
Основные положения МВС.
Химическая связь представляет собой сложное электростатическое взаимодействие, сопровождающееся перестройкой электронных оболочек атомов.
Основные положения метода валентных связей 1. Химическая связь осуществляется двумя электронами с противоположной ориентацией спинов.
2. Связующая электронная пара находится в общем пользовании двух атомов и локализована между двумя ядрами.
3. Молекулярная волновая функция φ рассчитывается как произведение атомных волновых функций. Таким образом, ковалентная химическая связь рассматривается как двухэлектронная, двухцентровая и локализованная. Недостатки МВС: 1) не объясняет магнитные свойства частиц;
2) специфические связи между атомами (такие, как в молекуле бензола и в металлических кристаллах);
3) устойчивость некоторых заряженных частиц (Н2+).
| Пример( в рабочей тетради писали) |
Различают два механизма образования ковалентной связи: I. Обменный когда два взаимодействующих атома предоставляют по одному неспаренному электрону для образования связи. II. Донорно - акцепторный когда один из взаимодействующих атомов предоставляет неподеленную пару электронов (донор), а второй вакантную атомную орбиталь (акцептор)
| Пример( в рабочей тетради писали) |
Насыщаемость это способность атома при химическом взаимодействии использовать все свои валентные возможности. Валентностью называется число образованных атомом связей.
Различают основную и максимальную валентности. Основная валентность определяется числом неспаренных электронов. Максимальная определяется числом валентных орбиталей, способных участвовать в образовании связей. При этом безразлично, как заселены электронами орбитали, т.к. связь может быть образована и одноэлектронной орбиталью (по обменному механизму), и двухэлектронной (по донорно – акцепторному механизму, донор), и пустой (по донорно – акцепторному механизму, акцептор).
Виды ковалентной связи. Кратность связи. В зависимости от взаимной ориентации орбиталей в пространстве характер их перекрывания различен. Различают сигма - и пи - химические связи. сигма - связь образуется при перекрывании атомных орбиталей на линии, соединяющей центры взаимодействующих атомов. сигма - связь может быть образована орбиталями любой симметрии. Орбитали перекрываются глубоко и такими участками, в которых электронная плотность высока, поэтому сигма - связь является энергетически наиболее выгодной и более прочной чем пи - связь. Пи - связь возникает при перекрывании р, d или f – атомных орбиталей над линией, соединяющей центры взаимодействующих атомов. Орбитали, образующие пи - связи, перекрываются такими участками, где электронная плотность относительно мала, поэтому пи - связи характеризуются более низкой энергией и меньшей прочностью чем сигма - связь. Число связей (или число электронных пар), соединяющих два атома, называется кратностью связи. Различают одинарные, двойные и тройные связи. С увеличением кратности связи длина ее уменьшается.
Кратность связи - количество электронных пар, участвующих в образовании химических связей. Чем выше кратность, тем прочнее атомы связаны друг с другом (длина связи уменьшается)
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи. Помимо σ- и π-связей, возможно образование еще одного вида связи - δ-связи:
Обычно такая связь образуется после образования атомами σ- и π-связей при наличии у атомов d- и f-орбиталей путем перекрывания их "лепестков" сразу в четырех местах. В результате кратность связи может возрасти до 4-5.
Например, в октахлородиренат(III)-ионе [Re2Cl8]2- между атомами рения образуются четыре связи.
Дата: 2019-07-30, просмотров: 958.