Окислительно-восстановительными называются реакции, сопровождающиеся переносом электронов от донора к акцептору. По аналогии с кислотно-основными реакциями взаимодействующие вещества образуют сопряженные пары, которые принято называть окислительно-восстановительными парами. Оба компонента пары различаются числом электронов. Богатый электронами компонент называется восстановленной формой, а бедный электронами - окисленной формой соответствующего соединения. В ходе овр восстановленная форма одной пары (восстановитель) переносит электроны на окисленную форму (окислитель) другой пары. При этом восстановитель окисляется, а окислитель восстанавливается.
Если элемент находится в промежуточной степени окисленности, то его атомы могут, в зависимости от условий, как принимать, так и отдавать электроны. В первом случае степень окисленности элемента будет понижаться, во втором — повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисленности, обладают окислительно-восстановительной двойственностью-способностью вступать в реакции как с окислителями, так и с восстановителями.
Так, азот образует соединения, в которых степень его окисленности изменяется от —3 (аммиак и соли аммония) до +5 (азотная кислота и ее соли). Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты— только в качестве окислителя. Азотистая же кислота и ее соли, где степень окисленности азота равна +3, вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В первом случае окисляется до азотной кислоты, во втором — восстанавливается обычно до оксида азота.
В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
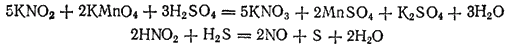
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод,пероксид водорода и ряд других веществ.
Вещества, содержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой кислот:
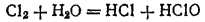
Здесь и окисление, и восстановление претерпевает хлор:
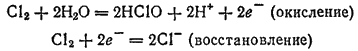
Самоокисление-самовосстановление называют также диспропорционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации. Так, в ходе термической диссоциации водяного пара.
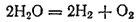
кислород окисляется (его степень окисленности возрастает от —2 до 0), а водород восстанавливается (его степень окисленности уменьшается от +1 до 0).
Вопрос №12. Стандартное изменение энергии Гиббса и Гельмгольца окислительно-восстановительной реакции и стандартные окислительно-восстановительные потенциалы (электродные потенциалы). Определение направления протекания ОВ реакций по разности ОВ потенциалов.
Полезная работа Апол. электрохимического элемента представляет собой работу электрического тока и может быть найдена:
Аэлек = qj = nFj, (1.28)
где q - количество электричества, n – число электронов, отдаваемых или присоединяемых в элементарном акте, F – число Фарадея.
Согласно (1.20) для обратимых процессов DG= –Апол = –nFj. Самопроизвольному течению процесса соответствует отрицательное значение энергии Гиббса, следовательно, для реакций, протекающих в электрохимических элементах (окислительно-восстановительных реакций) должно выполняться: –nFj < 0. Поскольку n и F положительны, то приходим к заключению, что самопроизвольно протекают те окислительно-восстановительные реакции, для которых величины ЭДС положительны. Например, определим, возможно ли в стандартных условиях окисление перманганатом калия ионов Fe2+ и Co2+ до Fe3+ и Со3+ в кислой среде. Величины электродных потенциалов:
MnO4– + 8H+ + 5ē = Mn2+ + 4H2O; Е1=1,51 В (окисл);
Fe3+ + ē = Fe2+; Е2=0,77 В (восст);
Co3+ + ē = Co2+; Е3=1,82 В (восст).
Для первого процесса
φ1 0= Е0окисл–Е0восст =Е10-Е20=1,51-0,77 = 0,74 В.
Для второго процесса
φ2 0= Е0окисл–Е0восст =Е10-Е30 = 1,51–1,82 = –0,31 В.
Как видно, самопроизвольное течение возможно лишь для первого процесса. Вторая реакция запрещена, перманганат-ион не может окислить ион Co2+ до Co3+, а наоборот - в кислой среде ион Co3+ окисляет Mn2+ до перманганат-иона.
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд. Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Его значение и знак (+ или -) определяются природой раствора и находящегося в нем металла. При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e— = Zn2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu2+ + 2e— = Cu
Таким образом, в элементе происходит такая реакция:
Zn + Cu2+ = Zn2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
Проведем реакцию
2Fe3+ + 2I— = 2Fe2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник. В сосуды, содержащие растворы Fe3+ и I—, поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток. Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe3+:
2I— — 2e— = I2
2Fe3+ + 2e— = 2Fe2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом. Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
|
Дата: 2019-07-30, просмотров: 689.