Ограничения теории Аррениуса были преодолены в протонной теории кислот и оснований Бренстеда и Лоури. Их теория связала кислотно-основные свойства с отношением вещества к протону. По этой теории:
Кислота – это вещество, стремящееся отдать протоы, донор протонов.
Основание – вещество, стремящееся присоединить протоны, акцептор протонов.
Кислота, отдавая протон, превращается в сопряженное ей основание, например:
HCl → H+ + Cl‾
HCN → H+ + CN‾
HCl и HCN кислоты, а Cl ‾ и CN‾ - сопряженные основания.
Основание принимает протон и переходит в сопряженную кислоту, например:
ОН‾ + Н+ ↔ Н2О
ОН‾ является основанием, а Н2О – сопряженной кислотой.
Сопряженные кислота и основание называются протолитами, они образуют протолитическую систему: кислота ↔ основание + Н +.
Амфолиты – вещества, кислотно-основное поведение которых определяется другим участником реакции. Они могут выступать в качестве как кислоты, так и основания. Для них характерно кислотно-основное диспропорционирование.
Пример амфолитов: вода диссоциирует по схеме Н2О + Н2О ↔ Н3О + + ОН ‾. Вода способна проявлять как кислотные, так и основные свойства в зависимости от кислотно-основных свойств растворённого вещества. В присутствии кислоты молекула воды принимает протон, т.е. играет роль основания, например:
HCl + Н2О ↔ Н3О+ + Cl‾
В растворе основания, например
NH3 + Н2О ↔ NH4+ + OH‾
Вода выступает в роли кислоты, которой сопряжено основание ОН‾.
Таким образом, в водном растворе кислоты или основания всегда присутствуют две сопряженные пары кислота – основание.
Согласно протонной теории в сопряженной паре кислота – основание всегда сильному донору протонов сопутствует слабый акцептор, и наоборот. Чем сильнее кислота, тем слабее сопряженное ей основание.
В частности, сильной кислоте HCl сопряжено слабое основание Cl‾ :
1-я сопряженная пара (HCl и Cl‾) 2-я сопряженная пара (H2O и Н3О+)
HCl + H2O ↔ Н3О+ + Cl ‾
HCl –более сильная кислота; Cl‾ - более слабое основание в 1-ой сопряженной паре;
Н2О – более сильное основание; Н3О+ - более слабое основание.
Соответственно соляная кислота диссоциирует полностью.
Слабой кислоте HCN сопряжено сильное основание CN‾, и равновесие диссоциации синильной кислоты смещено влево:
1-я сопряженная пара 2-я сопряженная пара
HCN + H2O ↔ Н3О+ + СN ‾
Более слабая кислота HCN - более сильное основание CN‾ 1-я сопряженная пара
Более сильная кислота Н3О+ - более слабое основание Н2О 2-я сопряженная пара
Относительная сила кислот и оснований связана с их донорно-акцепторными способностями по отношению к протону. Для бескислородных кислот способность отщеплять водородный ион определяется полярностью связи водород – кислотный остаток. Например, в ряду HF – HCl – HBr – HI энергия связи падает, а кислотность растёт. В ряду же СН4 – NH3 – H2O – HF кислотность увеличивается с ростом электроотрицательности атома, с которым связан водород, несмотря на упрочнее связи.
В случае кислородсодержащих кислот наибольшее значение имеет полярность связи Н – О, которая в свою очередь зависит от природы центрального атома и числа негидроксильных атомов кислорода в молекуле. Природа центрального атома, его металлические или неметаллические свойства определяют и кислотно-основные свойства его гидроксида. Он будет вести себя как основание, если преобладают металлические свойства, или как кислота, если преобладают свойства неметалла.
Кислоты и основания Льюиса
В принципе, следуя по пути расширения взглядов на кислоты и основания, можно считать, что кислотные свойства сопряжены с наличием некоторого электрофильного центра (имеет положительный заряд), притягивающего отрицательно заряженные частицы и стремящегося отдать положительно заряженные, а основные свойства – наоборот. Так, Льюис предложил считать кислотой акцептор пары электронов, имеющий подходящую вакантную орбиталь, а основанием – донор, имеющий неподелённую пару электронов. В результате взаимодействия основания с кислотой образуется донорно-акцепторная ковалентная связь:
Акцептор + Донор = Донорно-акцепторный комплекс
Кислота + Основаните = Продукт нейтрализации
H+ + ׃NH3 = NH4+
H+ + ׃ OH‾ = H2O
BF3 + ׃NH3 = F3B ׃ NH3
HCl + ׃NH3 = NH4Cl
H+ + ׃OH‾ = H2O
Ag+ + ׃NH3 = [Ag(NH3)2]+
AlCl3 + ׃Cl‾ = [AlCl4]‾
Электронная теории Льюиса применима к процессам, протекающим без участия растворителя.
Очевидно, что при изучении состояния веществ и процессов в водных растворах оптимальной является протонная теория.
Амфотерные гидроксиды металлов удобно рассматривать одновременно и как основания – акцепторы протонов:
Al(OH)3(тв.) + 3Н3О+ → [Al(H2O)6]3+ (раств.)
и как кислоты Льюиса – акцепторы электронных пар
Al(OH)3(тв.) + 3ОН‾ (р-р) → [Al(OH)6]3- (р-р)
( я думаю, что пусть лучше 10 раз будет написано и 10 раз мы это прочитаем, потому что я не особо понимаю, что вообще хотят в этом вопросе, так что пусть лучше будет больше и повторяться)
Гидролиз – реакция обменного разложения веществ водой.
Различают три случая гидролиза.
1. Гидролиз по катиону. Характерен для солей, образованных слабым основанием и сильной кислотой (например, NН4Сl, Al(NO2)3, CuSO4 и др.). Рассмотрим гидролиз хлорида аммония NН4Сl. Анионы Сl, образующиеся при диссоциации NН4Сl= NН4 + + Сl-, не связывают ионов водорода, так как НС1 – сильная кислота. Катионы NН4+ связывают ионы ОН- с образованием слабо диссоциирующего основания NН4СН по уравнению NН4+ +НОН 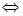 NН4ОН+Н+. При этом освобождаются ионы Н+, обеспечивающие кислую реакцию среды (рН<7).
NН4ОН+Н+. При этом освобождаются ионы Н+, обеспечивающие кислую реакцию среды (рН<7).
Молекулярное уравнение гидролиза записывается в виде
NН4Сl+Н2О 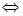 NН4ОН+НСl.
NН4ОН+НСl.
Самым слабым электролитом в рассматриваемой системе является вода, поэтому равновесие смещено влево и гидролиз до конца не идет.
2. Гидролиз по аниону. Характерен для солей, образованных сильным основанием и слабой кислотой (например, КCN, СН3СООNа, Na2CO3, K2S и др.).
Рассмотрим гидролиз ацетата натрия СН3СООNа. Рассуждая аналогично первому случаю, приходим к выводу, что в данной соли гидролизуется анион СН3СОО- по уравнению:
СН3СОО- + НОН 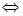 СН3СООН + ОН-
СН3СООН + ОН-
Реакция среды щелочная (рН> 7).
Молекулярное уравнение реакции записывается следующим образом:
СН3СООNa + Н2О 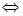 СН3СООН + NaОН.
СН3СООН + NaОН.
3. Гидролиз по аниону и катиону. Характерен для солей, образованных слабым основанием и слабой кислотой.
Например, при гидролизе ацетата аммония NH4CH3COO и катион, и анион участвуют в процессе, образуя слабо диссоциирующие основание и кислоту:
NH 4 + + CH 3 COO - + НОН 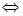 NH 4 ОН + CH 3 COO Н.
NH 4 ОН + CH 3 COO Н.
В этом случае реакция среды определяется относительной силой (константой диссоциации) образующихся основания и кислоты. Если основание и кислота одинаковы по силе, то константы диссоциации их равны и рН=7; если кислота сильнее основания, т.е. константа ассоциации кислоты больше константы диссоциации основания, то реакция среды слабокислая, и наоборот.
pH растворов слабых кислот, оснований
Для указания концентрации ионов гидроксония в растворе используется водородный показатель pH раствора – десятичный логарифм обратной величины концентрации ионов гидроксония в растворе:
pH=-lg[H3O+]
Значение pH для нейтрального раствора можно вычислить непосредственно из ионного произведения воды:
Kw=[H3O+][OH-]= 10-14 моль/л
Поскольку [H3O+]=[OH-]= 10-7 моль/л, то
Для нейтрального раствора pH=7
Для кислого pH<7
Для щелочного pH>7
Концентрацию гидроксильных ионов в растворе можно выразить с помощью величины p ОН:
p ОН=- lg [ OH - ]
Величины pH и pOH связаны между собой соотношением:
pH + pOH = pKw =14
Дата: 2019-07-30, просмотров: 482.