Каждый раствор имеет свою концентрацию.
Концентрация – это величина, характеризующая количественный состав раствора, т.е. показывает какое количество вещества растворено в определенном количестве растворителя.
Массовая доля (массовая концентрация) - отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах. Свойства растворов зависят от концентрации.
Виды концентрации:
Массовая доля растворенного вещества в растворе – процентное отношение массы вещества к массе раствора.
Молярность раствора – число молей растворенного вещества в одном литре раствора.
Моляльность – число молей растворенного вещества на 1000 г растворителя. Титр – число растворенного вещества в одном миллилитре раствора.
Насыщаемость растворов:
Ненасыщенные - это те растворы, которые содержат растворенного вещества меньше, чем его может растворить определенный объем (или масса) растворителя.
Насыщенные - это те растворы, которые содержат растворенного вещества столько, сколько его может растворить определенный объем (или масса) растворителя.
Пересыщенные - это те растворы, которые содержат растворенного вещества больше, чем его может растворить определенный объем (или масса) растворителя.
Закон Вант-Гоффа об осмотическом давлении:
Закон Вант-Гоффа:
«Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось бы в газообразном состоянии и занимало бы объем, равный объему раствора»
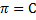 мRT
мRT
Где 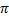 - осмотическое давление, кПа
- осмотическое давление, кПа
R- это газовая постоянная, 8,31 кПа*л/Моль*К
Т – абсолютная температура, К
 м – молярная концентрация, моль/л
м – молярная концентрация, моль/л
Теория электролитической диссоциации (Аррениус С. Каблуков И.А.):
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Теория электролитической диссоциации:
1. при растворении в воде электролиты распадаются на положительные ионы (катионы) и отрицательные ионы (анионы). ионы в растворе взаимодействуют с молекулами воды (гидратация). Процесс диссоциации является обратимым.
2. под действием постоянного электрического тока катионы движутся по катоду, анионы – к аноду.
3. степень диссоциации зависит от природы электролита и растворителя, концентрации электролита и температуры.
Роль осмоса в биосистемах:
Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением.
Плазмолиз- отделение протопласта от клеточной стенки в гипертоническом растворе.
Гемолиз-разрушение эритроцитов с выходом гемоглобина в окружающую эритроциты среду.
Тургор- внутреннее гидростатическое давление в живой клетке, вызывающее напряжение клеточной оболочки.
Гипотонический раствор- раствор, имеющий более низкое осмотическое давление, чем клеточный сок. Всасывание воды клеткой возможно только из гипотонических растворов. При погружении клетки в гипотонический раствор, происходит осмотическое проникновение воды внутрь клетки с развитием её гипергидратации — набухания с последующим цитолизом. Растительные клетки в данной ситуации повреждаются не всегда; при погружении в гипотонический раствор, клетка будет повышать тургорное давление, возобновляя своё нормальное функционирование.
Гипертонический раствор- раствор, имеющий бо́льшую концентрацию вещества по отношению к внутриклеточной. При погружении клетки в гипертонический раствор, происходит её дегидратация — внутриклеточная вода выходит наружу, что приводит к высыханию и сморщиванию клетки.
Изотонический раствор — раствор, имеющий осмотическое давление, равное внутриклеточному. Клетка, погружённая в изотонический раствор, находится в равновесном состоянии — молекулы воды диффундируют через клеточную мембрану в равном количестве внутрь и наружу, не накапливаясь и не теряясь клеткой. Отклонение осмотического давления от нормального физиологического уровня влечёт за собой нарушение обменных процессов между кровью, тканевой жидкостью и клетками организма. Сильное отклонение может нарушить структуру и целостность клеточных мембран.
Вопрос №17.Теория растворов сильных электролитов. Ионная сила растворов, коэффициент активности и активность ионов.
В растворах сильных электролитов нет динамического равновесия между ионами и недиссоциированными молекулами: процесс диссоциации сильных электролитов необратим, вследствие этого растворы сильных электролитов и не подчиняются закону действия масс.
Теория сильных электролитов Дебая-Гюккеля.
Сильными электролитами называются соединения с ионным или ковалентным полярным типом связи, необратимо (полностью) диссоциирующие в водных растворах. К сильным электролитам относятся:
(а) некоторые неорганические кислоты: HCl, HClO4, HNO3, H2SO4 и др.,
(б) щелочи: NaOH, KOH, Ba(OH)2, Ca(OH)2 и др.,
(в) все соли, даже труднорастворимые
Из-за высокой концентрации ионов, в растворе сильного электролита создается собственное электромагнитное поле, интенсивность которого определяется величиной ионной силы раствора (I). Ионная сила раствора рассчитывается по уравнению: 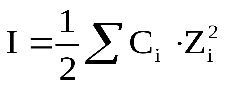
где Сi — молярная концентрация каждого иона, моль/л,
Zi — заряд каждого иона
В растворе сильного электролита вокруг каждого иона создается ионная атмосфера, состоящая из ионов противоположного знака.
Во внешнем электрическом поле ион и его атмосфера приобретают разнонаправленное движение, вследствие чего происходит электрофоретическое торможение ионов и уменьшение электропроводности раствора. Из-за уменьшения электропроводности, вызванной взаимным торможением ионов, создается впечатление, что концентрация ионов в растворе меньше, чем истинная. Эта «кажущаяся» концентрация называется активностью (а). Активность ионов (моль/л) рассчитывается по уравнению:
а = f·См,
где f — коэффициент активности иона, характеризующий отклонение физических свойств растворов от идеальных свойств (f<1).
Активность (a) учитывает взаимное притяжение ионов, взаимодействие растворенного вещества с растворителем, присутствие других электролитов и явления, изменяющие подвижность ионов в растворе. Активность для бесконечно разбавленных растворов равна молярной концентрации вещества: а = См и выражается в грамм ионах на литр.
Коэффициент активности (f) характеризует степень отклонения свойств реальных растворов от свойств идеальных растворов; он является величиной, отражающей все происходящие в растворе явления, вызывающие понижение подвижности ионов и снижающие их химическую активность. Численно коэффициент активности равняется отношению активности к общей молярной концентрации иона:
f = a/c а = cf
В растворах сильных электролитов ионы проявляют свои свойства не в соответствии с их концентрацией, а в соответствии с их активностью.
Вопрос №18.Равновесие между раствором и осадком малорастворимого сильного электролита. Произведение растворимости. Условия растворения и образование осадка.
В насыщенном растворе малорастворимого электролита устанавливается гетерогенное равновесие между осадком и находящимися в растворе ионами:
АmBn  mAn++nBm-.
mAn++nBm-.
осадок 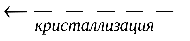 насыщенный раствор
насыщенный раствор
В насыщенном растворе скорости процессов растворения и кристаллизации одинаковы,а концентрации ионов над твердой фазой являются равновесными при данной температуре.
Константа равновесия данного гетерогенного процесса определяется только произведением активностей ионов в растворе и не зависит от активности твердого компонента. Она получила название произведения растворимости ПР. 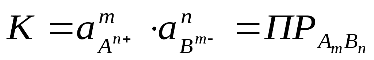
Пусть раствор какого-нибудь сильного электролита, например AgCl, находится в равновесии со своими кристаллами. Тогда между осадком и ионами в насыщенном растворе установится гетерогенное равновесие:
AgCl(тв) ↔ Ag+(водн) + Cl‾(водн).
Запишем выражение константы для гетерогенного равновесия, учитывая, что твёрдые вещества не входят в эту формулу. Имеем:
К = С(Ag+) ∙ C(Сl ‾ ) = ПР
Полученная константа называется произведением растворимости (ПР). Таким образом,
в насыщенном растворе малорастворимого электролита произведение его ионов, возведённых в степень с показателем, равным стехиометрическому коэффициенту при данном ионе, при данной температуре – величина постоянная.
Осадок выпадает в том случае, когда произведение растворимости его ионов в растворе превышает величину произведения растворимости. При этом концентрации ионов в растворе могут быть разными.
если С(Ме+)∙С(А‾)< ПР(МеА), то раствор не насыщен;
если С(Ме+)∙С(А‾)= ПР(МеА), то раствор насыщен; осадка нет;
если С(Ме+)∙С(А‾)> ПР(МеА), то раствор насыщен; есть осадок.
Вопрос №19.Ионизация воды. Ионное произведение воды. Водородный показатель, pH растворов сильных кислот и оснований.
Вода хотя и весьма незначительно, но все же диссоциирует на ионы:
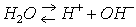
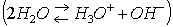
Вода является самым типичным амфотерным электролитом, т.е. она может действовать в равной степени и как кислота, и как основание.
Установлено, что константа ионизации воды равна:
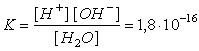
Для воды и разбавленных водных растворов при неизменной t˚ произведение концентрации ионов водорода и гидроксид – ионов есть величина постоянная. Она называется ионным произведением воды.
Для оценки кислотности и щелочности среды удобно пользоваться не концентрацией водородных ионов, а водородным показателем рН. Он равен десятичному логарифму концентрации водородных ионов, взятому с обратным знаком.
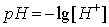
Расчет рН в растворах сильных одноосновных кислот и оснований проводят по формулам:
рН = - lg Cк и рН =14 + lg Со
Где Cк , Со –молярная концентрация кислоты или основания, моль/л
Дата: 2019-07-30, просмотров: 497.