· Сначала называют внутреннюю сферу.
· Составные части еѐ называют в следующей последовательности: лиганды анионы, лиганды – молекулы, комплексообразователь. Записывают формулу в обратной последовательности.
· К названиям лигандов – ионов добавляют окончание «о» (Сl—хлоро-, СN—циано-). Нейтральные молекулы сохраняют свои названия, за исключением Н2О – акво, NН3 – амин.
· Число лигандов указывают греческими числительными: ди, три-, тетра-, пента-, гекса- и т.д.
· В последнюю очередь называют ионы внешней сферы.
Пример: катионные –[Cu(NH3)4]SO4 – тетраамминокупрат (II) сульфат; анион-ные – Na3[Co(NO2)6] –гексанитрокобольтат (III) натрия; нейтральные [Pt(NH3)]Cl2 - дихлородиамминоплатина.
Катионные комплексные соединения помимо гидроксокомплексов и солей, могут быть кислотами, напримерH[SbF6] – гексафторсурьмяная кислота.
В анионных комплексахв качестве лигандов выступают гидроксид-анионы – это гидроксокомплексы (например, Na2[Zn(OH)4] – тетрагидроксоцинкат калия), или анионы кислотных остатков - это ацидокомплексы (например, K3[Fe(CN)6] – гексацианоферрат (III) калия).
p-комплексы (пи-комплексы) – это комплексные соединения, в которых в роли лигандов фигурируют ненасыщенные органические молекулы типа этилена, циклопентадиена, бензола и т.п.
Наиболее известным примером таких комплексов служит ферроцен – бис(циклопентадиенил)железо состава [Fe(C5H5)2]. Циклопентадиен С5H6 – соединение с двумя двойными связями. Он является очень слабой кислотой. При взаимодействии с металлическим натрием образуется циклопентадиенилнатрий Na(C5H5) с анионом С5Н5-:
2 Na + 2 С5H6 = 2 Na(C5H5) + H2
При действии циклопентадиенилнатрия Na(C5H5) на соль железа(II) в среде тетрагидрофурана выделяются оранжевые кристаллы бис(циклопентадиенил)железа:
FeCl2 + 2 Na(C5H5) = [Fe(C5H5)2] + 2 NaCl
Структура этого соединения напоминает сэндвич или бутерброд:
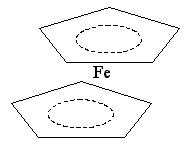
Комплекс диамагнитен, а комплексообразователь – Fe(II) находится между циклическими анионами С5Н5- на равном расстоянии от всех атомов углерода.
Выделить в бис(циклопентадиенил)железе отдельные ковалентные связи между комплексообразователем и атомами лиганда нельзя: центральный атом образует связь со всей p-электронной системой лиганда.
В частице ферроцена донором электронных пар являются циклопентадиенил-ионы, каждый из которых предоставляет по три пары p-электронов. Акцепторами этих электронных пар служат sp3d2-гибридные орбитали железа(II).
Поскольку образуются шесть многоцентровых связей, которые упрочняются по дативному механизму (за счет электронных пар атома железа), валентные штрихи, обозначающие связь металл – лиганд, теряют свой обычный смысл. Следовательно, к p-комплексам относят те комплексы, у которых в образовании связи M – L участвуют p-электроны всего лиганда, а не какого-либо отдельного атома.
Карбонилы металлов — координационные комплексы переходных металлов с монооксидом углерода в качестве лиганда.
Карбонильные комплексы d-элементов, как правило, диамагнитны. Они практически нерастворимы в воде и относятся к категории неэлектролитов, но хорошо растворимы в органических растворителях; так же, как монооксид углерода, они весьма токсичны.
Карбонильные комплексы часто получают прямым синтезом:
Fe(т) + 5 CO(г) = [Fe(CO)5](ж) (при 200 С и 150 атм)
При нагревании карбонилы разлагаются:
[Fe(CO)5](ж) = Fe(т) + 5 CO(г) (при 300 С)
Карбонильные комплексы, растворенные в тетрахлориде углерода, энергично взаимодействуют с галогенами, а кислоты реагируют с карбонилами, как с соответствующими металлами:
2 [Fe(CO)5] + 3 Cl2 = 2 FeCl3 + 10 CO
[Ni(CO)4] + Br2 = NiBr2 + 4 CO
[Fe(CO)5] + H2SO4 = FeSO4 + 5 CO + H2.
Хелатные комплексы – это циклические комплексные соединения, образуемые би- и полидентатными лигандами.
Все хелатные КС характеризуются тем, что один из концевых атомов полидентатного лиганда связан с центральным атомом или ионом-комплексообразователем за счет неспаренных электронов обычной ковалентной связи, а другой за счет донорно-акцепторной связи.
При таком способе образования комплексообразователь оказывается зажатым «клешней» или несколькими «клешнями» и при переходе такого КС в раствор он не обнаруживает своих свойств.
Например, молекула этилендиамина имеет 2 атома азота, имеющих по паре электронов, поэтому они способны образовывать 2 ковалентные связи по донорно-акцепторному механизму. При взаимодействии с ионами меди молекулы этилендиамина могут образовывать хелатные комплексы определенного цвета.
Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2 H2O
По типу внутрикомплексных соединений построены многие полиатомные молекулы ферментов, в которых атомами комплексообразователями атомы Fe, Zn, Co, Mn, Cu, Mo.
Примеры хелатных комплексов:
Ферменты пероксидазы – катализируют ОВ процессы, идущие в присутствии H2O2;
Ферменты каталазы – обеспечивают быстрое расщепление H2O2;
Ферменты карбопептидазы – катализируют гидролитическое отщепление концевых кислотных остатков в белках и пептидах;
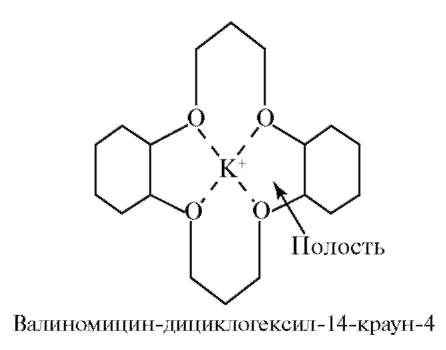
Макроцикликлические КС - координационные соединения, образованные за счёт включения комплексообразователя во внутрициклическое пространство макроциклических лигандов. К макроциклическим лигандам обычно относят моно- и полициклические молекулы, имеющие не менее 12 атомов в цикле и не менее трёх атомов и групп, потенциально способныхкоординироваться с комплексообразователем. (Рис. Комплекс валиномицина с ионом K+)
Вопрос №37. Биологическая роль КС. Металлоферменты, понятие о строении их активных центров. Химические основы применения КС в фармации и медицине.
В организме человека все металлы, кроме щелочных и, частично, щелочноземельных, находятся в виде прочных хелатных комплексов с биолигандами: белками, аминокислотами, витаминами, гормонами и другими биоактивными соединениями. Важнейшими являются комплексы с белками. К ним относятся многочисленные металлоферменты, а также гемоглобин (комплекс железа с порфином) и хлорофилл (комплекс магния).
Сбалансированные потоки металлов и лигандов в биосистемах обуславливают металло-лигандный гомеостаз. Его нарушение приводит к различным заболеваниям. Например, при недостатке железа развивается анемия, при его избытке — сидероз. Недостаток кальция приводит к остеопорозу, а его избыток в организме человека способствует развитию катаракты, атеросклероза, а также обызвествлению костной ткани.
Для коррекции металло-лигандного гомеостаза используются:
комплексоны, связывающие токсичные металлы, и выводящие их из организма человека;
комплексные соединения. Так, комплексы платины (например, [Pt(NH3)2Cl2]), применяются как противоопухолевые препараты. Комплексы золота (Na3[Au(S2O3)2]) используются для лечения артритов и туберкулеза. Тетацин находит широкое применение при отравлениях тяжелыми металлами.
Главную роль в жизнедеятельности живых организмов играют бионеорганические соединения с макроциклическими лигандами. В таких лигандах донорные атомы связаны в единое кольцо – цикл.
Наиболее распространены тетрадентатные макроциклы – порфирины. Лигандами являются атомы азота, которые располагаются по углам квадрата и жестко скоординированы в пространстве. Поэтому они образуют прочные координационные соединения даже с катионами щелочно - земельных металлов. Например, если в качестве центрального атома выступает ион магния, то в результате образуется активный центр хлорофилла, а если используются ионы Fe2+, образуется активный центр гемоглобина.
Порфириновые комплексы железа и кобальта входят в состав гемоглобина, каталазы, цитохромов, витамина В12. Все эти комплексы имеют октаэдрическую конфигурацию.
Дефицит этих веществ в организме приводит к серьезным заболеваниям.
Комплексообразование имеет большое значение для многих биологических процессов. В виде аквакомплексов находятся в крови, лимфе и тканевых жидкостях ионы щелочных и щелочноземельных металлов, выполняющих в организме важные и многообразные физиологические функции. Ионы d – элементов в результате высокой комплексообразующей способности находятся в организме исключительно в виде комплексов с белками и входят в состав гормонов, ферментов, витаминов и других жизненно важных соединений. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов - например витамин В12 , участвующий в процессах кроветворения, является комплексом кобальта.
Токсические свойства некоторых веществ обусловлены их высокой комплексообразующей способностью. Например, токсическое действие на организм цианидов и оксида углерода объясняется их способностью образовывать прочные комплексы с катионами железа. Цианиды блокируют атомы железа, входящие в состав дыхательного фермента цитохромоксидазы, в результате прекращается клеточное дыхание. Оксид углерода (СО) связывает железо гемоглобина, вследствие этого гемоглобин утрачивает способность осуществлять транспорт кислорода.
В медицинской практике при лечении многих заболеваний в качестве лекарственных препаратов используются соединения меди, серебра, цинка, кобальта, хрома, золота, платины, ртути и др.
Вопрос №38. Общая характеристика. Особенности положения в ПСЭ, реакции с кислородом, галогенами, металлами, оксидами.
s – Элементы расположены в главных подгруппах I и II-группах ПСЭ Менделеева. Электронная конфигурация соответственно ns1, ns2. Эти элементы типичные металлы, обладают блеском, электро- и теплопроводностью, очень активны в химическом отношении. Исключением является водород. Он занимает особое место и отличается не только по физическим, но и по химическим свойствам. Металлы IА-подгруппы называются щелочными, а IIА- щелочно-земельными. По группе сверху вниз происходит увеличение радиусов атомов элементов, уменьшение энергии ионизации, энергии сродства к электрону и электроотрицательности; увеличение металлических, основных и восстановительных свойств. Легкость перехода в состояние катиона обуславливает образование, как правило, соединений с ионным типом связи.
Щелочные металлы
Характерная степень окисления +1.
Несмотря на единственную степень окисления с кислородом ЩеМе образуют несколько бинарных соединений – пероксиды, надпероксиды, озониды. Объясняется это тем, что относительно большие однозарядные ионы обладают малым поляризующим действием и не дестабилизируют молекулярные ионы кислорода.
O2 + 2 Na= Na2O2 пероксид
O2 + K= KO2 надпероксид
O2 + Rb= RbO3 озонид.
Энергично щелочные металлы реагируют с галогенами, особенно с хлором и фтором, образуя галогениды МеГ:
2Na(ТВ) + F2(Г) = 2NaF(ТВ)
2К(т) + Cl2(г) = 2КCl(Т).
С другими металлами щелочные металлы образуют сплавы и интерметаллиды.
2Na + K = Na2K.
Щелочноземельные металлы
Характерная степень окисления +2.
С кислородом:
2 Be + O2 = 2 BeO
2 Ва + О2 = 2 ВаО.
С галогенами:
Сa + Cl2 = CaCl2.
Вопрос №39. Вода как важнейшее соединение водорода, ее физические и химические свойства. Аквакомплексы и кристаллогидраты. Дистиллированная и апирогенная вода, их получение и применение в фармации. Природные и минеральные воды.
H2O – одно из самых важных соединений водорода. Все важные процессы в организмах человека и животных, а также растений протекают в водной среде.
Физические свойства: физические константы, характеризующие воду, приняты как эталон для сравнения свойств других веществ. Т(кип.) (Н2О) = +1000С, Т(пл.) = 00С; масса 1 мл воды при 40С (температуре её максимальной плотности) составляет 1 г; теплота, необходимая для нагревания 1 г воды на 10С, равна 1 кал.
Химические свойства: молекула воды – трёхатомна, межъядерные расстояния О – Н составляют 0,096 нм, валентный угол Н – О – Н равен 104,50, средняя энергия каждой связи О – Н равна 464,1 кДж, степень ионности каждой связи примерно 0,3.
Электронное строение молекулы воды характеризуется четырьмя гибридными орбиталями (sp3- гибридизация) : двумя орбиталями связей О – Н и двумя орбиталями двух неподелённых электронных пар кислородного атома.
Кислотно-основные реакции:
Вода обладает амфотерными свойствами. Это означает, что она может выступать как в роли кислоты, так и в роли основания. Её амфотерные свойства обусловлены способностью воды к самоионизации:
Н2О ↔ Н+ + ОН‾.
Это позволяет воде быть, с одной стороны, акцептором протона:
HCl + H2O ↔ (H3O)+ + Cl‾,
а с другой стороны – донором протона:
NH3 + H2O ↔ NH4+ + ОН ‾.
Окисление и восстановление:
Вода обладает способностью выступать как в роли окислителя, так и в роли восстановителя. Она окисляет металлы, расположенные в электрохимическом ряду напряжений до водорода. Например:
2Na + 2H2O = H2↑ + 2NaOH
H2O (пар) + Mg = Mg(тв.) + Н2
Восстановителем вода может быть в реакциях с сильными окислителями:
F2 + H2O = 2HF + O (O2, O3, H2O2, F2O);
2Cl2 + 2H2O = 4HCl + O2 (t).
Кроме того, вода является важным восстановителем в биохимических процессах. Например, некоторые стадии цикла лимонной кислоты включают окисление воды:
2Н2О → О2 + 4Н+ + 4е‾.
Этот процесс электронного переноса имеет также большое значение в восстановлении органических фосфатных соединений при фотосинтезе. Цикл лимонной кислоты и фотосинтез представляют собой сложные процессы, включающие ряд последовательно протекающих химических реакций. В обоих случаях процессы электронного переноса, происходящие в них, ещё не полностью выявлены.
Гидратация
Молекулы воды способны сольватировать катионы и анионы. Этот процесс называется гидратацией. Гидратация может осуществляться без разрушения молекул воды или с разрушением молекул воды.
Гидратация без разрушения молекул воды приводит к образованию гидратов. Она обусловлена электростатическими и ван-дер-ваальсовыми взаимодействиями и иногда водородной связью. Наиболее изучена гидратация ионов. Гидратация молекул изучена недостаточно.
Гидратация с разрушением молекул воды широко распространена в неорганической и органической химии. Гидратация оксидов элементов приводит в зависимости от их природы к образованию щелочей, кислот, или амфотерных гидроксидов.
Гидратация органических соединений обычно осуществляется в растворах в присутствии щелочных или кислотных катализаторов, или в паровой фазе при повышенных температурах и давлениях и в присутствии катализаторов.
Аквакомплексы представляют собой ионы или молекулы, в которых лигандами служат молекулы воды. В водных растворах солей почти все ионы существуют в виде акваионов, например, [Be(H2O)4]2+, [Al(H2O)6]3+, [Cr(H2O)6]3+ и т.д. При кристаллизации таких солей из водных растворов вода остается связанной с комплексообразователем: [Be(H2O)4]SO4, [K(H2O)6][Al(H2O)6](SO4)2, [Cr(H2O)6]Cl3.
К аквакомплексам относятся многие кристаллогидраты, например, [Al(H2O)6]Cl3 (иначе – AlCl3 . 6 H2O), [Cr(H2O)6](NO3)3 (иначе – Cr(NO3)3 . 6 H2O).
У некоторых кристаллогидратов часть молекул воды входит во внутреннюю, а остальные находятся во внешней сфере и связываются с внешнесферными ионами. Например, пентагидрат сульфата меди(II) и гептагидрат сульфата никеля(II) содержат аквакомплексы – катион тетрааквамеди(II) и катион гексаакваникеля(II) и слабо связанную внешнесферную молекулу воды, которая объединяет катионы и анионы посредством водородных связей.
В фармацевтической промышленности используют дистиллированную воду для инъекций, как растворитель лекарственных форм. Вода находит применение в гидротерапевтических процедурах – обливание, обтирание, грелки, припарки.
Этапы получения дистиллированной воды:
· нагрев исходной воды (после ее предварительной обработки, если в этом есть необходимость) до кипения и парообразования;
· поступление пара в конденсатор и конденсация;
· поступление конденсата в водоприемник: хранение и использование путем подачи через систему трубопроводов или иных механизмов доставки на рабочие места.
Апирогенная вода – вода, не содержащая веществ, вызывающих при введении в организм повышения температуры тела и другие нежелательные реакции.
Методы разрушения пирогенов и предотвращения пирогенности:
· температурное воздействие, при котором разрушаются все органические вещества (пар под давлением — 5 часов, сухожаровой шкаф при t=180 оC — 4 часа, при t=200°C — 45 минут);
· фильтрация растворов для инфузий через асбестовые фильтры;
· интенсивное воздействие ультразвуком;
· сорбция активированным углем;
· обработка ферментами ();
· химический метод (использование горячего подкисленного 1% раствора перманганата калия для обработки стеклянных трубок дистилляторов, сосудов для сбора дистиллята с последующим отмыванием от раствора).
Минеральные (лечебные) воды - природные подземные воды, оказывающие на организм человека лечебное действие, обусловленное повышенным содержанием полезных биологически активных компонентов, особенностями газового состава или общим ионно-солевым составом воды.
Природная вода – раствор многих веществ в воде. В природной воде содержатся соли, газы, органические вещества и т.д. Качество природной воды определяют путем химического анализа. Основными характеристиками природной воды являются ее соленость и жесткость.
Вопрос №40. Характеристика и реакционная способность соединений водорода с другими распространенными элементами: кислородом, азотом, углеродом, серой. Особенности поведения водорода в соединениях с сильно и слабополярными связями. Ион водорода, ион оксония, ион аммония.
При нагревании водород проявляет свойства сильного восстановителя, реагирует с неметаллами, оксидами металлов:
Н2 + Са = СаН2; Н2 + Cl2 = 2HCl; Н2 + S = H2S; Н2 + N2 =2NH3;
Н2 + 2C = C2H2; 2Н2 + C = CH4; 4H2 + CO2 = CH4 + 2H2O;
Н2 + CuO = Cu + H2O; H2 + Ag2SO4 = 2Ag + H2SO4 (t=2000C)
В роли окислителя водород выступает в реакциях с активными металлами. Например: Н2 + Са = СаН2. В этих реакциях образуются гидриды металлов, в которых водород проявляет степень окисления -1. Гидриды щелочных металлов по внешнему виду и физическим свойствам напоминают галогениды соответствующих металлов.
Гидриды реагируют с водой, кислотами, кислородом, хлором, оксидами неметаллов:
LiH + H2O = LiOH + H2; LiH + HCl = LiCl + H2; LiH + O2 = 2LiOH;
LiH + Cl2 = LiCl + HCl; 2LiH + 2SO2 = Li2SO4 + H2S.
В настоящее время известны гидриды для большинства химических элементов. По своим свойствам и строению они могут быть разделены на четыре группы:
1. Газообразные или легколетучие (NH3, (BH3)2, CH4 и др.).
2. Солеобразные (NaH, CaH2 ).
3. Полимерные [(BeH2)x; (AlH3)x],
4. Металлообразные. Эти соединения не имеют постоянного состава и могут рассматриваться как твёрдые растворы водорода в металлах. Так, например, водород растворяется в палладии, платине и др. металлах.
Водород, несмотря на высокий ионизационный потенциал, ведёт себя как довольно сильно электроположительный элемент. Водород проявляет склонность к образованию малополярных ковалентных связей и, в соответствии с этим, легколетучих соединений. Вследствие летучести этих соединений равновесия реакций с их участием смещены в сторону их образования. На этом основана большая восстановительная способность водорода. Вследствие неполярности и большой прочности молекулы Н2 (Нодис = 436 кДж/моль) при комнатной температуре водород мало активен и взаимодействует только с фтором.
Молекулярный ион водорода — простейший двухатомный ион H2+, образуется при ионизации молекулы водорода. В молекулярном ионе H2+ образуется одноэлектронная химическая связь с расстоянием dHH = 1,07Å. Одноэлектронная связь менее прочна, чем обычная двухэлектронная связь в нейтральной молекуле водорода.
Н3О+ (ион гидроксония) — комплексный ион, соединение протона с молекулой воды. Содержится в желудочном соке, проявляет противомикробное и каталитическое действие. При его участии гидролизуются белки, полисахариды.
Аммоний-ион (NH4+) - в природных водах накапливается при растворении в воде газа - аммиака (NH3), образующегося при биохимическом распаде азотсодержащих органических соединений. Растворенный аммиак поступает в водоем с поверхностным и подземным стоком, атмосферными осадками, а также со сточными водами.
Наличие иона аммония в концентрациях, превышающих фоновые значения, указывает на свежее загрязнение и близость источника загрязнения.
Вопрос №41. Общая характеристика. Изменение свойств элементов IIA группы в сравнении с IA. Характеристики катионов. Ионы s–металлов в водных растворах; энергия гидратации ионов.
s-Элементы IIA группы – это бериллий, магний и щелочно-земельные металлы – кальций Са, стронций Sr, барий Ва и радиоактивный радий Ra.
В свободном состоянии эти металлы представляют собой серебристо-белые вещества, более твёрдые, чем щелочные металлы, со сравнительно высокими температурами плавления. Все эти элементы, кроме бериллия, обладают ярко выраженными металлическими свойствами.
Атомы элементов IIA группы проявляют в своих соединениях одну степень окисления +2.
Гидриды щелочноземельных металлов белые кристаллические вещества с ионной кристаллической решеткой, анион Н‾. Гидриды Ве и Mg твёрдые полимерные соединения. Термическая устойчивость гидридов понижается от Ва к Ве (ВеН2 плавится при 1250С, а ВаН2 – при 12000С). Гидриды группы металлов IIA, как и гидриды металлов группы IA, сильные восстановители.
С водой активно реагируют щелочноземельные металлы (Са, Sr, Ba), реакции идут при обычной температуре. Например:
Са + 2Н2О = Са(ОН)2 + Н2↑
Магний реагирует при нагревании, а бериллий имеет поверхность, покрытую прочной плёнкой оксида и, поэтому, с водой не реагирует даже при высоких температурах (хотя термодинамически это возможно).
Активность взаимодействия с водой в ряду Mg – Ca – Sr – Ba – Ra возрастает.
Ионы K+, Na+ имеют устойчивую конфигурацию внешнего энергетического уровня, окислительно-восстановительные реакции для них не характерны. NH4+ – сложный ион, свойства которого сходны со свойствами К+, и только сильные окислители (хлорная вода и др.) могут окислить его до свободного азота.
Ионы K+, Na+, NH4+ бесцветны, окраска их соединений определяется только окраской аниона.
Ионы K+, Na+ гидролизу не подвергаются, в результате гидролиза по катиону NH4+ происходит образование слабого основания и подкисление раствора. Соли аммония термически нестойки.
Катионы первой аналитической группы не проявляют способности к комплексообразованию, могут входить во внешнюю сферу комплексных соединений. Характерными реакциями этих ионов являются реакции обмена.
Для катионов K+, Na+ свойственны реакции окрашивания пламени.
Все металлы, образующие катионы этой группы, являются S-элементами второй группы ПСМ (ns2) и образуют соединения со степенью окисления +2. В окислительно-восстановительных процессах не участвуют.
Гидроксиды этих элементов Ca(OH)2, Sr(OH)2, Ba(OH)2 являются сильными основаниями, в воде растворимость их увеличивается от Ca(OH)2 к Ba(OH)2. Получить их можно непосредственным растворением в воде оксидов или самих металлов.
Поскольку основные свойства здесь выражены сильно, соли металлов II группы, образованные сильными кислотами, не подвергаются гидролизу и имеют в растворе реакцию, близкую к нейтральной (рН6). Следовательно, гидролизу могут подвергаться только растворы солей слабых кислот, которые имеют щелочную реакцию.
Катионы Ca2+, Sr2+, Ba2+ как типичные S-элементы не образуют устойчивых комплексов.
Ионы Ca2+, Sr2+, Ba2+ имеют законченные 8-электронные оболочки. В водных растворах эти ионы бесцветны.
В ряд активности металлов помещен водород, потому что это единственный неметалл, разделяющий с металлами их общее свойство — находиться в водных растворах в виде положительных ионов (хотя и гидратированных).
Металлы в ряду стандартных электродных потенциалов расположены по убыванию (ослаблению) их восстановительной способности в растворах или по возрастанию (усилению) окислительной способности их ионов в растворах. В этом ряду каждый предыдущий металл вытесняет из растворов солей все последующие.
Металлы, расположенные в ряду до водорода, вытесняют его из разбавленных кислот (кроме азотной). А щелочные и щелочноземельные — вытесняют водород даже из воды.
Энергия гидратации (ЭГ) — энергия (Н), выделяющаяся при взаимодействии молекул воды с ионами растворяющегося вещества. Является важнейшей величиной в энергии, обеспечивающей возможность растворения ионных или диссоциирующих на ионы соединений и определяющей теплоту растворения (L). Значение ЭГ состоит и в нередко преобразующей роли характера связей в соединениях, образующихся при кристаллизации из водных растворов, становящихся более ионными в сравнении с кристаллизацией из расплавов. ЭГ играет важнейшую роль в явлениях катионного обмена. Чем выше ЭГ иона при прочих равных условиях (валентности, концентрации), тем охотнее он переходит в раствор в обмен на катионы с меньшей ЭГ. До последнего времени представлялось, что ЭГ есть результат чисто электростатического взаимодействия как анионов, так и катионов с дипольными зарядами молекул воды. Поэтому величина ЭГ соединений (H) вычислялась на основе представлений об энергии кристаллической решетки (U) с поправкой на теплоту растворения (L); H = U + L. Из таких ЭГ соединений вычислялись и ЭГ ионов, сводившихся в таблицы. Однако на основе новой системы ионно-атомных радиусов механизм взаимодействия катионов с молекулами воды представляется иным. По Лебедеву, между катионами и молекулами воды связь, вероятно, донорно-акцепторная и только между анионами и молекулами воды скорее электростатическая.
42. Взаимодействие металлов с кислородом, образование оксидов, пероксидов, гипероксидов (супероксидов, надпероксидов). Взаимодействие с водой этих соединений. Гидроксиды щелочных и щелочно-земельных металлов; амфотерность гидроксида беррилия. Гидриды щелочных и щелочно-земельных металлов и их восстановительные свойства.
На воздухе все щелочные металлы быстро покрываются тёмно-серым налётом из оксидов, только у Li появляется зеленовато-чёрная плёнка Li2N.
Склонность к окислению возрастает от лития к Fr, причём Rb, Cs и Fr окисляются уже с воспламенением. Поэтому щелочные металлы хранят под слоем обезвоженного парафинового или вазелинового масла. Кислород окисляет все щелочные металлы, но если литий превращается только в Li2O, то остальные щелочные металлы превращаются в Ме2О2 или в МеО2:
4Li(тв) + О2(г) = 2Li2O(тв);
2Na(тв) + О2(г) = Na2O2 (ТВ) ;
К(ТВ) + О2(г) = КО2 (ТВ).
Все оксиды, кроме Li2O, получают косвенным путём. Например:
Na2O2 + 2Na = 2Na2O;
2NaOH + 2Na = 2Na2O + H2.
Оксиды щелочных металлов – кристаллические вещества, очень реакционноспособные, с ярко выраженными основными свойствами, усиливающимися от Li к Cs.
Оксиды щелочных металлов взаимодействуют с амфотерными и кислотными оксидами, растворами кислот. При этом образуются соли, например:
Li2O + Al2O3 = 2LiAlO2 (сплавление)
K2O + CO2 = K2CO3 (t=4000C)
Na2O + 2HCl (разб.) = 2NaCl + H2O.
Оксиды щелочно-земельных металлов – твёдые белые тугоплавкие вещества. Они могут быть получены термическим разложением карбонатов, нитратов, гидроксидов. Например:
МеСО3 = МеО + СО2↑.
Оксиды, кроме ВеО, реагируют с водой; MgO реагирует с горячей водой:
МеО + Н2О = Ме(ОН)2
Оксиды щелочно-земельных металлов проявляют свойства основных оксидов:
ВаО + 2HCl = BaCl2 + H2O,
CaO + CO2 = CaCO3,
CaO + SiO2 = CaSiO3.
ВеО – амфотерный оксид, белое тугоплавкое, термически устойчивое вещество. При нагревании взаимодействует с кислотами и щелочами, кислотными и основными оксидами:
ВеО + 2НCl(конц.) = ВеCl2 + H2O,
ВеО + H2SO4 (конц.) = ВеSO4 ↓+ H2O
ВеО + 2NaOH(конц. Гор.) + H2O = Na2[Be(OH)4],
ВеО + 2Na2O = Na4BeO3 (t = 5000C)
2ВеО + SiO2 = Be2SiO4 (фенакит; t= 16000C)
2 ВеО + Al2O3 = (BeAl2)O4 (хризоберилл; t = 14000C)
ВеО – токсичен, раздражает дыхательные пути, при попадании в лёгкие вызывает хроническое заболевание бериллиоз (лёгочная недостаточность).
Пероксид натрия образуется при сгорании натрия на воздухе. Пероксиды калия, рубидия и цезия Ме2О2 получают косвенным путём, они менее устойчивы, чем Na2O2.
К, Rb, Cs при сгорании образуют надпероксиды МеО2 (КО2, RbO2, CsO2).
Пероксиды и надпероксиды щелочных металлов сильные окислители, например:
Na2O2(ТВ) + 2СО2 = 2Na2CO3(ТВ) + О2↑
2КO2 + S = K2SO4.
Пероксиды и надпероксиды легко разлагаются водой, например:
Na2O2 + 2H2O = 2NaOH + H2O2;
2KO2 + 2H2O = 2KOH + H2O2 + O2.
Гидроксиды щелочных металлов Ме(ОН) – бесцветные кристаллические вещества, хорошо растворимые в воде (исключая LiOH), являются сильными электролитами (существуют в воде только в виде ионов). В ряду Li – Cs растворимость гидроксидов и их основные свойства усиливаются.
Гидроксиды активно поглощают из воздуха СО2 и Н2О (поэтому всегда содержат примеси – карбонаты).
Гидроксиды проявляют все характерные свойства оснований:
NaOH + HCl = NaCl + H2O,
NaOH + CO2 = NaHCO3,
2NaOH + ZnO = Na2ZnO2 + H2O (сплавление),
NaOH + Al(OH)3 = Na[Al(OH)4],
2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl,
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O.
В промышленности гидроксиды получают электролизом водных растворов их солей, например:
2NaCl + 2H2O ----------------→ H2(катод) + Cl2(анод) + 2NaOH.
Твёрдые гидроксиды и их концентрированные водные растворы разрушают живые ткани вследствие обезвоживания и щелочного гидролиза белков. Поэтому работа с ними требует мер предосторожности (резиновые перчатки, очки).
Элементы группы IIA образуют гидроксиды Ме(ОН)2. Это бесцветные, тугоплавкие, твёрдые вещества. Они являются более слабыми основаниями, чем гидроксиды щелочных металлов. Основные свойства гидроксидов усиливаются от Ве(ОН)2 к Ва(ОН)2. Гидроксиды бериллия и магния – слабые основания, плохо растворимые в воде. Ве(ОН)2 склонен к полимеризации.
Гидроксиды щелочно-земельных металлов являются сильными основаниями. Они активно взаимодействуют с кислотами, кислотными оксидами. Например:
Ва(ОН)2 + Н2SO4 = BaSO4 + 2H2O↓,
Ca(OH)2 + CO2 = CaCO3↓.
При нагревании гидроксиды разлагаются. Например:
Ме(ОН)2 = МеО + Н2О↑.
Гидроксид бериллия проявляет амфотерные свойства, реагирует с разбавленными кислотами, щелочами в растворе и при сплавлении:
Be(OH)2 + 2HCl(разб.) = BeCl2 + 2H2O,
Be(OH)2 + 2NaOH(конц.) = Na2[Be(OH)4],
Be(OH)2 + 2NaOH = Na2BeO2 + 2H2O (t = 3000C).
Гидриды – бесцветные кристаллические вещества с ионной решеткой типа NaCl, анионом является Н‾. Гидриды ряда NaH – CsH подвергаются термической диссоциации не плавясь. Гидриды сильные восстановители: реагируют с кислотами, кислородом, водой. Например:
NaH + HCl = NaCl + H2↑,
2NaH + O2 = 2NaOH
NaH + H2O = NaOH + H2.
С водородом металлы образуют гидриды МеН2. Например:
Са + Н2 = СаН2.
Бериллий с водородом не взаимодействует.
Гидриды щелочноземельных металлов белые кристаллические вещества с ионной кристаллической решеткой, анион Н‾. Гидриды Ве и Mg твёрдые полимерные соединения. Термическая устойчивость гидридов понижается от Ва к Ве (ВеН2 плавится при 1250С, а ВаН2 – при 12000С). Гидриды группы металлов IIA, как и гидриды металлов группы IA, сильные восстановители.
Вопрос №43. Взаимодействие щелочных и щелочно-земельных металлов с водой и кислотами. Соли щелочных и щелочно-земельных металлов: сульфаты, галогениды, карбонаты, фосфаты.
Щелочные металлы энергично взаимодействуют с большинством неметаллов, разлагают воду; на холоде бурно реагируют с разбавленными растворами кислот.
2Na + 2HCl → 2NaCl + H2.
Все щелочные металлы реагируют с водой, образуя гидроксиды МеОН:
2Ме(т) + 2Н2О(ж) = 2МеОН(ж) + Н2(Г).
С водой активно реагируют щелочноземельные металлы (Са, Sr, Ba), реакции идут при обычной температуре. Например:
Са + 2Н2О = Са(ОН)2 + Н2↑
Магний реагирует при нагревании, а бериллий имеет поверхность, покрытую прочной плёнкой оксида и, поэтому, с водой не реагирует даже при высоких температурах (хотя термодинамически это возможно).
Активность взаимодействия с водой в ряду Mg – Ca – Sr – Ba – Ra возрастает.
Все металлы растворяются в кислотах:
Ca + 2HCl = CaCl2 + H2
Mg + H2SO4(разб.) = MgSO4 + H2.
Щелочные металлы образуют соли с большинством известных кислот. С многоосновными кислотами образуют средние соли (MeCO3, MeSO3, MeSO4, Me3(PO4)3 и др.) и кислые (MeHSO3, MeHSO4, MeH2PO4, Me2HPO4 и др.).
Кислых солей щелочных металлов известно очень много, а у других металлов они встречаются редко. Склонность к образованию таких солей и их термическая устойчивость увеличивается в ряду Li – Cs.
Большинство солей щелочных металлов хорошо растворимы в воде. Исключение составляют соли лития.
Все соли щелочных металлов характеризуются высокими температурами плавления, хорошо проводят электрический ток их расплавы и растворы.
В водных растворах соли слабых кислот пордвергаются гидролизу. Например:
Na2CO3 + H2O ↔ NaHCO3 + NaOH;
K2S + H2O ↔ KHS + KOH.
Летучие соединения щелочных металлов окрашивают пламя в характерные цвета: натрий – желтый, калий – фиолетовый и т.д.).
Элементы IIA подобно щелочным металлам образуют соли со всеми кислотами. Многие соли растворимы. Малорастворимы или практически нерастворимы фториды и карбонаты, а также сульфаты кальция, стронция и бария. С ростом порядкового номера элемента растворимость солей понижается.
Растворимые соли бериллия и магния подвергаются гидролизу:
ВеCl2 + H2O ↔ BeOHCl + HCl,
Mg(NO3)2 + H2O ↔ MgOHNO3 + HNO3.
Ионы элементов группы IIA, как и ионы щелочных металлов, не образуют устойчивых комплексных соединений. Более склонны к образованию комплексных соединений бериллий и магний. В ряду Be2+ - Mg2+- Ca2+ - Sr2+ - Ba2+ прочность комплексных соединений уменьшается.
Вопрос №44. Ионы щелочных и щелочно-земельных металлов как комплексообразователи. Ионофоры и их роль в мембранном переносе калия и натрия. Ионы магния и кальция как комплексообразователи. Реакция с комплексонами (на примере натрия этилендиаминтетраацетата).
Комплексные соединения с ионом щелочного металла в качестве комплексообразователя известны лишь для лития. Напротив, весьма обычны комплексные производные, у которых ионы щелочного металла располагаются во внешней сфере. Многие из подобных комплексов отличаются устойчивостью, возрастающей по ряду Li–Cs.
Ионы щелочных и щелочноземельных металлов входят в состав комплексных соединений как комплексообразователи, в живых организмах эти металлы образуют комплексы с белками или другими биолигандами. Например, Mg2+ играет роль комплексообразователя в одном из важнейших соединений растительного мира – пигмента хлорофилла.
Ионофоры – органические вещества, осуществляющие перенос катионов щелочных и щелочно-земельных металлов или NH4+ через биологические мембраны. К ионофорам относятся многие антибиотики (валиномицин, нактины, энниатины и др.).
В основе действия ионофоров лежит их способность образовывать комплексы с транспортируемыми катионами. Механизм переноса ионов обычно включает следующие стадии. Вначале ионофор, расположенный на поверхности мембраны, взаимодействует с катионом, находящимся в водной фазе с одной стороны мембраны. Образующийся комплекс внедряется в мембрану и перемещается к другой её стороне под действием электрического поля или градиента концентрации, после чего комплекс диссоциирует. Катион вновь переходит в водную фазу (принцип подвижного переносчика).
Комплексообразующая способность катиона магния больше, чем у катиона кальция, но и Са2+, в отличие от катионов К+ и Na+, образует достаточно прочные комплексы с аминокислотами и белками. Причем катион Mg2+ более жесткий комплексообразователь, а Са2+ - более мягкий, поэтому Mg2+ больше "любит" кислород- и фосфатсодержащие лиганды, а Са2+ -кислород- и азотсодержащие лиганды. Именно склонность к комплексообразованию является характерной особенностью этих катионов в условиях организма.
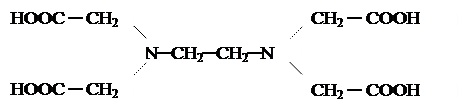
Для живых систем характерны комплексы, содержащие полидентантные органические лиганды типа комплексонов. Примером подобных веществ может служить синтетический препарат трилон Б – двуводный кристаллогидрат двунатриевой соли ЭДТА (этилендиаминтетрауксусной кислоты):
Вопрос №45. Биологическая роль s-элементов-металлов в минеральном балансе организма. Макро- и микроs-элементы. Поступление в организм с водой. Жесткость воды, единицы ее измерения, пределы, влияние на живые организмы и протекание реакций в водных растворах, методы устранения жесткости. Соединения кальция в костной ткани, сходство ионов кальция и стронция, изоморфное замещение (проблема стронция-90).
Щелочные металлы
Литий : биологическая роль лития как микроэлемента пока до конца не выяснена. Доказано, что на уровне клеточных мембран ионы лития конкурируют с ионами натрия при проникновении в клетки. Некоторые соединения лития оказывают положительное влияние на больных маниакальной депрессией.
Натрий: натрий является основным внеклкеточным ионом. Ионы натрия играют важную роль в обеспечении постоянства внутренней среды человеческого организма, участвуют в поддержании постоянного осмотического давления биожидкости (биологического гомеостаза). В виде противоионов в соединениях с фосфорной кислотой и органическими кислотами натрий обеспечивает кислотно - основное равновесие организма. Ионы натрия участвуют в регуляции водного обмена и влияют на работу ферментов. Вместе с ионами магния, калия, кальция, хлора ион натрия участвует в передаче нервных импульсов и поддерживает нормальную возбудимость мышечных клеток.
Калий : ионы К+ играют важную роль в физиологических процессах – сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, обменных реакциях. Ионы К+ являются важными активаторами ферментов, находящихся внутри клетки. Совместно с катионом натрия принимает участие в биокатализе, образуя смешенные комплексы типа фермент – катион – субстрат.
Рубидий и цезий: они постоянно содержаться в организме, но биологическая роль их не выяснена.
Щелочноземельные металлы
Бериллий : биологическая роль его изучена недостаточно. Известно, что соединения бериллия токсичны и вызывают ряд заболеваний (бериллиевый рахит, бериллиоз и др.). Отрицательное влияние иона Ве2+ на физиологические процессы можно объяснить способностью его образовывать прочные связи с биолигандами и хорошей растворимостью фосфатов бериллия.
Магний: ион магния, так же как и ион калия, является внутриклеточным катионом. Ионы Mg2+ играют важную биологическую роль в организме человека. Он является активным катализатором ферментативных процессов.
Кальций : в крови и лимфе кальций находится как в ионизированном, так и в неионизированном состоянии – в соединениях с белками, углеводами и др. Свертывание крови происходит при наличии ионизированного Са2+. Ионы Са2+ принимают активное участие в передаче нервных импульсов, сокращении мышц, регулировании работы сердечной мышцы. Кальция не используется практически внутри клетки, поэтому он выступает в качестве строительного материала в организме. Скелет – основное хранилище кальция в организме.
Стронций: важную роль играет стронций в процессах костеобразования (остеогенеза). Определение исодержания стронция в плазме и эритроцитах используют для диагностики и прогнозирования заболеваний лейкозом. Радиактивные изотопы 89Sr и 90Sr применяют в лучевой терапии при лечении костных опухолей.
Барий: биологическая роль его пока не выяснена. Ионы бария токсичны для организма.
Радий : примесный микроэлемент, концентрируется преимущественно в костной ткани.
Макро- и микроэлементы обеспечивают нормальную работу главных систем организма.
Макроэлементы. Это элементы, содержание которых в организме выше 10~2%. К ним относятся водород, кальций (является основным элементом костной ткани, а также требуется для поддержания ионного баланса организма, отвечает за активацию некоторых ферментов. Большое количество кальция находится в молочных продуктах, поэтому ежедневно в меню необходимо включать молоко, сыр, кефир, ряженку, творог.), магний (отвечает за процессы обмена углеводов, энергии, поддерживает работу нервной системы. Находится в значительном количестве в таких продуктах, как творог, орехи, ячневая крупа, овощи, горох, фасоль.) и натрий (играет большую роль в поддержании буферного баланса, кровяного давления, работы мышц и нервной системы и активации ферментов. Главными источниками натрия считают хлеб и поваренную соль.).
Микроэлементы. Это элементы, содержание которых в организме находится в пределах от 10~3 до 10~5%. К ним относятся медь (участвует в процессах кровообращения и дыхания. При ее нехватке развивается атрофия сердечных мышц. Находится в таких продуктах, как грейпфрут, мясо, творог, крыжовник, пивные дрожжи.), стронций, барий.
Макро- и микроэлементы не синтезируются в организме, они поступают с пищевыми продуктами, водой, воздухом. Степень их усвоения зависит от состояния органов дыхания и пищеварения. Обмен минеральных веществ и воды, в которой они растворены, неразделимы, а ключевые элементы депонируются в тканях, по мере необходимости извлекаются в кровь.
Жесткость воды обусловлена наличием ионов Са2+ и Mg2+. Чем выше их содержание в природной воде, тем больше её жесткость.
Количественно жесткость воды характеризуют через суммарное содержание ионов Са2+ и Mg2+, выраженное в моль/л. По жесткости все природные воды делятся на мягкие (общая жесткость менее 2 ммоль/л) и жесткие со средней степенью жесткости (2 – 10 ммоль/л) и высокой степенью жесткости (более 10 ммоль/л).
Различают общую жесткость, которая складывается из временной и постоянной жесткости.
Временная жесткость (устранимая, или карбонатная жесткость) удаляется кипячением воды. Эта жесткость вызвана присутствием в воде гидрокарбонатов Са(НСО3)2 и Mg (НСО3)2 и количественно равна концентрации ионов Са2+ и Mg2+, которая соответствует удвоенной концентрации гидрокарбонат-иона НСО3‾. При длительном кипечении воды в ней появляется осадок МеСО3 и одновременно выделяется газ СО2:
Сa(HCO3)2 = CaCO3↓ +CO2↑ +H2O,
Mg(HCO3)2 = MgCO3↓ +CO2↑ +H2O,
Поэтому карбонатную жесткость называют временной жесткостью.
Постоянная жесткость (неустранимая, или некарбонатная) сохраняется при кипячении воды. Количественно она равна концентрации ионов Са2+ и Mg2+ за вычетом временной жесткости. Обычно постоянную жесткость характеризуют содержанием CaSO4 и MgSO4, поэтому её называют сульфатной жесткостью. Эту жесткость устраняют введением в воду химических реагентов (карбонат натрия, гидроксид кальция, ортофосфат натрия, тетраборат натрия и др.). Например:
Сa(HCO3)2 + Сa(OH)2 = 2CaCO3↓ + 2H2O,
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4,
3CaSO4 + 2Na3PO4 = Ca3(PO4)2↓ + 3Na2SO4.
Ортофосфаты менее растворимы, чем карбонаты, поэтому лучшее умягчение достигается с помощью реагента Na3PO4.
Современный способ умягчения воды основан на использовании ионообменных смол – ионитов (катионитов и анионитов). Через трубчатый обменник, заполненный смолой в Na+-форме пропускают жесткую воду, при этом ионы Са2+ и Mg2+, эквивалентно замещают ионы Na+ в смоле. Ионит периодически регенерируют, промывая концентрированным раствором хлорида натрия.
Умягчение воды при стирке проводят с помощью комплексообразующих ионитов (полифосфаты натрия, метафосфаты натрия и др.). Ионы Са2+ и Mg2+ связываются в устойчивые комплексы и становятся инертными по отношению к мылу.
В некоторых случаях проводят полное обессоливание воды. Для этого воду подвергают перегонке (дистилляции). Другой способ обессоливания – последовательная обработка воды с помощью катионита и анионита. При пропускании через катионитный фильтр ионы металлов в растворе заменяются на ионы Н+, а при пропускании воды через анионитный фильтр анионы кислот в растворе заменяются на ионы ОН ‾. Таким образом, в целом из воды удаляются соли, а перешедшие в воду ионы взаимно нейтрализуются: Н+ + ОН ‾ = Н2О. Периодически иониты восстанавливают, промывая их разбавленными растворами соответственно серной кислоты и гидроксидом натрия.
1.Жесткость воды неблагоприятно влияет на кожу, обусловливая ее преждевременное старение. При взаимодействии солей жесткости с моющими веществами происходит образование осадков в виде пены, которая после высыхания остается в виде микроскопической корки на человеческой коже, на волосах. Главным отрицательным воздействием этих осадков на человека является то, что они разрушают естественную 8 жировую пленку, которой всегда покрыта нормальная кожа. Из-за этого забиваются поры, появляются сухость, шелушение, перхоть. Кожа не только рано стареет, но становится аллергичной и чувствительной к раздражениям. 2. Высокая жесткость оказывает отрицательное действие на органы пищеварения. Соли жесткости, соединяясь с животными белками, находящимися в нашей пище, оседают на стенках пищевода, желудка, кишечника, мешая перистальтике, вызывая дисбактериоз, нарушая работу ферментов и отравляя организм. Постоянное употребление внутрь воды с повышенной жесткостью приводит к снижению моторики желудка, к накоплению солей в организме.
3.Больше всего от воды переполненной ионами кальция и магния страдает сердечно - сосудистая система. (Ca контролирует ритм сердца, необходим для сокращения и релаксации, в том числе и сердечной мышцы) 4.Постоянное употребление внутрь воды с повышенной жесткостью приводит к заболеванию суставов (артриты, полиартриты). В человеческом теле можно выделить семь основных типов соединения костей, обеспечивающих различную степень их подвижности. Между соединяемыми элементами находится прозрачно-желтая жидкость, называемая в медицине синовиальной. Она играет роль смазки, позволяя костям легко поворачиваться относительно друг друга в месте соединения. Если же вместо такой жидкости там оказываются неорганические минералы, поступившие с питьевой водой, и ядовитые кристаллы, то каждое такое перемещение будет даваться человеку с трудом, вызывая при этом болезненные ощущения.
5.Существует мнение, что жесткость воды приводит к образованию камней в почках и желчных путях. Интересен тот факт, что камни в почках образуются из-за недостатка кальция в пище. Научные эксперименты доказывают, что камни формируются не из кальция, усвоенного из пищи. Были проведены 9 эксперименты с использованием радиоактивных меток на кальции в пище. Когда почечные камни и шпоры позже исследовались, в них не было ни единого радиоактивного кальция. Таким образом, было доказано, что 100% почечных камней и костяных шпор строятся из кальция, выщелачиваемого из костей для нейтрализации кислотности жидких сред организма. С другой стороны, Mg является антагонистом Ca в обменных процессах. При избытке Mg увеличивается выведение Ca из организма, то есть Mg начинает вытеснять Ca из тканей и костей, что ведёт к нарушению нормального костеобразования.
В костях и зубах кальций находится в виде нерастворимого кристаллического минерала – гидроксилапатита Ca10(PO4)6(OH)2, образование которго происходит при взаимодействии ионов кальция с фосфат – ионами. В крови и лимфе кальций находится как в ионизированном, так и в неионизированном состоянии – в соединениях с белками, углеводами и др.
Так как кальций по физико-химическим характеристикам (радиус ионов, энергия ионизации, координационные числа) близок к стронцию и барию, то, как правило, ионы этих элементов являются синергистами иона кальция. Сходство в размерах ионов кальция и стронция приводит к наличию постоянной примеси стронция в организме.
Изоморфизм - это способность атомов, ионов или молекул замещать друг друга в кристаллических структурах. В результате изоморфизма образуются твердые растворы замещения.
Стро́нций-90 (англ. strontium-90) — радиоактивный нуклидхимического элемента стронция с атомным номером 38 и массовым числом 90. Образуется преимущественно при делении ядер в ядерных реакторах и ядерном оружии.
Стронций является аналогом кальция, поэтому он наиболее эффективно откладывается в костной ткани. В мягких тканях задерживается менее 1 %. За счёт отложения в костной ткани, он облучает костную ткань и костный мозг. Так как у красного костного мозга взвешивающий коэффициент в 12 раз больше, чем у костной ткани, то именно он является критическим органом при попадании стронция-90 в организм, что ведет к развитию рака крови (лейкемии), раку кости и раку груди. А при поступлении большого количества изотопа может вызвать лучевую болезнь.
Вопрос №46.Токсичность соединений бериллия. Химические основы применения соединений лития, натрия, калия, магния, кальция, бария в медицине и в фармации.
Бериллий ( Be )
Металлический бериллий и все его соединения обладают весьма высокой токсичностью, они могут вызвать острые и хронические заболевания. Пары и аэрозоль бериллия и его соединений вызывают своеобразное тяжелое поражение легких— легочный гранулематоз, который может развиваться и проявляться во время работы, а также спустя несколько лет после прекращения работы с ними.
Литий(Li)
Медицинское применение соединений лития ограничено. Соли лития (лития карбонат,
лития оксибат, литонит и др.) используются при лечении маниакально-депрессивных
психозов. В последние годы появились сведения об эффективности препаратов лития
при лечении новообразований, сахарного диабета и алкоголизма.
Натрий( Na)
Нитрит натрия также используется в медицине и ветеринарии как
сосудорасширяющее, бронхолитическое (расширяет бронхи), снимает спазмы
кишечника, используется как слабительное, а также как антидот при отравлении
цианидами.
Проводятся исследования по применению его при серповидной анемии, сердечными
приступами и ишемией сердца, аневризмами головного мозга и лёгочной гипертензии
у детей.Применяется как антицианид.
может вызвать серьёзное отравление с летальным исходом.
бромид натрия NаВг — используется в медицине и в фотографии;
— сульфит натрия Na2SO4 и тиосульфат натрия Na2SO3 — в медицине и фотографии
и т.д.
хлорид натрия NаСl (поваренная соль) — в технике, медицине, в пищевой
промышленности, для производства соды, едкого натра и др.;
Калий (К)
Бромид калия применяется в медицине и как успокаивающее средство для нервной
системы.
Перманганат калия — сильный окислитель, используется как антисептическое
средство в медицине и для лабораторного получения кислорода.
Магний ( Mg)
Магний является жизненно-важным элементом, который находится во всех тканях
организма и необходим для нормального функционирования клеток. Участвует в
большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в
сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Оксид и
соли магния традиционно применяется в медицине в кардиологии, неврологии и
гастроэнтерологии (аспаркам, сульфат магния, цитрат магния. Наиболее интересным
природным ресурсом магния является минерал бишофит). Оказалось, что магниевые
эффекты бишофита в первую очередь проявляются при транскутанном (через кожном)
применении в лечении патологии опорно-двигательного аппарата. Бишофитотерапия
использует биологические эффекты природного магния в лечении и реабилитации
широкого круга заболеваний, в первую очередь — позвоночника и суставов,
последствий травм, нервной и сердечно-сосудистой систем.
Кальций ( Са)
Хлористый кальций в медицине нашел свое применение как противовоспалительное и
дисенсебилизирующее средство.
Фармакологическое действие хлористого кальция:
Кальций сам по себе является макроэлементом, участвующим в формировании тканей
костей, процессе свертывании крови, он необходим для нормальной деятельности
сердца и также участвует в процессах передачи импульсов по нервам. Хлористый
кальций при введении вызывает возбуждение симпатической нервной системы,
усиливает выделение надпочечниками адреналина, а также оказывает умеренное
диуретическое действие.
При взаимодействии хлористого кальция с магниевыми солями, щавелевой и
фтористой кислотами образуются нерастворимые соединения, позволяющие
использовать хлористый кальций в медицине в качестве антидота.
Показания к применению хлористого кальция:
Хлористый кальций в медицине применяется как дополнительное средство для
лечения аллергий (крапивницы, сенной лихорадки, сывороточной болезни,
ангионевротического отека), а также аллергических реакций на медикаменты.
Применяется также в качестве гемостатического средства при различных
кровотечениях: легочных, маточных, кишечных, желудочных, носовых.
При отравлениях хлористый кальций в сочетании с магниевыми солями, щавелевой и
фтористой кислотами используется в качестве противоядия.
Барий(Ba)
Барий в природе встречается главным образом в виде суль фатов и карбонатов,
образуя минералы бария BaSO4 витерит ВаСO3. Барий относится к числу очень
активных элементов, он быстро окисляется на воздухе, энергично реагирует с водой и
вступает в реакции со многими элементами.
Из солей бария в медицине применяются лишь сульфат ба рия, который практически
нерастворим ни в воде, ни в кисло тах, ни в щелочах, ни в органических растворителях,
а поэто му не ядовит.
Все растворимые соли бария (хлориды, бромиды, йодиды, нитраты, цианиды) очень
токсичны и по этой причине не при меняются в медицине. Токсичны и те соли бария,
которые не растворимы в воде, но растворимы в соляной кислоте (ВаСO3, BaS), так
как, попадая в кислую среду желудочного сока, они переходят в растворимую соль
хлорид бария ВаСl2.
Применение сульфата бария в медицине основано на его непроницаемости для
рентгеновских лучей, что используется в рентгенологии для получения контрастных
рентгеновских сним ков и при рентгеноскопическом исследовании пищеварительно го
тракта.
Вопрос №47.Общая характеристика d-элементов (переходных элементов). Характерные особенности d- элементов: переменные степени окисления, образование комплексов. Вторичная периодичность в семействах d-элементов. Лантаноидное сжатие и сходство d-элементов V и VI периодов
К d-элементам относятся все элементы побочных групп/ Периодической системы (группы IБ – VIIIБ), включая лантаноиды и актиноиды.Эти элементы занимают положение между s- и р-элементами. Поэтому они фактически прерывают постепенное изменение свойств, присущее типическим элементам, и как бы осуществляют переход от типических металлов к типическим неметаллам, за что их называют переходными элементами (или переходными металлами, так как все эти элементы обладают свойствами металлов). В отличие от типических элементов у переходных металлов валентными являются не
только электроны внешнего уровня, но и электроны, а также вакантные орбитали
(n –1)d- и (n – 2)f-подуровней. Благодаря этому эти элементы в своих соединениях
проявляют, как правило, разнообразные положительные степени окисления. Как и для
элементов главных групп, максимальное положительное значение степени окисления
определяется номером группы; однако есть два важных исключения.
Для элементов IБ группы (Cu, Ag, Au) более характерна степень окисления +I,
по-видимому, потому, что не только электроны внешнего энергетического уровня
участвуют в образовании химических связей.
Из элементов VIIIБ групп (Fe, Co, Ni, Ru, Pd, Os, ir, Pt) степень окисления (VIII)
достигается только в соединениях рутения Ru и осмия Os; остальные элементы
проявляют более низкие степени окисления.
Переходные d-элементы являются типичными металлами. Все они (кроме ртути)
находятся при обычных условиях в одном агрегатном состоянии, обладают
значительной твёрдостью, прочностью, пластичностью, высокими температурами
плавления и кипения, высокой электропроводностью и теплопроводностью.
У переходных элементов в пределах одного периода возрастание порядкового номера
не сопровождается существенным изменением структуры внешнего электронного
слоя, так как электронами заполняется предвнешний слой. В связи с этим химические
свойства этих элементов изменяются в периоде хотя и закономерно, но значительно
менее резко, чем у элементов главных подгрупп.
Изменение радиусов атомов по периоду у d-элементов более плавное, чем у
непереходных элементов. В подгруппах радиусы атомов d-элементов, как правило,
увеличиваются. Однако это увеличение, в основном, заметно при переходе от
элементов IV периода к V периоду. Радиусы элементов V и VI периодов примерно
одинаковы. Это связано с, так называемым лантаноидным сжатием (уменьшением
атомных радиусов в ряду Се –Lu из-за последовательного возрастания заряда ядра и
его действия на внешние электроны при заполнении электронами третьей снаружи
f-орбитали и неизменном общем числе электронных слоёв).
Характерной особенностью d-элементов является то, что с увеличением заряда ядра у
них значение устойчивой степени окисления по подгруппе возрастает, а по периоду – падает. Это обусловлено, соответственно, более эффективным экранированием
валентных электронов от воздействия положительного заряда ядра и эффектом
d-cжатия.
В низших степенях окисления d-элементы проявляют свойства металлов. С
увеличением порядкового номера в подгруппах металлические свойства
d-элементов закономерно ослабевают, а окислительные свойства усиливаются.
Катионные формы низших степеней окисления в растворах характеризуются
основными и восстановительными свойствами.
Для d-элементов с высшей степенью окисления характерно образование в растворах
кислородсодержащих анионов, проявляющих кислотные и окислительные свойства.
В промежуточной степени окисления d-элементы проявляют амфотерные свойства.
Вопрос №48. d–Элементы III группы. Общая характеристика, сходство и отличие от s–элементов II группы. f-Элементы как аналоги d-элементов III группы; сходство и отличие на примере церия. Химические основы применения церия(IV) сульфатов в количественном анализе.
Элементы IIБ группы
К данным элементам относятся цинк, кадмий, ртуть. Они являются
d-элементами с полностью заполненными d- орбиталями; это последние d – элементы периодов. Во всех соединениях их степень окисления равна +2 (только
ртуть в соединениях со строением –Hg –Hg –формально может иметь степень
окисления +1). В отличие от щелочноземельных металлов, у Zn, Cd и Hg
предвнешний энергетический уровень содержит не 8, а 18 электронов. Это приводит к
существенному отличию свойств рассматриваемых элементов от свойств
щелочноземельных металлов. Ввиду того, что на внешнем уровне атомы элементов
подгруппы цинка, как и атомы щелочноземельных металлов, имеют по два
s-электрона, существует некоторое сходство между этими элементами и
щелочноземельными металлами. Атомы (и ионы) элементов IIБ группы имеют
меньшие размеры, чем атомы (и ионы) s-элементов. Поэтому у цинка, кадмия и ртути
химическая активность выражена в меньшей степени: при обычной температуре они
труднее окисляются и не взаимодействуют с водой. Плотность этих металлов
возрастает от цинка (7,13 г/см3) к ртути (13,6 г/см3), а температуры плавления и
кипения, а также твёрдость –понижаются. Цинк плавится при 419,40С, а ртуть при
-38,90С.Два последних ряда периодической системы элементов составляют
f-элементы. В элементном состоянии все они металлы; лантаноиды обозначают обычно общим символом Ln.
Многие особенности, характерные для d-элементов, присущи также f-элементам,
которые более похожи на d-элементы, чем на s- и р-элементы. К f-элементам
относятся лантаноиды и актиноиды, в атомах которых заполняются соответственно 4f- и
5f-оболочки.
Лантаноиды очень сходны по химическим свойствам. Близость свойств соединений
лантаноидов обусловлена тем, что застройка внутренней 4f-оболочки атомов мало
сказывается на состоянии валентных электронов. В образовании химической связи 4f-
электроны лантаноидов обычно не принимают участия.
В атомах актиноидов 5f-электроны являются «более внешними», чем 4f-электроны в
атомах лантаноидов, их энергии сопоставимы с энергиями 6d-электронов. Поэтому 5f-
электроны атомов актиноидов могут участвовать в образовании химических связей
(наряду с 6d- и 7s-электронами). Отсюда значительное отличие актиноидов друг от друга и проявление ими высоких степеней окисления (до +7).
Близость энергий 5f- и 6d-электронов атомов актиноидов объясняет сходство свойств
первых элементов семейства актиноидов с d-элементами.
Так, хотя строение внешних электронных оболочек невозбужденных атомов урана и
вольфрама различны, однако при сравнительно небольшом
энергетическом воздействии на атом урана f-электроны переходят на 6d-уровень в
возбужденном состоянии и уран становится аналогом вольфрама
Поэтому свойства урана во многом похожи на свойства вольфрама.
С ростом порядкового номера f-элемента связь 5f-электрона с ядром упрочняется,
поэтому при переходе от первых актиноидов к последним степень окисления +3,
отвечающая отделению только 6d- и 7s -электронов, становится все более
характерной. В современной технике широко используют способность церия как и
других лантаноидов модифицировать сплавы на основе железа, магния, алюминия,
меди, ниобия, титана. Легирование конструкционных сталей церием значительно
повышает их прочность. Здесь действие церия в целом аналогично действию лантана.
Но, поскольку церий и его соединения дешевле и доступнее, чем лантан, значение
церия как легирующей добавки больше, нежели лантана.
Вопрос №49. d–Элементы IV и V, групп. Общая характеристика. Химические основы применения титана, ниобия и тантала в хирургии, титана диоксида и аммония метаванадата в фармации.
Валентная конфигурация d-элементов IV группы (n-1) и V группы. Поэтому высшая
степень окисления +4, но возможны +3 и +2, а для V группы +5, +4, +3, +2.
Отрицательные степени окисления невозможны, поэтому элементы подгруппы титана
образуют катионы и комплексные катионы. Химические свойства подгруппы титана
характеризуют их металлические свойства. Они не взаимодействуют с
концентрированными серной и азотной кислотами благодаря наличию пленки оксидов.
К растворам щелочей элементы подгруппы титана устойчивы. При сгорании титан
образует диоксид TiO2, но известны и низшие оксиды Ti2O3 и TiO. Наиболее
стабильным является TiO2. гидроксид Ti(OH)4 с щелочами образуются соли титанаты:
K4TiO4 –ортотитанат калия или при обезвоживании метатитанаты: BaTiO3. Элементы
подгруппы титана имеют высокие температуры плавления и образуют твердые
растворы друг с другом и с d-элементами V группы в виде непрерывных твердых
трехкомпонентных растворов, например Ti –V –Nb или V –Nb –Ta. Для таких сплавов
характерна коррозионная устойчивость, что предопределяет использование сплавов в
медицине в качестве хирургического инструмента. Уникальной особенностью
обладает чистый титан, который не раздражает живую ткань и используется в костной
хирургии для скрепления и замены пораженных частей костной ткани.Тантал и ниобий
преимущественно используются в электровакуумной технике и химической
промышленности.
Электровакуумная техника и электротехника. Тантал впервые был применен в
1900—903 гг. для изготовления нитей накаливания в электролампах, но позже, в
1909—910 гг., был заменен в этой области вольфрамом.
Широкое применение тантала в последующем связано с развитием электровакуумной
техники, главной отраслью которой является производство радиотехнической,
радиолокационной и рентгеновской аппаратуры.
Тантал и ниобий обладают весьма ценным сочетанием свойств, необходимых для
изготовления деталей электровакуумной аппаратуры: высокой температурой
плавления, высокой эмиссионной, способностью и способностью поглощать газы
Последнее свойство используется для поддержания глубокого вакуума в радиолампах
и других электровакуумных приборах.
Из тантала и ниобия изготовляют «горячую арматуру» (т. е, нагреваемые детали) — аноды, сетки, катоды косвенного накала и другие детали в электронных и, в
особенности, в мощных генераторных лампах.
Кроме чистых металлов, для тех же целей применяют тантало-ниобиевый сплав
Химическая промышленность. Устойчивость тантала и ниобия против действия
минеральных кислот позволяет применять их для изготовления химической посуды и
облицовки химической аппаратуры. В этой области преимущественно используют
тантал как более коррозионноустойчивый. Так, в производстве соляной кислоты
применяют конденсаторы из тантала. Наряду с высокой кислотостойкостью такие
конденсаторы обладают весьма высоким коэффициентом теплопередачи.
Из тантала изготовляют фильеры (взамен платиновых) для протяжки целлюлозных
нитей в производстве искусственного шелка.
Подогреватели с защитным патроном из тантала применяют для нагревания
солянокислых растворов.
Медицина. Металлический тантал в виде проволоки и тонких листов нашел
применение в костной и пластической хирургии для скрепления костей, «заплат» на
черепе и т. п. Металл совершенно не раздражает соприкасающуюся с ним живую
ткань и не вредит жизнедеятельности организма.Диоксид титана отличается высокой
реакционной устойчивостью к различным соединениям, в том числе и к токсичным,
содержащимся в воздушной среде. Из-за своей инертности, диоксид титана не
токсичен и, в общем, считается очень безопасным веществом. Он может
контактировать с продуктами в упаковке, а в определенных концентрациях его можно
использовать и как пищевой краситель.
Вопрос №50. Хром. Общая характеристика. Простое вещество и его химическая активность, способность к комплексообразованию.
Хром обнаруживается в растительных и животных организмах. В организме
взрослого человека содержится примерно 6 г Cr (0,1%).
Металлический хром не токсичен, а соединения хрома (III) и (VI) опасны для
здоровья, предполагают, что они обладают канцерогенными свойствами. 0,25 - 0,3 г
дихромата калия вызывает летальный исход.Ярко выраженная способность
трехвалентного хрома к образованию комплексных соединений особенно отчетливо
проявляется в его различных комплексных продуктов присоединения аммиака. В
соответствии со своим КЧ 6 ион хрома (III) может координационно связать шесть
молекул аммиака. При этом образуется комплексный ион [Cr (NH3) 6] 3+, заряд
которого совпадает с зарядом хрома. В зависимости от температур меняется и
химическая активность хрома.
Так при небольших температурах хром мало активен и взаимодействует только со
фтором.
С увеличением температуры от 600 0 C, начинает взаимодействовать с галогенами,
серой, азотом, кремнием, бором, углеродом, кислородом.
Реакция с кислородом протекает сначала довольно активно, но через некоторое время
резко замедляется, так как поверхность покрывается тонкой чрезвычайно устойчивой
пленкой, препятствующему дальнейшему окислению.
Это явление получило название –пассивирование.
Хром пассивируется холодными концентрированными H2SO4 и HNO3, однако при
сильном нагревании он растворяется в этих кислотах:
2Cr + 6H2SO4(конц.) = Cr2(SO4)3 + 3SO2 + 6H2O
Cr + 6HNO3(конц.) = Cr(NO3)3 + 3NO2 + 3H2O
Дальше, уже при 1200 0 C пленка начинает разрушаться и окисление снова идет
быстро.
При 2000 0 C хром воспламеняется в кислороде с образованием темно-зеленого
оксида Cr2O3.
В сильных разбавленных кислотах - HCl и H2SO4, хром имеет свойство растворяться.
В отсутствии воздуха при этом образуются соли Cr2+, а на воздухе - соли Cr3+:
Cr + 2HCl = CrCl2+ H2
4Cr + 12HCl +3O2 = 4CrCl3 + 6H2O
Благодаря защитной пленке, хром не растворим кислотах в H3PO4, HClO4
Вопрос №51. Хром(II), кислотно-основная (КО) и окислительно-восстановительная (ОВ) характеристики соединений.
Соединения Cr (+2) —сильные восстановители, т.к. Хром в минимальной степени
окисления.
CrCl2 + 4HCl + O2 = 4СrСl3 + 2Н2О
Оксид хрома(II) и гидроксид хрома(II) имеют основной характер
Cr(OH)+2HCl→CrCl+2HO
Соединение хрома(II)-сильные восстановители; переходят в соединение хрома(III) под
действием кислорода воздуха.
2CrCl+ 2HCl → 2CrCl+ H
Вопрос №52. Xpoм(III), кислотно-основная (КО) и окислительно-восстановительная (ОВ) характеристики соединений, способность к комплексообразованию.
Соединения Cr (+3) —могут являться и окислителями и восстановителями, т.к.
Хром в данных соединениях имеет промежуточную степень окисления.
Сr2O3 + 2Al = 2Сr + Аl2O3
Сr –окислитель
Cr2(SO4)3 + 3Cl2 +16NaOH=2NaCI+6Na2SO4 + 3Na2CrO4 + 8Н2O
Cr –восстановитель
Вопрос №53. Соединения хрома(VI) – оксид и хромовые кислоты, хроматы и дихроматы, КО и ОВ характе- ристика. Окислительные свойства хроматов и дихроматов в зависимости от рН среды; окисление органических соединений (спиртов). Пероксосоединения xpoмa(VI).
Соединения хрома (VI)
Оксид хрома CrO3 (хромовый ангидрид) –кристаллическое вещество тёмно-красного
цвета, легко растворяется в воде с образованием хромовых кислот.
Хромовый ангидрид –сильный окислитель. Если, например, сухой CrO3 смочить
этиловым спиртом, то спирт окисляется настолько энергично, что происходит
самовоспламенение, CrO3 восстанавливается доCr2O3.
Хромовому ангидриду соответствуют хромовая H2CrO4 и двухромовая H2Cr2O7
кислоты. Они известны только в водных растворах и образуют хроматы (K2CrO4,
CaCrO4) и дихроматы (K2Cr2O7, CaCr2O7). Хромовая кислота (К1 = 2 10-1 и К2 = 3
10-7) значительно слабее двухромовой кислоты (К2 = 2 10-2). Дихромовая кислота –__представитель изополикислот общей формулы хН2О уЭО3. Растворы этих кислот
очень токсичны.
Хроматы щелочных металлов подвергаются заметному гидролизу, и растворы их
имеют щелочную среду. Хромат-ионы CrO42- устойчивы в нейтральной и в щелочной
средах. В кислой среде (при подкислении водных растворов хроматов) происходит
превращение хромат-ионов в дихромат-ионы:
2CrO42- + 2H+ ↔ Cr2O72- + H2O
В результате чего желтый раствор окрашивается в оранжевый цвет.
Под действием щелочи дихромат-ионы Cr2O72- превращаются в хромат-ионы CrO42-:
Cr2O72- + 2ОН- = 2CrO42- + H2O
(оранжевый цвет раствора переходит в желтый).
Следовательно, в кислой среде существуют только дихроматы, а в щелочной – только
хроматы.
Окислительные свойства проявляют только производные хрома (VI). Хроматы и
дихроматы – сильные окислители. Их широко используют для окисления различных
веществ. Особенно хорошо окислительные свойства проявляются в кислой среде. Так,
например, при комнатной температуре они окисляют H2S, HI, H2SO3 и их соли, а при
нагревании – HBr и даже HCl. Например:
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O,
K2Cr2O7 + 14HCl = 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Последняя реакция интересна тем, что она идёт только при нагревании и поэтому
удобна для получения хлора в небольших количествах в лаборатории.
В аналитической химии реакции окисления хроматом или дихроматом калия
различных ионов используется для их определения (хроматометрия).
Смесь K2Cr2O7 и H2SO4 (в соотношении 1 : 1) широко используется как сильное
окислительное моющее средство в лабораторной практике. Её называют «хромпик»
или хромовой смесью. Смесь легко удаляет жир с поверхности стекла, окисляя его
образующимся хромовым ангидридом CrO3 и смывая концентрированной серной
кислотой.
С уменьшением рН равновесие смещается вправо (в присутствии НCl образуются
ионы CrO3Cl Таким образом, хроматы устойчивы в нейтральной и щелочной следах
(желтая окраска), а дихроматы - в кислой среде (оранжевая окраска). Кислые соли M+
HCrO4
неизвестны (при соответствующих реакциях получаются дихроматы). В растворе
хроматы имеют щелочную реакцию, а дихроматы - кислую.
При подкислении концентрированных растворов дихроматов ионы Cr2O7
Переходят в (Cr3O10) и (Cr4O13), что сопровождается появлением красной окраски.
Вопрос №54. Общие закономерности КО и ОВ свойств соединений d-элементов при переходе от низших степеней окисления к высшим на примере соединений хрома.
Общие закономерности КО и ОВ свойств соединений d-элементов при переходе от
низших степеней окисления к высшим на примере соединений хрома.
Элементы d-блока находящиеся в III, IV, V, VI, VIIB группах имеют незавершенный
d-электронный слой (предвнешний эн. уровень). Такие электронные оболочки
неустойчивы. Этим объясняется переменная валентность и возможность проявлять
различные степени окисления d-элементов. Степени окисления элементов d-блока в
соединениях всегда только положительные.
Соединения с высшей степенью окисления проявляют кислотные и окислительные
свойства (в растворах представлены кислородсодержащими анионами). Соединения с
низшей степенью окисления –основные и восстановительные свойства (в растворах
представлены катионами). Соединения с промежуточной степенью окисления – проявляют амфотерные свойства.
Например: CrO основной оксид, Cr2O3 –амфотерный оксид, CrO3 –кислотный оксид.
В периоде с возрастанием заряда ядра атома уменьшается устойчивость соединений
с высшей степенью окисления, возрастают их окислительные свойства.
В группах увеличивается устойчивость соединений с высшей степенью окисления,
уменьшаются окислительные и возрастают восстановительные свойства элементов
Вопрос №55. Молибден и вольфрам, общая характеристика, способность к образованию изополи- и гете- рополикислот; сравнительная окислительно-восстановительная характеристика соединений мо- либдена и вольфрама по отношению к соединениям хрома.
Молибден –относится к металлам жизни, это один из важнейших биогенных
элементов. Примерно 30 лет назад Ф.Крик и л. Орил выдвинули идею, что
возникновение жизни на Земле происходило не эволюционным путём, а она занесена
неведомой цивилизацией из космоса с молибденовых звёзд, где жизнь существовала
задолго до нас.
Молибден создаёт устойчивые оксокомплексы [MoO(C2O4)(H2O)2O2]2- или другие и,
видимо, поэтому входит в состав ферментов, обеспечивающих перенос оксогрупп.
Однако избыточное количество молибдена в пищи нарушает метаболизм ионов кальция, вызывает снижение прочности костей (остеопороз). Молибден является важнейшим микроэлементом растений, так как биологически активные вещества с его участием обеспечивают мягкую фиксацию азота: превращают в аммиак или азотсодержащие продукты.
Вольфрам –микроэлемент, его роль в организме изучена недостаточно.
Молибден и вольфрам всех степеней окисления образуют очень большое число комплексов как с неорганическими, так и с органическими соединениями, группами и радикалами. В одних соединениях эти элементы являются центральными атомами-комплексообразователями, в других же они входят в состав лигандов.
Многие их комплексы используются в качестве катализаторов, реактивов в аналитической химии. Некоторые комплексы имеют большое значение в технологи самих металлов, например, в процессах экстракции, сорбции.
Так называемые комплексные парасоли аммония менее растворимы, чем нормальные соли, поэтому в виде парасолей можно извлекать Мо и W из растворов. Наоборот мета- и гетерокомплексы хорошо растворимы в определенных условиях и могут удерживать Мо и W в растворах. Наибольший интерес представляют комплексы, относящиеся к группе
полисоединений (изо-, гетеро-, акваполикомплексы и их соли). Многочисленные галогенидные, радонидные, цианидные, сульфидные, сульфатные, нитратные, оксалатные комплексы Мо и W могут быть отнесены к группе ацидокомплексов.
При экстракции Мо и W большое значение имеют комплексы с аминами, кетонами, аммониевыми основаниями, фосфинами и фосфорорганическими кислотами. В процессе экстракции в одних случаяхсоединения Мо и W образуют собственно комплексные соединения, в других –сольватные или сорбционные соединения.
Мо и W обычно входят в состав комплексных анионов, но есть и их
комплексные катионы. Изо- и гетерополисоединения Мо и W (6+) –комплексные многоосновные кислоты и их соли, в которых Мо и W входят в комплексный анион. Изополисоединения содержат в анионной части кроме Мо (W) также кислород и водород. Гетерополисоединения содержат еще один или два элемента, являющихся комплексообразователями. Известно до 35 типов гетерополисоединений с различными центральными атомами.
Вопрос №56. Биологическое значение d-элементов VI группы. Химические основы применения соединений хрома, молибдена и вольфрама в фармации (фармацевтическом анализе).
Наиболее широкая область применения металлов VIБ группы –металлургия (металлы важнейшие лигирующие добавки). Хром используется для хромирования деталей и изделий. Многие его соединения применяют как окислители.
Молибден и вольфрам –незаменимые материалы электровакуумной техники. Карбиды Мо и W –основные компоненты инструментальных сплавов.
Cr, Mo, W –микроэлементs живых организмов. Хром обнаруживается в растительных и животных организмах. В организме взрослого
человека содержится примерно 6 г Cr (0,1%). Металлический хром не токсичен, а соединения хрома (III) и (VI) опасны для здоровья, предполагают, что они обладают канцерогенными свойствами. 0,25 - 0,3 г дихромата калия вызывает летальный исход.
Молибден –относится к металлам жизни, это один из важнейших биогенных
элементов. Примерно 30 лет назад Ф.Крик и л. Орил выдвинули идею, что возникновение жизни на Земле происходило не эволюционным путём, а она занесена
неведомой цивилизацией из космоса с молибденовых звёзд, где жизнь существовала
задолго до нас.
Молибден создаёт устойчивые оксокомплексы [MoO(C2O4)(H2O)2O2]2- или другие и,
видимо, поэтому входит в состав ферментов, обеспечивающих перенос оксогрупп.
Однако избыточное количество молибдена в пищи нарушает метаболизм ионов
кальция, вызывает снижение прочности костей (остеопороз).
Молибден является важнейшим микроэлементом растений, так как биологически активные вещества с его участием обеспечивают мягкую фиксацию азота: превращают в аммиак или азотсодержащие продукты.
Вольфрам –микроэлемент, его роль в организме изучена недостаточно.
Вопрос 57. Марганец. Общая характеристика. Химическая активность простого вещества. Способность к комплексообразованию (карбонилы марганца).
Марганец- элемент побочной подгруппы седьмой группы четвёртогопериода переодической системы Д. И. Менделеева с атомным номером 25. Обозначается символом Mn(лат. Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Характерные степени окисления марганца:0, +2, +3, +4, +6, +7 (+1, +5 мало характерны).
Дата: 2019-07-30, просмотров: 869.