Влияние концентрации реагента:
Zn + H2SO4 (разб.) → ZnSO4 + H2
3Zn + 4H2SO4 (конц.) → 3 ZnSO4 + S + 2H2O
Разбавленная серная кислота является слабым окислителем за счёт катиона водорода Н+, а концентрированная – сильным окислителем за счёт аниона SO4 2-, который содержит серу в высшей степени окисления +6.
Влияние температуры:
А) Реакция идёт на холоду: Cl2 + 2KOH → KCl + KClO + H2O
Б) Реакция протекает при нагревании: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
При нагревании окисление хлора происходит более глубоко (до степени окисления +5), по сравнению с реакцией, протекающей на холоду (до степени окисления +1).
В зависимости от рН среды меняется характер протекания окислительно-восстановительного процесса между одними и теми же регентами.
Например, взаимодействие восстановителя сульфита натрия (Na2SO3) с окислителем перманганатом калия (KMnO4) в кислотной (рН<7), нейтральной (pH=7) и щелочной (pH>7) среде приводит к образованию различных продуктов реакций:
5Na2SO3 +2KMnO4+3H2SO4 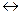 2MnSO4+5Na2SO4+K2SO4 +3H2O (pH 7);
2MnSO4+5Na2SO4+K2SO4 +3H2O (pH 7); 
Na2SO3 + 2KMnO4 + H2O 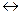 3Na2SO4 + 2MnO2 + 2KOH (pH=7);
3Na2SO4 + 2MnO2 + 2KOH (pH=7);
Na2SO3 + 2KMnO4 + 2KOH 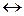 Na2SO4 + 2K2MnO4 + H2O (pH >7).
Na2SO4 + 2K2MnO4 + H2O (pH >7).
Вопрос №14. Основные определения: раствор, растворитель, растворенное вещество. Растворимость. Растворы газообразных, жидких и твердых веществ. Вода как один из наиболее распространенных растворителей. Роль водных растворов в жизнедеятельности организмов. Неводные растворители и растворы.
Раствор – это гомогенная (однородная) система, состоящая из двух и/или более компонентов, один из которых – растворитель, другие – растворенные вещества
раствор = растворенное вещество + растворитель
Растворитель – вещество, которое находится в растворе в избытке (вода, спирт)
Растворенное вещество – вещество, которое растворяют в растворителе.
Растворимость — способность вещества образовывать с другими веществами однородные системы
На растворимость веществ оказывают влияние многие факторы, главными из которых являются природа растворителя и растворяемого вещества, температура, давление, наличие в растворе других веществ (особенно электролитов).
- Влияние природы: в растворителе, молекулы которого полярны, лучше всего растворяются вещества, образованные ионными или ковалентными полярными связями.
- Влияние температуры: растворимость большинства твердых и жидких веществ при повышении температуры в той или иной степени увеличивается. Для некоторых твердых веществ (особенно если при их растворении теплота выделяется) растворимость, наоборот, может понижаться с повышением температуры.
Растворимость газов уменьшается с повышением температуры.
- Влияние давления на растворимость твердых и жидких веществ практически не сказывается, т.к. объем системы при этом изменяется незначительно.
Существенное влияние давление оказывает лишь на растворимость газов.
- Влияние электролитов - при добавлении в раствор электролитов может понижаться растворимость газов, некоторых жидкостей и твердых веществ.
По агрегатному состоянию различают газовые, жидкие и твердые растворы.
Газообразные растворы называются иначе газовыми смесями. Примером такой смеси может служить земная атмосфера, состоящая, главным образом, из азота и кислорода, а также некоторых других веществ, присутствующих в значительно меньших количествах (углекислого газа, водяных паров, благородных газов и т.д.).
Твердыми растворами являются многие сплавы металлов, некоторые неорганические минералы. Образуются твердые растворы при кристаллизации расплавов.
Наибольшее распространение в природе и в хозяйственной деятельности человека получили жидкие растворы. Они, в свою очередь, подразделяются на растворы газов в жидкостях, жидкостей в жидкостях и растворы твердых веществ в жидкостях.
Вода как растворитель:
Энергия образования молекул воды высока, она составляет 242 кДж/моль. Этим объясняется устойчивость воды в природных условиях. Устойчивость в сочетании с электрическими характеристиками и молекулярным строением делают воду практически универсальным растворителем для многих веществ. Высокая диэлектрическая проницаемость обусловливает самую большую растворяющую способность воды по отношению к веществам, молекулы которых полярны.
Растворение веществ в воде сопровождается образованием слабых связей между их молекулами или ионами и молекулами воды. Это явление называется гидратацией. Для веществ с ионной структурой характерно формирование гидратных оболочек вокруг катионов за счет донорно-акцепторной связи с неподеленной парой электронов атома кислорода. Катионы гидратированы тем в большей степени, чем меньше их радиус и выше заряд. Анионы, обычно менее гидратированные, чем катионы, присоединяют молекулы воды водородными связями.
В процессе растворения веществ изменяется величина электрического момента диполя молекул воды, изменяется их пространственная ориентация, разрываются одни и образуются другие водородные связи. В совокупности эти явления приводят к перестройке внутренней структуры.
Роль водных растворов в жизнедеятельности организмов:
1) Важнейшие биологические жидкости (кровь, лимфа, слюна и т.п.) являются растворами солей, белков, углеводов, липидов в воде.
2) Биохимич реакции в организ-х протекают в растворах.
3) Усвоение пищи происходит с переходом пит веществ в растворенное состояние
4) Биожидкости транспортируют пит вещества(жиры, аминокислоты), лекарственные препараты к органам и тканям, а также выводят метаболиты(мочевину, угл газ). В жидких средах организма поддерживаются постоянство кислотности, концентрации солей и органических веществ.
Неводные растворы - это жидкие лекарственные формы, представляющие собой гомогенные дисперсные системы, структурными единицами в которых являются ионы и молекулы. Эти растворы предназначены главным образом для наружного применения (смазывания, обтирания, примочки, капли для носа, ушные и т.п.). Значительно реже они применяются внутрь, для инъекций и для ингаляций.
Причины применения неводных растворителей:
1. Необходимость получения растворов из трудно растворимых в воде лекарственных веществ;
2. Для устранения гидролиза лекарственных веществ;
3. Возможность пролонгирования действия;
4. Для увеличения стабильности лекарственных веществ в растворе.
Растворители, входящие в состав неводных растворов, подразделяют на две группы:
· летучие (этанол, диэтиловый эфир, хлороформ);
· нелетучие (глицерин, минеральные масла (вазелиновое), силиконы (эсилон 4, 5), полиэтиленоксиды (ПЭО - 400), димексид).
Вопрос №15. Процесс растворения как физико-химическое явление (Д.И. Менделеев, Н.С. Курнаков). Термодинамика процесса растворения.
Процесс растворения – физико-химический процесс.
Физический процесс растворения заключается в разрушении межмолекулярных и меж ионных химических связей, кристаллической решётки, что сопровождается поглощением энергии – эндотермический процесс, а так же идёт распределение частиц растворённого вещества между молекулами растворителя (диффузия).
Химический процесс растворения заключается во взаимодействии частиц растворённого вещества с молекулами растворителя, что сопровождается выделением энергии – экзотермический процесс.
Растворение – сложный физико-химический процесс, включающий три основные стадии, каждая из которых характеризуется изменениями термодинамических функций ∆Н и ∆S:
1) разрушение химических и межмолекулярных связей в растворяемом веществе (например, разрушение кристаллической решетки): ∆Н1>0, ∆S1>0
2) химическое взаимодействие частиц растворенного вещества с растворителем (сольватация): ∆Н2<0, ∆S2<0
3) равномерное распределение частиц растворенного вещества в среде растворителя путем диффузии: ∆Н3>0, ∆S3>0
Согласно 2-му закону термодинамики условием самопроизвольности процесса растворения является убыль энергии Гиббса:
∆G = ∆H - T∆S < 0, которая складывается из энтальпийного ∆Н и энтропийного T∆S факторов.
Растворение газов в жидкостях приводит к упорядочению системы и, следовательно, сопровождается уменьшением энтропии: ∆Sр-ния<0. Движущей силой процесса растворения в этом случае является энтальпийный фактор и растворение большинства газов является процессом экзотермическим: ∆Нр-ния<0. Таким образом, самопроизвольное растворение газов возможно при низких температурах (|∆Н| > |T∆S|)
Растворение жидких и твердых веществ в жидкостях приводит к увеличению беспорядка в системе и увеличению энтропии: ∆Sр-ния>0. Суммарный тепловой эффект процесса растворения определяется в основном слагаемыми ∆Н1 и ∆Н2 и в зависимости от их соотношения может и быть и положительным (NaCl), и отрицательным (NaOH). Растворение большинства кристаллических веществ – процесс эндотермический ∆Нр-ния>0, так как энергия, затрачиваемая на разрушение кристаллической решетки, не компенсируется энергией, выделяемой за счет сольватации. Таким образом, самопроизвольному растворению большинства твердых веществ способствуют высокие температуры (|∆Н| < |T∆S|).
Растворы, образование которых не сопровождается изменениями объема системы и тепловыми эффектами (∆V=0, ∆Н=0), называют идеальными. Движущей силой образования идеального раствора является увеличение энтропии системы.
Вопрос №16. Растворы газов в жидкостях. Законы Генри, Генри-Дальтона, И.М. Сеченова. Растворы твердых веществ в жидкостях. Понятие о коллигативных свойствах раствора.Зависимость «свойство раствора – концентрация». Закон Вант-Гоффа об осмотическом давлении. Теория электролитической диссоциации (Аррениус С. Каблуков И.А.). Роль осмоса в биосистемах. Плазмолиз, гемолиз, тургор. Гипо-, изо- и гипертонические растворы.
Растворимость газа в жидкости определяет способность чистого газового компонента или смеси газов образовывать с жидкостью гомогенные растворы. Растворение газа в жидкости почти всегда сопровождается выделением теплоты, поэтому растворимость газа с повышением температуры понижается. Однако иногда растворение газа сопровождается поглощением теплоты (например, растворение благородных газов в органических растворах); в этом случае повышение температуры увеличивает растворимость газа. Газ в жидкости не растворяется беспредельно. При растворении происходит уменьшение объема системы, поэтому повышение давления должно приводить к увеличению растворимости газа.
Если газ мало растворим и давление мало, то растворимость газа пропорциональна его давлению.
Эта зависимость выражена в законе Генри:
«Растворимость газа в жидкости прямо пропорциональна парциальному давлению газа при постоянной температуре.»
С=КР ,
где с - молярная концентрация газа в растворе, моль/л,
К - коэффициент (константа) Генри, моль/(Па*л). Коэффициент зависит от природы газа и растворителя, а также от температуры,
Р - парциальное давление газа над раствором,
Па Закон Генри является частным случаем общего закона Дальтона (если речь идет о растворении смеси газов, то растворимость подчиняется этому закону):.
Закон Генри-Дальтона:
«Растворимость каждого компонента газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависти от общего давления смеси и индивидуальности других компонентов.»
Под парциальным давлением понимается доля давления компонента от общего давления газовой смеси.
При растворении газов в жидкостсях ∆ H раств всегда экзотермический процесс, а энтропия уменьшается.
Закон Сеченова:
« Растворимость газов в жидкостях в присутствии электролитов понижается, происходит высаливание газов».
Растворы твердых веществ в жидкостях:
· Если твердое вещество имеет ионную кристаллическую решетку, то ∆Hраств эндотермический процесс, а энтропия увеличивается.
· Если твердое вещество имеет молекулярную кристаллическую решетку ( например, йод), то ∆Hраств экзотермический процесс, а энтропия увеличивается.
Понятие о коллигативных свойствах растворов:
Коллигативные свойства растворов – это такие свойства, которые зависят только от концентрации частиц растворённого вещества, но не зависят от химической природы составляющих его веществ.
Свойства идеальных растворов определяются только его концентрацией. Образование такого раствора сопровождается нулевым ∆Н = 0, ∆V = 0.
К коллигативным свойствам относятся: диффузия и осмос, давление насыщенного пара растворителя и раствора, температура кристаллизации раствора, температура кипения раствора.
Дата: 2019-07-30, просмотров: 814.