Поляризуемость это способность электронной плотности химической связи смещаться под действием электрического поля. Например, если молекулу хлороводорода поместить в воду, то молекулы воды гидратируют молекулу HCl и поляризуют еще в большей степени полярную связь в ней. Поляризация приводит к разрыву связи в молекуле хлороводорода на ионы хлора и водорода. Таким образом, молекулы воды способствуют диссоциации веществ при их растворении.
Полярность ковалентной связи — это несимметричность расположения электронной пары на связываемых ею атомах.
Полярность связи.
Различают неполярную и полярную ковалентные связи. Неполярная связь возникает между атомами с одинаковой или близкой электроотрицательностью. Например, в двухатомных молекулах простых веществ (Н2, О2, N2). Полярные ковалентные связи образуются между атомами с разной электроотрицательностью. Например, в молекуле хлороводорода, в которой электронная пара смещена в сторону атома хлора (Нδ+ Cl δ-), в результате чего атомы приобретают эффективные заряды. Благодаря своей двухполюсности она называется диполем и определенным образом ориентируется во внешнем магнитном поле. Мерой полярности связи является ее электрический момент диполя: μ = q * d, μ – дипольный момент, Кл*м;
q – заряд диполя, Кл; d – длина диполя, м. Электрический момент диполя характеризует способность связи ориентироваться в магнитном поле
Полярность молекул - это несимметричное распределение электронной плотности, возникающее из-за различной электроотрицательности элементов, входящих в состав молекулы.
Эффективный заряд атома, характеризует разность между числом электронов, принадлежащих данному атому в хим. соед., и числом электронов своб. атома. Для оценок Э. з. а. используют модели, в которых экспериментально определяемые величины представляют, как ф-ции точечных неполяризуемых зарядов, локализованных на атомах; напр., дипольный момент двухатомной молекулы рассматривают как произведение Э. з. а. на межатомное расстояние. В рамках подобных моделей Э. з. а. можно рассчитать, используя данные оптич. или рентгеновской спектроскопии, ЯМР и др. Однако, поскольку электронная плотность в хим. соед. делокализована и границ между атомами не существует, нельзя описать разл. характеристики соед. одним набором Э. з. а.; значения этого показателя, определенные разными эксперим. методами, могут не совпадать. Э. з. а. можно определить также на основе квантовохим. расчетов. Э. з. а., определенные в рамках к.-л. одной модели или в однотипных расчетах, используют для корреляции с различными физ.-хим. характеристиками соед., установления реакц. центров в молекулах, оценки степени ионности хим. связи.
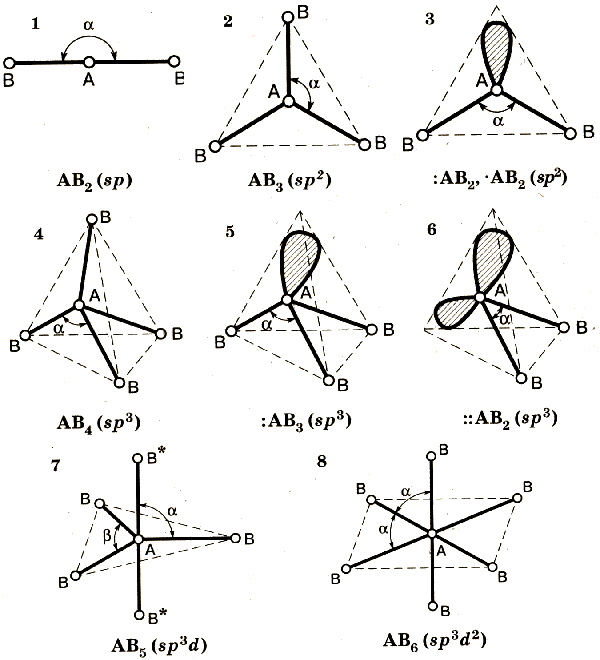
Вопрос №30. Гибридизация атомных орбиталей. Устойчивость гибридизированных состояний различных атомов. Пространственное расположение атомов в молекулах. Характерные структуры трех-, четырех-, пяти- и шестиатомных молекул .
Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии орбиталей данного атома с возникновением того же числа новых (гибридных1) орбиталей, одинаковых по энергии и форме.
Гибридизация атомных орбиталей происходит при образовании ковалентных связей.
Согласно концепции гибридизации орбитали центрального атома, участвующие в образовании σ – связей, выравниваются по форме и энергии.
При sp – гибридизации гибридизуется одна s – и одна p – орбиталь, при этом образуются две гибридные орбитали
180 гр линейная
При sp2 – гибридизации гибридизуется одна s – и две p – орбитали, при этом образуются три гибридные орбитали. Угол между направлением этих орбиталей составляет 120гр треугольник
При sp3 – гибридизации гибридизуется одна s – и три p – орбитали, при этом образуются четыре гибридные орбитали. 109028' тетраэдр
При sp3d2– гибридизации гибридизуется одна s – , три p – и две d - орбитали, при этом возникает шесть гибридных орбиталей 90 гр октаэдр
Или
Гибридизация– это явление смешения атомных орбиталей или электронных облаков, приводящее к образованию новых гибридных облаков одинаковой формы и одинаковой энергии.
Гибридные орбитали вытянуты по направлению к соседним атомам, что приводит к более полному перекрыванию электронных орбиталей, максимальному удалению электронных пар друг от друга,что соответствует минимуму энергии межэлектронного отталкивания, образованию более прочной химической связи и к выигрышу энергии.
| Тип гибридизации | Геометрическая форма | Угол между связями |
| sp | линейная | 180o |
| sp2 | треугольная | 120o |
| sp3 | тетраэдрическая | 109,5o |
| sp3d | тригонально-бипирамидальная | 90o; 120o |
| sp3d2 | октаэдрическая | 90o |
Вопрос №31. Описание молекул методом молекулярных орбиталей (ММО). Связывающие, разрыхляющие и несвязывающие МО, их энергия и форма. Энергические диаграммы МО. Заполнение МО электронами в молекулах, образованных атомами и ионами элементов 1-го и 2-го периодов ПСЭ. Кратность связи в ММО.
Он смог объяснить не только устойчивость частиц типа Н2+, но и магнитные свойства частиц, а также существование соединений благородных газов.
Основные положения метода
1. Молекула рассматривается как единой целое. Каждый электрон принадлежит молекуле в целом и движется в поле всех ядер и электронов. 2. Состояние электрона описывается молекулярной волновой функцией , которая в отличии от атомной является многоцентровой.
3. Вероятность нахождения электрона в какой либо точке многоядерного поля определяется квадратом молекулярной волновой функции / /2.
4. Молекулярная орбиталь (МО) характеризуется 4-мя квантовыми числами, определяющими ее размер, форму, ориентацию в пространстве и спиновое состояние. 5. Заселение электронами МО осуществляется по принципу минимальной энергии, принципу Паули и правилу Гунда.
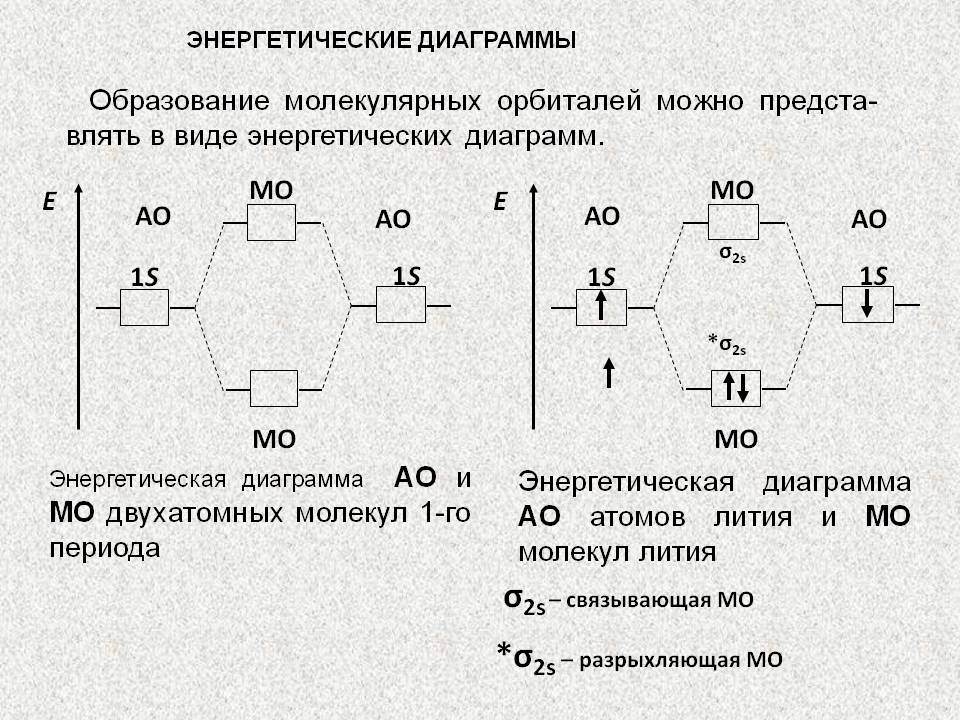
Энергетическая диграмма МО на примере молекулы водорода
сигма орбиталью – называется МО, образованная линейной комбинацией, когда АО перекрываются на линии связи. При этом, при сложении АО образуется связывающая МО ( св.) (электронная плотность повышена в межъядерном пространстве атомов А и В). Электроны, заселяющие ее называются связывающими. Энергия св. МО ниже энергии исходных АО. При вычитании АО образуется разрыхляющая МО ( * ) (электронная плотность нулевая в межъядерном пространстве атомов А и В). Электроны, заселяющие ее называются разрыхляющими. Энергия * МО ниже энергии исходных АО. Если электроны находятся на связывающей орбитали, значит, электронная плотность концентрируется между ядрами, что обуславливает сокращение длины связи и упрочнение молекулы.
Если же электроны находятся на разрыхляющей орбитали, то электронная плотность концентрируется за ядрами атомов и длина связи увеличивается (энергия связи понижается).
Энергические диаграммы МО.
----
Энергетические диаграммы МО молекул элементов второго периода
У элементов второго периода при переходе от лития к фтору происходит изменение энергий МО двухатомных молекул. Сопоставим сначала энергетические диаграммы МО молекул фтора и азота (Рис 5 ). Они подобны за исключением того, что в молекуле азота 3σ- орбитали расположены по энергии выше , чем 1π-орбитали, а в молекуле фтора , наоборот, энергия 1π-орбитали оказывается больше энергии 3σ- орбитали. Почему это так?- При переходе от лития к фтору увеличивается различие энергий 2s- и 2р- атомных орбиталей
 1 период
1 период
Кратность связи (порядок связи) – это число общих электронных пар, образующих данную связь. Химическая связь, образованная одной электронной парой, называется простой, одинарной или σ-связью(сигма-связь). Химическая связь, осуществляемая более чем одной электронной парой, называется кратной. Кратная связь может быть двойной, тройной, иметь более высокую кратность. Кратная связь состоит из σ-связи, π-связей и иногда δ-связей.
Вопрос №32. Межмолекулярные взаимодействия и их природа. Энергия межмолекулярного взаимодействия. Ориентационное, индукционное и дисперсионное взаимодействие.
Между любыми молекулами в любом агрегатном состоянии осуществляются межмолекулярные взаимодействия или силы Ван – дер – Ваальса. Эти химические связи слабее ковалентных связей. В основе межмолекулярных взаимодействий лежит электростатическое притяжение между диполями, но в различных веществах механизм возникновения диполей различен. Виды межмолекулярных взаимодействий:
1. Ориентационное взаимодействие возникает между молекулярными диполями, которые ориентируются друг по отношению к другу противоположно заряженными полюсами:
2. Индукционное взаимодействие возникает между неполярными и полярными молекулярными. Под влиянием электрического поля, создаваемого полярной молекулой, в неполярной молекуле индуцируется диполь.
3. Дисперсионное взаимодействие возникает между неполярными молекулами. При низких температурах в молекал неполярных веществ могут возникать мгновенные диполи. Энергия ориентационного взаимодействия больше индукционного, а индукционного больше дисперсионного взаимодействия. При взаимодействии реальных молекул часто одновременно осуществляются в той или иной мере все три вида взаимодействий, а общая энергия притяжения представляет сумму ориентационного, индукционного и дисперсионного взаимодействий: Вклад каждого из членов определяется полярностью и поляризуемостью взаимодействующих молекул.
Межмолекулярные взаимодействия характеризуются отсутствием обмена электронами между частицами, отсутствием специфичности и насыщаемости. Энергия межмолекулярного взаимодействия сравнительно невелика, однако она вносит существенный вклад в энергетическое состояние системы, определяя в значительной степени физические и химические свойства вещества.
Вопрос №33. Водородная связь и ее разновидности. Биологическая роль водородной связи. Молекулярные комплексы и их роль в метаболических процессах
Водородная связь возникает между положительно поляризованным атомом водорода и отрицательно поляризованным атомом с большой электроотрицательностью.
Водородная связь бывает внутри- и межмолекулярной молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при 24°С (молекулярная формула обоих веществ С2Н6О).
Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH3OH, С2Н5ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются.
Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность.
в организме -посредством водородных связей взаимодействуют спирали ДНК и РНК, белки, формируются мембраны биологических клеток.
Дата: 2019-07-30, просмотров: 1114.