Диссоциация слабых электролитов – обратимый процесс, к которому применим закон действия масс:
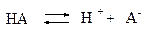
Константу равновесия процесса диссоциации называют константой диссоциации.
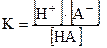
Если диссоциация протекает по ступеням, то каждая ступень диссоциации характеризуется своей константой:
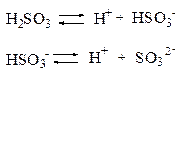
|
1-ая ступень:
2-ая ступень:
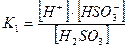
| 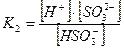
|
При этом К1>К2 , а Ксум=К1×К2.
Константа диссоциации, как и любая константа равновесия, не зависит от концентрации и является строгой характеристикой электролита при данной температуре.
Многоосновные кислоты и многокислотные основания ионизируют ступенчато. Каждая ступень ионизации характеризуется своим значением константы ионизации, причем первая ступень протекает в большей степени, чем последующие.
Способность к ступенчатой ионизации определяет способность кислот и оснований к образованию кислых и основных солей.
Многоосновные кислоты и основания диссоциируют ступенчато. Например
Н3РО4 = Н+ + Н2РО4‾
Н2РО4‾ = Н+ + НРО4‾2
НРО4‾2 = H+ + РО4 ‾3
Н3РО4 = 3Н+ + РО4-3
Диссоциация характеризуется константами для каждой стадии
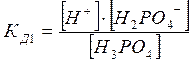
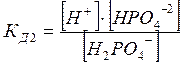
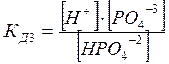
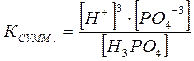
Применение ЗДМ к ионизации слабых электролитов. Константа ионизации (диссоциации).
Диссоциация слабых электролитов – обратимый процесс, к которому применим закон действия масс: 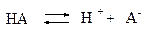
Константу равновесия процесса диссоциации называют константой диссоциации.
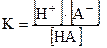
Если диссоциация протекает по ступеням, то каждая ступень диссоциации характеризуется своей константой:
|
| 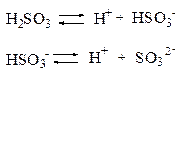
| |
1-ая ступень 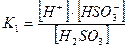
2-ая ступень: 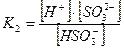
При этом К1>К2 , а Ксум=К1×К2.
Константа диссоциации, как и любая константа равновесия, не зависит от концентрации и является строгой характеристикой электролита при данной температуре. Для слабых электролитов Кдисс< 10-4.
Вопрос №21.Теория кислот и оснований (Аррениуса, Льюиса,Бренстеда-Лоури). Константы кислотности и основности. Процессы ионизации, гидролиза, нейтрализации с точки зрения различных теорий кислот и оснований. pH растворов слабых кислот, оснований, гидролизующих солей.
Теория Аррениуса
В 1884 г. С. Аррениус высказал предположение, что кислота представляет собой вещество, которое диссоциирует с образованием ионов водорода Н+ ;
Основание – вещество, которое диссоциирует в воде с образованием
гидроксидных ионов ОН-.
Эта теория является классической и до сих пор сохранила свою применимость, хотя ей присущи некоторые ограничения. Например, она не позволяет объяснить наличие основных свойств у некоторых органических веществ, таких, как триэтилами N(C2H5)3, которое не содержит группы ОН.
Теория Льюиса
В 1938 г. американский химик создал теорию, в которой понятие
“кислота” и ”основание” имеют еще более широкий смысл. Эта теория
называется электронной.
Согласно этой теории:
кислота – это вещество, которое способно образовывать ковалентную связь, акцептируя электронную пару от основания;
основание – вещество, обладающее электронной парой, способное
предоставлять ее для образования ковалентной связи с каким – либо атомом,
молекулой или ионом.
Ковалентную связь, образуемую в результате предоставления электронной пары, часто называют координационной или донорно – акцепторной связью и схематически обозначают стрелкой.
Таким образом, теория Льюиса расширяет круг кислотно – основных реакций, включая в них такие реакции, в которых вовсе не принимают участие протоны.
К основаниям Льюиса относятся галогенид – ионы, аммиак, алифатические и ароматические амины, пиридин и т.д.
К кислотам Льюиса относятся галогениды бора, алюминия, олова, фосфора, мышьяка, сурьмы, кремния; ионы – комплексообразователи Ag+ , Со3+ , Cr3+ , Pt2+ и др.
Теория Бренстеда - Лоури
В 1923 г. Бренстед и Лоури выдвинули новую теорию кислот и оснований, основанную на представлении о переносе протона (поэтому эту теорию еще называют протонной).
Согласно этой теории кислота представляет собой вещество, состоящее из молекул или ионов – доноров протонов Н+ (т.е. отдают протоны);
основание – вещество, состоящее из молекул или ионов – акцепторов
протонов Н+ (т.е. принимают протоны).
Кислота и основание по теории Бренстеда – Лоури являются сопряженными, т.е. каждая кислота имеет свое сопряженное основание. Причем, сильной кислоте всегда соответствует слабое сопряженное основание, а слабой кислоте – сильное сопряженное основание.
По протонной теории кислоты и основания бывают:
1) нейтральные кислоты: H2SO4, H2CO3, CH3COOH и др.
основания: NH3, H2O и др.
2) катионные кислоты: NH4 + , H3O+ и др.
основания: NH2NH3 + и др.
3) анионные кислоты: HSO3 - , НCO3 - , H2PO4 — и др.
основания: CO3 2- , CH3COO- и др.
Константы кислотности и основности:
Для кислот:
HA↔ H++ A-
Ka = 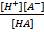
Константу диссоциации называют константой кислотности (является мерой силы данной кислоты) и обозначают Ка, а рКа показателем кислотности:
рКа=-lgКа
Чем больше рКа, тем слабее кислота.
Для оснований:
BOH↔ B++OH-
Kв= 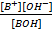
Константу диссоциации называют константой основности Кв, а рКв – показатель основности:
рКв=-lgКв
Дата: 2019-07-30, просмотров: 550.