Вопрос №4. Понятие об энтропии как мере неупорядоченности системы (уравнение Больцмана).
Каждая термодинамическая система обладает функцией состояния, называемой энтропией. Энтропия вычисляется следующим образом. Система переводится из произвольно выбранного начального состояния в соответствующее конечное состояние через последовательность состояний равновесия; вычисляются все проводимые при этом к системе порции тепла dQ, делятся каждая на соответствующую ей абсолютную температуру Т, и все полученные таким образом значения суммируются (первая часть второго начала термодинамики). При реальных (неидеальных) процессах энтропия изолированной системы возрастает (вторая часть второго начала термодинамики).
При обсуждении химических процессов удобно пользоваться определением энтропии, данным Больцманом:
Энтропия (S) пропорциональна логарифму термодинамической вероятности (W) состояния системы.
S = k ∙lnW
где k – постоянная Больцмана, а термодинамическая вероятность определяется числом микросостояний системы, которым может осуществляться рассматриваемое состояние. (Пример: зрительный зал кинотеатра).
Совершенно строго энтропия была введена в термодинамике как функция состояния, изменение которой определяется отношением количества теплоты, полученной (или отданной) системой при температуре Т, к этой температуре:
S = Q/T.
Сообщенная системе теплота идет на увеличение беспорядочного, хаотичного движения частиц, т.е. увеличивает энтропию. (Например: плавление веществ, кипение жидкостей).
Наоборот, при кристаллизации жидкости, уменьшается энергия системы и выделяется скрытая теплота плавления.
В газе частицы движутся независимо друг от друга, поэтому в газе неупорядоченность больше, чем в жидкости. В кристалле неупорядоченность меньше, чем в жидкости и в газе. Поэтому энтропия имеет наибольшее значение в газе, меньшее в жидкости и самое меньшее в кристалле.
Второе начало термодинамики утверждает:
В ИЗОЛИРОВАННОЙ СИСТЕМЕ САМОПРОИЗВОЛЬНО МОГУТ ПРОТЕКАТЬ ТОЛЬКО ТАКИЕ ПРОЦЕССЫ, КОТОРЫЕ ВЕДУТ К УВЕЛИЧЕНИЮ НЕУПОРЯДОЧЕННОСТИ СИСТЕМЫ, Т.Е. К РОСТУ ЭНТРОПИИ
Вопрос №5. Энергия Гиббса и энергия Гельмгольца как критерий самопроизвольного протекания процесса и термодинамической устойчивости химических соединений. Таблицы стандартных энергий Гиббса образования веществ.
Энергия Гиббса G = H – TS или ∆G =∆H - T∆S.
Энергия Гиббса характеризует ту часть полной энергии системы, которая может быть превращена в работу в изобарно-изотермическом (или в изохорно-изотермическом) процессе (так называемая полезная работа, совершаемая системой).
В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изобарно-изотермических условиях:
- при ∆G = 0 энергия Гиббса имеет минимальное значение; система находится в состоянии термодинамического равновесия;
- при ∆G < 0 энергия Гиббса убывает; процесс самопроизвольно протекает в прямом направлении, т.е. термодинамически возможен;
- при ∆G > 0 энергия Гиббса возрастает; самопроизвольно протекает только обратный процесс, прямой процесс термодинамически невозможен.
Д ля простых веществ, устойчивых в стандартных условиях, DG( 298 К) = 0. 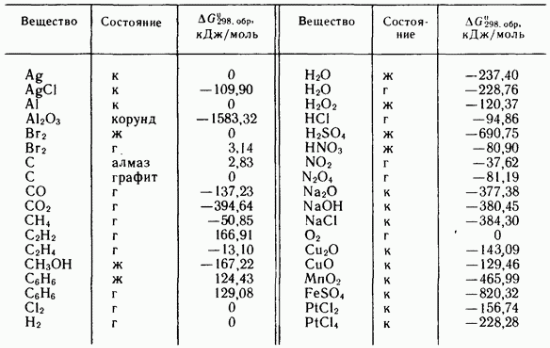
Энергия Гельмгольца A — это та часть внутренней энергии системы, также определяющая работоспособность и может быть применена для совершения максимальной работы.
Энергия Гельмгольца системы с определенной внутренней энергией (U), энтропией (S) при абсолютной температуре (Т) определяется уравнением: A = U – TS
Изменение энергии Гельмгольца для процессов (при постоянных температуре и объеме) можно определить соотношением: ΔA= ΔU – TΔS
ΔA — величина, которая не зависит от пути, а зависит только от исходного и конечного состояния системы, т.е. ΔA также, как и другие рассмотренные термодинамические величины, является функцией состояния.
Энергия Гельмгольца подобно энергии Гиббса связана с самопроизвольностью протекания процесса. Если допустить, что система изолирована, а объем и температура постоянны, то самопроизвольно будут протекать только те процессы, при которых А уменьшается.
Таким образом, при ΔA<0 процесс идет самопроизвольно в прямом направлении,
при ΔA>0 – в обратном направлении, а при ΔA=0 система находится в состоянии равновесия.
Вопрос №6. Обратимые и необратимые химические реакции и состояние химического равновесия. Качественная характеристика состояния химического равновесия и его отличие от кинетически заторможенного состояния системы.
Обратимые реакции – реакции, продукты которых взаимодействуют друг с другом и вновь дают исходные вещества.
A + B = C + D
3H2 + N2 ⇆ 2NH3
Направление обратимых реакций зависит от концентраций веществ — участников реакции. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Необратимые реакции - химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ.
2КСlО3> 2КСl + ЗО2,
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции - выпадают в виде осадка, выделяются в виде газа, например:
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
Химическое равновесие – состояние системы, при котором скорость прямой реакции равно скорости обратной реакции.
Качественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Константа скорости химической реакции является мерой реакционной способности молекул и характеризует скорость реакции при данной температуре.
реакции. Константа скорости химической реакции зависит от природы реагирующих веществ и температуры, но не зависит от концентрации реагирующих веществ.
H2+I2=2HI
V1=K1(H2)(I2)
V2=K2(HI)^2
В момент равновесия V1=V2. В момент равновесия реакции продолжают идти, но концентрации реагентов не меняются. Кинетически заторможенное состояние, когда V1,2=0( резкое понижение t примерно 200С).
Вопрос №7. Закон действующих масс (ЗДМ). Константа химического равновесия и ее связь со стандартным изменением энергии Гиббса и энергии Гельмгольца процесса. Определение направления протекания реакции в системе при данных условиях путем сравнения соотношения произведений концентраций в данных условиях и значения константы равновесия.
Зависимость скорости реакций от концентрации реагирующих веществ определяется законом действующих масс: СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ, ПРОТЕКАЮЩЕЙ ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ В ГОМОГЕННОЙ СРЕДЕ, ПРОПОРЦИОНАЛЬНА ПРОИЗВЕДЕНИЮ КОНЦЕНТРАЦИЙ РЕАГИРУЮЩИХ ВЕЩЕСТВ, ВОЗВЕДЁННЫХ В СТЕПЕНЬ ИХ СТЕХИОМЕТРИЧЕСКИХ КОЭФФИЦИЕНТОВ.
(Этот закон был сформулирован Гульдбергом и Вааге в 1867 г. И независимо от них в 1865 г русским учёным Н.И. Бекетовым).
Таким образом, для мономолекулярной реакции:
А → В, V = K ∙ C(A),
где С(А) – молярная концентрация вещества А.
Для бимолекулярной реакции:
А + В → АВ, V = K∙C(A)∙C(B);
Для тримолекулярной реакции:
А + 2В →АВ2, V = K∙C(A)∙C2(B).
Приведённые уравнения называются кинетическими уравнениями химических реакций.
Физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратимой реакции при данной температуре и концентрациях всех реагирующих веществ, равных 1моль/л.
Энергию Гельмгольца и энергию Гиббса в стандартных состояниях можно связать с константой равновесия:
ΔG0Т = ΔH0Т – TΔS0Т = —RTlnK,
Где R– универсальная газовая постоянная, K – константа равновесия, Т – абсолютная температура.
Если K>>1, т.е. реакция идет в прямом направлении, то ΔG0˂˂0.
Если K<<1, т.е. реакция идет в обратном направлении, то ΔG0>>0
Если K=1, то ΔG0=0
В случае химической реакции, протекающей в гальваническом элементе при стандартных условиях ΔG0 можно связать с ЭДС гальванического элемента следующим соотношением:
ΔG0=-nFE0, где
nF – количество прошедшего электричества
E0 – электродвижущая сила, при условии что все вещества, принимающие участие в реакции, находятся в стандартном состоянии.
При самопроизвольном протекании процесса, его ΔG<0, а ЭДС>0.
Порог реакционной способности веществ для большинства реакций имеет значение ΔG0≈41 кДж/моль.
То есть, если ΔG0<-41 кДж/моль, то процесс осуществим,
если ΔG0>+41 кДж/моль, то процесс неосуществим в любых реальных и стандартных условиях.
Последний тезим почитаейте на этом сайте, я не до конца понимаю, что требуют - http://alnam.ru/book_eq_chem.php?id=48
Дата: 2019-07-30, просмотров: 474.