Для создания множественных вставок коротких или протяженных последовательностей нуклеотидов в исследуемых участках ДНК используют два подхода.
В первом случае с помощью панкреатической ДНКазы в низких концентрациях в присутствии ионов Mn2+ вносят случайным образом один двухцепочечный разрыв в каждую векторную плазмиду , содержащую клонированный ген. К концам образовавшихся линейных молекул ДНК присоединяют с помощью ДНК-лигазы синтетические олигонуклеотидные линкеры, содержащие сайт рестрикции, который отсутствует в исследуемой плазмиде. Образовавшиеся линейные молекулы ДНК с линкерами обрабатывают рестриктазой, узнающей сайт рестрикции линкера, что приводит к образованию "липких" концов, и замыкают в кольцо с помощью ДНК-лигазы. В итоге кольцевые молекулы ДНК содержат исследуемый клонированный ген, в котором имеется по одной вставке локализованных случайным образом (в соответствии с расположением исходных двухцепочечных разрывов) олигонуклеотидных линкеров.
Во втором случае статистические разрывы в двухцепочечной ДНК получают путем частичного гидролиза мелкощепящими рестриктазами, которые узнают сайт рестрикции длиной в 4 нуклеотида. Метод получения вставок с использованием синтетических олигонуклеотидных линкеров получил название сканирования линкером .
Способы получения замен нуклеотидов (дезаминирование цитозина, включение аналогов нуклеотидов и др.). Проведение мутагенез ДНК in vitro с помощью олигонуклеотидов заданной последовательности.
Аналоги оснований по молекулярной структуре очень похожи на основания, нормально входящие в цепи ДНК. Эти соединения приводят к мутациям потому, что они могут существовать в альтернативных (таутамерных) состояниях. В каждом из двух состояний аналоги спариваются с разными нормальными основаниями, в результате чего может произойти их замена. Например, 5-бромурацил в нормальном состоянии спаривается с аденином, в более редком таутамерном состоянии- с гуанином. В связи с этим 5-бромурацил индуцирует транзицию (мутация, обусловленная заменой азотистого основания в молекуле нуклеиновой кислоты.), когда включается в ДНК в одном состоянии, затем в следующем раунде репликации ДНК превращается в более редкую таутамерную форму.
Другим широко известным аналогом оснований является 2-аминопурин. Ряд химических агентов действуют как мутагены, непосредственно модифицируя химическую структуру и свойства оснований. К ним относятся дезаминирущие, гидроксилирующие и алкилирующие агенты.
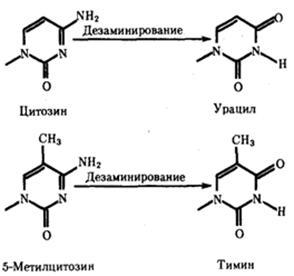
Азотистая кислота (HNO2) осуществляет окислительное дезаминирование, т.е. удаляет аминогруппы (-NH2) из таких оснований, как гуанин, цитозин и аденин. В результате дезаминирования гуанина азотистой кислотой образуется ксантин, но, так как это пуриновое основание имеет тот же тип спаривания, мутация не проявляется. Однако когда модифицируется цитозин, получается урацил (который спаривается с аденином). В итоге происходит транзиция от C-G к Т-А в ходе акта репликации. Аналогичным образом азотистая кислота модифицирует аденин в гипоксантин- основание, спаривающееся с цитозином, а не с тимином, что продуцирует транзицию А-Т в G-C.
Другим мутагеном, модифицирующим основания, является гидроксиламин (NH2OH), который специфически реагирует с цитозином, добавляя гидроксильную группу (-OH), в результате чего он спаривается уже с аденином, а не с гуанином. Таким образом, обработка гидроксиламином индуцирует транзиции C-G в Т-А. Метилметансульфонат алкилирует гуанин, т.е. добавляет группы –CH3 или –CH2CH3 к кислороду в 6-й позиции, в результате чего образуется О6-алкилгуанин или О6-мтилгуанин. Метилированный гуанин будет спариваться с тимином, а не с цитозином, давая транзицию G-C в А-Т.
Дата: 2019-05-28, просмотров: 375.