Опти́ческое волокно́ — нить из оптически прозрачного материала (стекло, пластик), используемая для переноса света внутри себя посредством полного внутреннего отражения. Оптическое волокно, как правило, имеет круглое сечение и состоит из двух частей — сердцевины и оболочки. Для обеспечения полного внутреннего отражения абсолютный показатель преломления сердцевины несколько выше показателя преломления оболочки. Сердцевина изготавливается из чистого материала (стекла или пластика) и имеет диаметр 9 мкм (для одномодового волокна), 50 или 62,5 мкм (для многомодового волокна). Оболочка имеет диаметр 125 мкм и состоит из материала с легирующими добавками, изменяющими показатель преломления. Например, если показатель преломления оболочки равен 1,474, то показатель преломления сердцевины — 1,479. Луч света, направленный в сердцевину, будет распространяться по ней, многократно отражаясь от оболочки.
Прастите.
Засовывая вектор в клетку, ученый может хотеть двух разных вещей:
1. чтобы происходила только транскрипция гена-вставки (то есть, синтез РНК на матрице ДНК — например, этого достаточно, если в клетку вносится какая-нибудь некодирующая РНК);
2. чтобы происходила и транскрипция, и трансляция гена-вставки (то есть, экспрессия кодируемого вставкой белка).
В первом случае вектор называется транскрипционным, во втором — экспрессионным. Экспрессионные векторы обычно немного сложнее транскрипционных, потому что в них присутствуют:
1. Консенсусная последовательность Козак. Это длинное имя носит короткий (примерно в 10 нуклеотидов) фрагмент в самом начале молекулы матричной РНК, который через белки-посредники обеспечивает связывание этой мРНК с рибосомой (без чего, как нетрудно догадаться, синтез белка невозможен). Последовательность Козак характерна только для эукариот, причем у представителей разных видов она немного отличается. Поэтому, создавая экспрессионный вектор, надо вставлять в него последовательность, которая характерна именно для того живого существа, в клетки которого мы собираемся вставлять вектор. Кроме того, последовательность Козак бывает сильной и слабой — то есть, приводящей к синтезу большого или малого количества белка. У прокариот роль последовательности Козак выполняет последовательность Шайна-Дальгарно, которая непосредственно (в смысле — без посредников, в отличие от последовательности Козак) соединяется с рибосомой, после чего и начинается синтез белка;
2. Последовательность Козак находится перед вставляемым геном. А после него должны находиться еще несколько коротких участков, к которым присоединяются белки, выполняющие полиаденилирование — пришивание к концу свежесинтезированной РНК полиаденинового хвоста. Этот хвост выполняет несколько функций, в том числе, обеспечивает экспорт РНК в цитоплазму и помогает организации трансляции — то есть, если мы хотим обеспечить синтез белка на основе нашей РНК, нам без него не обойтись;
3. мРНК, которая служит матрицей для синтеза белка, может быть транскрибирована только и исключительно РНК-полимеразой II типа. Поэтому нам нужно вставить в плазмиду именно тот промотор, который работает с этой РНК-полимеразой.
Создан еще один вид фагового вектора – фагмиды. Представляют собой фаговые векторы. Они созданы на основе плазмид, в которые встроен репликатор фагов содержащий 1 нить ДНК. И если такой плазмидой, содержащей репликатор фага, содержащего нитевидную ДНК, ввести в бактериальную клетку и одновременно заразить интактную фагом F1,то данная плазмида (фагмида) будет реплицироваться по типу фаговой репликации и включаться в белковую оболочку ,которая возникает за счет репродукции вот этого интактного фага ,фага помощника. И на ряду с образованием нормальных фаговых частиц F1 будут формироваться фаговые частицы содержащие однонитевую плазмидную ДНК. Таким образом фагмиды позволяют получать однонитевые ДНК содержащие сегмент чужДНК . Это удобно для создания так называемых меченных зондов. Но можно получить и в виде двунитевых молекул, тогда надо получить однонитевую молекулу из этих фагов in vitro,с помощью достройки комплемментарной 2-ой нити. Так что, фагмиды позволяют получать гибридные ДНК в виде однонитевой и двунитевой ДНК, но с использованием системы синтеза белка in vitro.
Векторы, совмещающие в себе элементы нитевидного фага и плазмиды. Впервые фагмиды созданы в 1981 г.
(a) При этом по EcoRI-участку плазмиды pBR322 был встроен фрагмент репликативной формы нитевидного фага f1 размером 1.3 т.п.н., который включает все элементы генома, необходимые для репликации и морфогенеза фага и получена фагмида pD4. При инфицировании культуры E. coli, содержащей pD4, неизмененным фагом f1, около половины секретируемых вирусных частиц несут одноцепочечную ДНК фагмиды. Вторая половина несет одноцепочечную ДНК фага f1.
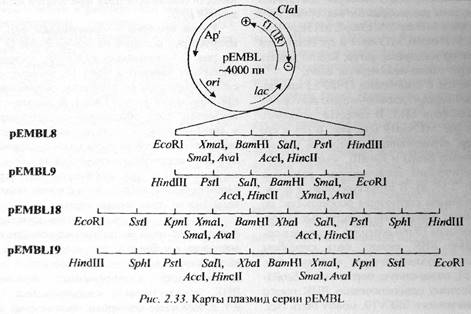
(б) Фрагмент генома фага f1 был перенесен в плазмиду pUC, не нарушая при этом ее генетических детерминант. Так была создана фагмида pEMBL. В зависимости от ориентации вcтроенного фрагмента чужДНК в фагмиде, секретируемые вирусные частицы впоследствии несут в своем капсиде либо +-, либо –-цепь фагмиды pEMBL.
24. Альтернативные пути и этапы репликации бактериофага λ (лямбда). Литический цикл, лизогенный путь.
Репликация фага лямбда на стадии его внутреклеточной репродукции довольно сложный процесс начинается в одной точке, обычной оri- репликации и распространяется в 2-х противоположных направлениях.
Репликация с начала идет по типу тета-репликации, а на завершающих стадиях переходит на репликацию по типу катящегося кольца ибо формируются конкотемерные ДНК фага λ, которые могут возникать и другим способом, по скольку линейные молекулы геномные ДНК фага λ имеют липкие концы, комплементарные, то они могут соединяться друг с другом без участия рекомбинационной системы клетки формировать структурные геномные структуры типа конкотемеров.
Процесс созревания фаговых частиц у фага λ напоминает таковой у фага Т4: идет разобщенный синтез предшественников фагов, белковых и нуклеиновых компонентов, а затем на завершающей стадии в силу механической сборки формируются полноценные фаговые частицы и процесс репродукции завершается в некоторых случаях при одном типе репродукции- лизисом клетки, высвобождением фагового потомства во внешнюю среду, лизис осуществляется ферментом типа фагового лизоцима, который характеризуется высокой специфичностью и эффективностью и детерминируется продуктом гена R.
Молекула геномной ДНК фага λ нарезается на отдельные геномы по cos-сайтам ферментом терминазой и сам процесс нарезания именуется терминазной реакцией, которая обеспечивается ферментом продукта фагового гена А.
Схема: процесс обр-ния фаговых частиц. Конкотемерные ДНК фага λ режется по cos-сайтам ферментом терминазой с последующей упаковкой отрезанных геномов. И потом после заполнения пустотелой фаговой предголовки имеет место соединение с остальными белками фаговой частицы, с белками хвоста, с белками нити формируются полноценные вирионы фага λ.
Интересной особенностью процесса созревания у фага λ является необходимость присутствия ДНК в виде конкатемеров, если конкатемеры не образуются, то упаковка фаговых геномов не осуществляется и полноценные фаговые частицы не формируются. Если клетка заражается фагом λ в условиях препятствующих формированию кокнатемеров, ну различного рода моделирующие соответствующие условия, то созревание фаговых частиц не наступает.
Модель.
Здесь уместно остановится на терминазной реакции и на тех фактах, которые объясняют процесс упаковки фаговой ДНК фага λ в формирующуюся головку. Схема организации cos-сайтов и участия некоторых генов в процессе упаковки и структура, именуемая порталом фага λ, которыми соединяет головку с хвостовым отростком и участвует в упаковке ДНК.
Терминация детерминируется 2-мя генами: ген Nu1 и А. Первый ген детерминирует малую субъединицу терминазы, второй- большую. Ген В детерминирует структуру белка-портала, ген Q участвует в детерминации структур необходимых для процесса соединения головки с хвостом, детерминирует структуру акцепторных или дополнительных белков. Ген С представляет собой компонент капсида, вовлекаемый в образование коннектора-- структур соединяющий головку с хвостом.
Cos-сайт представляет собой тройственную структуру и состоит из cos-Q, cos-N и cos-B.– Cos-Q – последовательность необходимая для терминации процесса упаковки, cos-N – сайт, где осуществляется никирование конкотемерной ДНК в области кос-сайта, ступенчато-обратный разрез с образованием липких концов на окончаниях молекулы геномной ДНК. Сos-B сайт подразделяется на несколько областей именуемых R1, R2, R3, которые являются сайтами связывания с малой субъединицы терминазы, а область I1- для взаимодействия с фактором интеграции клетки-хозяина, который необходим в процессах лизогенизации.
Каким образом осуществляется терминазная реакция? Терминатор соединяется со случайно встречаюцимся cos-сайтом и вводит ступенчатообразные разрезы, обозначаемые N1 и N2, при этом формируются концы геномных ДНК фага λ: левый и правый конецы. Терминатор соединяется с левым концом выступающего конкотемера и формируется временный комплекс – комплекс1, состоящий из теминазы и фаговой ДНК.Этот комплекс приводит к образованию тройственного комплекса, более стабильного, состоящего уже из предголовки, терминазы и упаковывающейся ДНК. При этом левый конец, отрезанный уже от конкотемера, проникает в предголовку и с участием естественно, гидролиза АТФ для высвобождения свободной энергии необходимой для осуществления этого процесса, до следующего сos-сайта.
Развитие умеренных фагов (лизогения) подробно охарактеризовано для колифага λ. Это сложный фаг, содержащий линейную двухцепочечную ДНК. На 5/-конце каждой ее цепи имеется одноцепочечная последовательность из 12 нуклеотидов – липкие концы (cos-сайты). Сразу же после проникновения фаговой ДНК в бактериальную клетку, липкие концы ДНК ковалентно соединяются ДНК-лигазой клетки-хозяина и образуется кольцевая молекула.
Далее, как правило, эта кольцевая молекула бактериофаговой ДНК не приступает к транскрипции, а встраивается в бактериальную хромосому. Установлено, что гены фага λ кодируют синтез четырех регуляторных белков, один из которых репрессорный белок сI (кодируется геном сI) блокирует развитие событий литического цикла, а антирепрессорный белок Cro (кодируется геном сro), наоборот, запускает их. После поступления ДНК фага λ в клетку, выбор между литическим и лизогенным путями развития зависит от относительной скорости накопления регуляторных белков: если преобладает антирепрессорная функция белка Cro, то развиваются события литического цикла, если успевает проявиться функция репрессорного белка сI, литический цикл не осуществляется, так как белок сІ связывается с ДНК фага λ в особых участках, препятствуя транскципции фаговых генов.
Встраивание ДНК фага λ в бактериальную хромосому осуществляется согластно интегративной модели А.Кемпбелла. Этот процесс называется сайт-специфической рекомбинацией, так как встраивание ДНК фага λ осуществляется в одном и том же месте (сайте) между генами gal и bio и не зависит от rec A-системы бактериальной клетки.
За интеграцию ДНК фага λ ответственен фермент лямбда-интеграза. Этот фермент узнает две разные последовательности – одну в хромосомной ДНК (att λ), а другую в ДНК фага (b2). Затем происходит разрыв обеих молекул ДНК и последующее их перекрестное воссоединение.
После этого ДНК фага λ реплицируется с клеточной ДНК как единая структура, и все дочерние клетки при делении получают копию фаговой ДНК в составе хромосомы. Подобные клетки называются лизогенными, а ДНК фага λ в них – профагом.
Состояние лизогении поддерживается благодаря постоянному образованию белка-репрессора сІ, и довольно неустойчиво: в любой момент может произойти переключение на литический путь из-за проявления антирепрессорных функций белка Cro. Показано, что в популяции лизогенных бактерий в одной из 102 – 105 клеток происходит спонтанная индукция профага и запускается литический цикл, а такие клетки подвергаются лизису. Эффективность данного процесса зависит как от состояния бактерии-хозяина, так и действия разнообразных физических и химических факторов. Индукторами перехода лизогения ↔ литический цикл являются ультрафиолетовое излучение, митомицин С, алкилирующие агенты, для некоторых фагов также и изменение температуры.
Явление индукции профага очень важно учитывать при составлении многокомпонентных заквасок для получения молочнокислых продуктов. Если среди штаммов, входящих в такие закваски окажутся лизогенные и нелизогенные, но чувствительные к фагу, обусловившему лизогению бактерий, то произойдет явление фаголизиса (т.е. гибели клеток), очень опасное для молочной промышленности.__ Следует отметить, что фаголизис может быть обусловлен и вирулентными фагами, попадающими в технологические потоки при плохой организации производства. Явление фаголизиса так же может наблюдается и в процессе микробного синтеза аминокислот, что значительно снижает рентабельность этих отраслей биотехнологии.
Таким образом, умеренные бактериофаги могут находиться в трех состояниях:
- в свободном состоянии в виде частиц – вирионов;
- в состоянии профага;
- в вегетативном (активном) состоянии, когда бактериофаг способен вызывать лизис бактериальной клетки
25. Клонирование рекомбинантных ДНК с помощью векторов на основе бактериофага (лямбда)
Штамм бактерии, лизогенный по какому-то умеренному фагу, обозначают по принципу: E. coli С600(λсI857), где в скобках – штамм лизогенирующего фага. Геном фага λ можно разделить на 3 основные части:
(1) сектор, включающий все гены (от Nu1 до J), белковые продукты которых необходимы для формирования капсида и упаковки в них молекул ДНК.
(2) сектор между J и N несущественен для литического развития фага. Этот сектор содержит ген, участвующие в сайтспецифической интеграции ДНК фага в бактериальную хромосому (int) и исключение профага из хромосомы (xis).
(3) Сектор остальных контролирующих элементов, включая гены, необходимые для репликации фаговой ДНК (O и P) и для лизиса клеток (S и R).
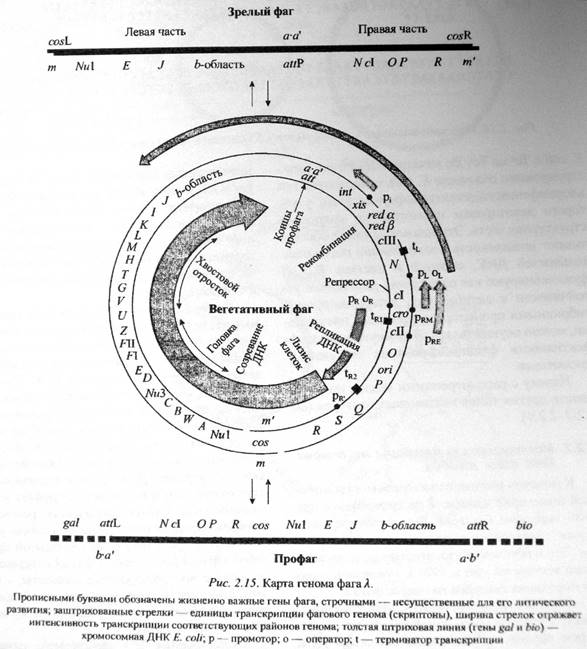
Район GC-богатых липких концов, длиной по 12 нукл. (cosR и cosL) называется cos-сайтом.
При размножении фага в клетке, его ДНК находится в конкатемерной форме – т.е. несколько полных фаговых геномов соединены в одну молекулу ДНК. Белки Nu1 и А связываются с cos-сайтами на такой конкатемерной молекуле и обеспецивают ее нарезание на одельные геномы, с образованием «липких» концов. ДНК пакуется в головку, а затем происходит присоединение хвостового отростка.
В геноме фага λ и имеется 5 мест расщепления для EcoRI, причем 3 из них находятся в области генов, несущественных для литического развития фага. Для HindIII имеется 6 мест узнавания, их них 5 – в области, несущественных для развития фага.
Встройка фрагментов чужДНК по сайтам рестрикции ограничена размером генома фага: жизнеспособность «гибридного» фага резко снижается, если размер его ДНК составляет более 105 или менее 78% размера ДНК фага дикого типа. Размер ДНК гибридных фагов должен находиться в пределах 38-51 т.п.н.
Упаковка ДНК фага лямбда в капсид in vitro. При использовании фага лямбда в качестве вектора часто применяют способ искусственной упаковки первоначально голой ДНК в капсиды. При этом берется ДНК мутантов фага, не способных образовывать полноценные фаговые частицы, т.к. имеют дефекты генов, кодирующих белки капсида. Ее смешивают с белковыми экстрактами клеток, в которых развивался фаг. В результате этого происходит самосборка инфекционных частиц, при которой незадействованные (пустые) капсиды с помощью ферментов фага включают фаговую ДНК. Значение этого метода в том, что в капсид упаковываются только молекулы ДНК, размер которых приблизительно равен размеру фагового генома. Побочные генно-инженерные продукты в капсид не упаковываются.
Векторы на основе λ делят на векторы внедрения и векторы замещения.
Векторы внедрения имеют на ДНК одно место действия для данной рестриктазы. Если при встройке экзогенной ДНК в этот сайт происходит нарушение какого-нибудь исходого гена, отбор гибридных клонов идет как процесс выявления соответсвующих фаговых мутаций.
Пример: векторный фаг λplac5-1. При встройке экзогенной ДНк по единственному месту действия EcoRI нарушается ген β-галактозидазы (lacZ), и это легко детектируется в тесте титрования фагов на газоне E.coli lacZ- (штамм, не способный сбраживать лактозу) на чашках с индикаторным красителем. β-галактозидаза катализирует расщепление лактозы на глюкозу и галактозу, что приводит к закислению окружающей среды. Изменение pH выявляется на питательной среде с лактозой и краистелем бромкрезоловым пурпурным. Исходный фаг λplac5-1 сбраживает лактозу, и бляшки, образуемые им, имеют желтое окрашивание. Гибридные фаги на основе λplac5-1 теряют β-галактозидазную активность, и формируют бляшки без изменения цвета.
Векторы замещения имеют 2 или более мест действия рестриктаз на молекуле фаговой ДНК.
Векторы замещения 1-го поколения. Заключенный между местами рестрикции фрагмент векторной ДНК замещается экзогенной ДНК. При этом происходит удаление нескольких генов фага, что детектируетс генетическими методами. Удаляться могут только гены, несущественные для литического развития фага (область от J до N).
Пример: вариант фага λ, в который можно встраивать фрагменты размером до 24 т.п.н., что составляет примерно ½ всей гибридной фаговой ДНК.
Векторы замещения 2-го поколения. У них замещаемые фрагменты ДНК с двух сторон ограничены искусственными полилинкерами, содержащими участки узнавания нексольких различных рестриктаз. Например, широко используется в лабораториях векторный фаг λEMBL12, содержащий в полилинкерах места узнавания для 6 рестриктаз.
Векторы замещения 2-го поколения позволяют встраивать фрагменты размером до 23 т.п.н. (1 т.п.н. идет на полилинкеры). Это дает возможность создавать на их основе библиотеки генов (= клонотеки, = геномных библиотеки). При этом геном изучаемого организма расщепляется на фрагменты «средне» щепящими рестриктазами (обычно Sau3AI и MboI). Перед встройкой в ДНК фага полученных фрагментов, среди них отбирают только фрагменты протяженностью 15-20 т.п.н., путем электрофоретического фракционирования. Таким образом избегают встройки в ДНК фага двух или более несоседних в геноме фрагментов. При встройке 2 и более фрагментов размер гибридной ДНК будет превышать предельно допустимый: удобным инструментом при этом является упаковка ДНК в капсид. При упаковке ДНК в капсид in vitro произосходит отбор гибридных молекул размером от 38 до 51 т.п.н.
Фрагменты ДНК в клонотеке можно идентифицировать по их порядку расположения в геноме, и при условии последовательного покрытия всего генома, такое собрание штаммов фага лямбда называют энциклопедией генов. Для этого используют векторы замещения 2-го поколения типа λDASH. Как оказывается, число клонов гибридной ДНК в энциклопедии гораздо меньше, чем в библиотеке, т.к. исключены крупные участки перекрывания и разного рода посторы. Например, для создания полной энциклопедии генов E. coli пришлось проанализировать 3400 гибридных клонов, а уже сформированная энциклопедия содержит 381 клон. Тем не менее, хранение целых генов в фаговых векторах не всегда возможно, т.к. многие гены гораздо длиннее, чем 23 т.п.н.
26 Конструирование космид и клонирование в них длинных фрагментов чужеродной ДНК.
Фаговые векторы позволяют клонировать фрагменты ДНК длиной 15-25 т.п.о. этого недостаточно для клонирования генов животных и растений, длина которых превышает 35-40 т.п.о. Требуемой емкостью обладают векторные молекулы, называемые космидами
Космиды представляют собой небольшие плазмиды, в которые in vitro введены cos-сайты ДНК фага лямбда. Отсюда происходит название всего типа данных векторов (cosmid). В ДНК нормальных фаговых частиц cos-сайты расположены на концах молекул, они разделяют мономеры фаговой ДНК в конкатемерах, объединяющих несколько соединенных "голова к хвосту" мономеров, которые являются предшественниками зрелых фаговых ДНК перед упаковкой в фаговые частицы. В таких конкатемерах соседние cos-сайты располагаются на расстоянии 35-45 т.п.о. друг от друга и заключают между собой весь фаговый геном. В процессе упаковки cos-сайты узнаются компонентами ферментативной системы и по ним происходит последовательное отрезание упакованной в фаговую частицу лямбда-ДНК от остальной неупакованной ДНК конкатемера.
Наличие cos-сайтов в ДНК является единственным необходимым условием упаковываемости ДНК в фаговые частицы. Это означает, что последовательность нуклеотидов лямбда-ДНК, расположенная между двумя cos-сайтами, которая заключает в себе весь фаговый геном (35-45 т.п.о.), может быть замещена in vitro на аналогичный по длине фрагмент чужеродной ДНК и упакована в фаговые частицы. Такая искусственная фаговая частица оказывается нежизнеспособной. Однако после адсорбции химерной фаговой частицы на поверхности бактериальной клетки заключенная в ней ДНК проникает (вводится фаговой частицей) внутрь бактерии и начинает автономно реплицироваться как плазмида, размер которой составляет 30-40 т.п.о. Поскольку такая плазмида (космида) содержит в своем составе селектируемые маркеры в виде генов устойчивости к антибиотикам, ее поддерживают в бактериальных клетках путем выращивания бактерий на среде с соответствующими антибиотиками. Несмотря на то, что емкость космидных векторов значительно выше фаговых, эффективность клонирования в космидах ниже, хотя и достигает в ряде случаев 105-106 колоний на 1 мкг клонируемой ДНК. При такой эффективности упаковки требуется всего лишь 2-4 мкг клонируемой ДНК для получения полной клонотеки большинства эукариотических геномов.
Стадия упаковки ДНК космид в фаговые частицы используется лишь для облегчения процесса введения рекомбинантных ДНК большого размера внутрь бактериальных клеток. Такой процесс имитирует проникновение фаговой хромосомы в бактерии во время фаговой инфекции. В случае космид сходство между их проникновением в бактериальные клетки и фаговой инфекцией на этом заканчивается.
27 Синтез и клонирование комплементарных ДНК (кДНК) с помощью фермента обратная транскриптаза.
Обратную транскриптазу преимущественно используют для транскрипции матричной РНК в комплементарную ДНК (кДНК) (рис. 9). Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. В качестве праймера при обратной транскрипции поли (А)-содержащих мРНК используют олигo (dT), а для молекул РНК, не имеющих 3'-поли (А) концов,
— химически синтезированные олигонуклеотиды, комплементарные 3'-концу изучаемой РНК. После синтеза на мРНК комплементарной цепи ДНК и разрушения РНК (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера. Матрицей служит первая цепь кДНК. Данная реакция может катализироваться как ревертазой, так и ДНК-полимеразой I E . c oli. Показано, что сочетание этих двух ферментов позволяет повысить выход полноценных двухцепочечных молекул кДНК. По окончании синтеза первая и вторая цепи кДНК остаются ковалентно связанными петлей шпильки, служившей праймером при синтезе второй цепи.

Рис. 9. Схема синтеза двухцепочечных ДНК- копий молекул РНК.
Эту петлю расщепляют эндонуклеазой S1, специфически разрушающей одноцепочечные участки нуклеиновых кислот. Образующиеся при этом концы не всегда оказываются тупыми. Для повышения эффективности последующего клонирования их репарируют до тупых с помощью фрагмента Кленова ДНК-полимеразы I E. coli. Полученную двухцепочечную кДНК можно затем встраивать в клонирующие векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований
28 Использование приема «прогулок по хромосомам» для клонирования и анализа длинных фрагментов ДНК.
«Прогулка» по хромосоме (chromosome walking)— метод анализа протяженных нуклеотидных последовательностей вокруг секвенированных участков генома с использованием «блуждающих» праймеров, который заключается в последовательном отборе клонов, содержащих частично перекрывающиеся фрагменты ДНК из определенного района генома. На первом этапе проводят скрининг библиотеки генов с помощью маркерной ДНК, сцепленной с определенным геном. После нахождения положительных клонов последние сами служат зондами для изоляции других клонов, содержащих перекрывающиеся нуклеотидные последовательности ДНК. Т. обр., каждый раз отобранный фрагмент используется в качестве скринирующего ДНК-зонда для последующего поиска. В результате получают набор клонированных фрагментов ДНК, полностью перекрывающих область поиска гена. Группа подобных клонов носит название «контигов». С помощью физического картирования инсерционных ДНК в разных клонах удается точно установить степень перекрывания между соседними фрагментами и соответственно упорядочить положение клонов в контигах. В результате прогулок по хромосомам с помощью перекрывающихся нуклеотидных последовательностей анализируются неизвестные протяженные участки генома, прилегающие друг к другу. Одним из вариантов метода прогулок по хромосомам является метод «прыжков по хромосоме»
Дата: 2019-05-28, просмотров: 553.