При малых концентрациях содержание Мо(VI) в водных растворах определяли спектрофотометрическим методом с роданидом калия.
Методика заключалась в следующем: отбирали V1 мл анализируемого раствора, переносили в мерную колбу емкостью V2 мл, объем доводили до метки дистиллированной водой. Через 10 мин. Отбирали аликвоту объемом V3 мл и переносили в мерную колбу объемом 50 мл, в которую добавляли нижеследующие растворы в указанной очередности:
· 12,5 мл раствора серной кислоты H2SO4 (1:2);
· 1,75 мл 1 % раствора (NH4)FeSO4;
· 3 мл 2 % раствора CuSO4;
· 10 мл 10 % раствора тиомочевины: CS(NH2)2;
· Через 5мин. 3 мл 50% раствора роданида калия (KCNS).
После добавления каждого реагента раствор тщательно перемешивали и содержимое колбы доводили до метки дистиллированной водой.
Аналогично готовили «холостой» раствор. Полученные растворы выдерживали 15 мин, после чего фотоколориметрировали на фотокалориметре КФК-3, при длине волны = 440 нм, толщина стеклянных составляла 10 мм.
Расчет концентрации Mo(VI) в анализируемом растворе проводили по уравнению: Ci=0,0093∙Di, R=0,998, рассчитанному по методу наименьших квадратов на основании предварительно построенного линейного колибровочного графика, представленного на рис. 1.
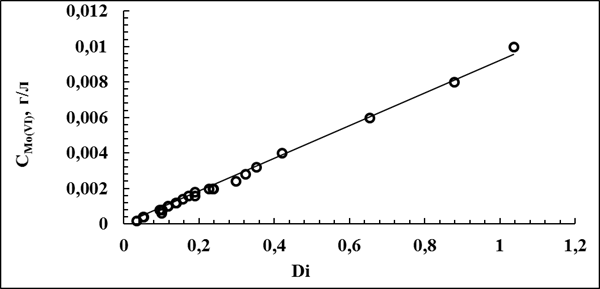
Рис.2.2. Калибровочная кривая для определения концентрации Мо( VI ) в растворе.
В стандартных растворах концентрацию Мо определяли гравиметрическим методом (определение в форме триоксида MoO3). Для этого осадок трисульфида молибдена вместе с бумажным фильтром высушивали в тигле и затем осторожно обугливали в пламени горелки Бунзена; после этого тигель помещали в муфельную печь. Прокаливали при температуре 600ºС (чтобы избежать значительных потерь МоО3). Переход трисульфида в триоксид молибдена заканчивается через 60 мин.
Осаждение трисульфида молибдена проводили следующим образом: Аликвоту раствора (20 мл, ~1 г/л) помещали в мерный стакан, приливали 6 мл 2 M раствора Na2S, затем избыток 2 H HCl до исчезновения окраски и выпадения осадка, раствор с осадком доводили до кипения, затем остужали и фильтровали через бумажный фильтр (белая лента). С фильтратом повторно проделывают операцию осаждения.
Определение концентрации Al в водных растворах
Концентрацию Al в водных растворах определяли титриметрическим методом. Метод основан на образовании комплексного соединения Al с Трилон-Б, последующем его разрушении фтористым натрием и титрованием освободившегося раствора Трилон-Б, эквивалентного количеству алюминия, раствором ацетата цинка. Одновременно образующиеся комплексные соединения Mg, Ca, Ti и Fe с Трилон-Б не разрушаются фторидом натрия и не мешают определению.
Аликвоту анализируемого раствора (Vал=2-5 мл) помещают в коническую колбу вместимостью 100 мл и добавляют от 5 до 20 мл Трилона Б (избыток). Раствор кипятят 1-2 мин, охлаждают. Затем прибавляют 1-2 капли раствора ксиленолового оранжевого, при этом раствор становится желтым. Затем по каплям добавляют раствор гидроксида аммония до перехода окраски раствора из желтой в фиолетовую (если раствор после добавления ксиленолового оранжевого становится сразу фиолетовым добавление NH4OH не требуется). Далее прибавляют по каплям раствор соляной кислоты до перехода окраски из фиолетовой в желтую (рН раствора становится равным 5,8). К раствору приливают 5 мл буферного раствора, кипятят 2-3 мин, быстро охлаждают в проточной воде и избыток Трилона Б титруют раствором ацетата цинка до перехода окраски раствора из желтой в фиолетовую (ярко-красную):
Формула для расчета концентрации Al:
C(Al) = (C(Zn(C2H3O2)2)·V(Zn(C2H3O2)2))/VАЛ, (М), (3)
где C(Zn(C2H3O2)2) – концентрации ацетата цинка (0,05 М); V(Zn(C2H3O2)2) – объем ацетата цинка, пошедшего на второе титрование (на титрование вытесненного Трилона Б, после добавления NaF), мл.
Дата: 2019-04-23, просмотров: 390.