Выбор эффективных экстрагентов для извлечения молибдена определяется состоянием элемента в водных растворах. Наиболее пригодны для экстракции молибдена из технологических растворов анионообменные экстрагенты.
По реакции анионного обмена молибден из щелочных, нейтральных и слабокислых растворов может быть экстрагирован солями четвертичных аммониевых оснований, из нейтральных и слабокислых растворов алкиламинами.
Экстракционному извлечению Мо из растворов различных кислот солями аминов посвящено большое количество исследований. Экстракция металлов солями замещенного алкиламмония может протекать из слабокислых и кислых растворов как по реакции обмена анионного комплекса металла с анионом соли амина, так и по реакции присоединения соли амина [20].
В работе [21] изучено влияние строения и степени замещения солей алкиламмония на их экстракционные свойства. По экстракционной способности алкиламины можно расположить в следующий ряд: третичные > вторичные > первичные, что объясняется уменьшением основности в данном ряду.
Наибольшей экстракционной способностью обладают третичные амины с неразветвленными радикалами, содержащими 8-10 атомов углерода.
Значительное влияние на экстракционные свойства аминов оказывает природа применяемого разбавителя. Так при экстракции триоктиламином из сульфатных растворов коэффициент распределения молибдена уменьшается в ряду: ксилол>бензол>нитробензол>>н-гептан>четыреххлористый углерод.
В случае галогенводородных кислот снижение экстракционной способности аминов находится в соответствии с усилением электрофильных свойств разбавителя, а, следовательно, и способностью их сольватировать анион соли амина. Для сульфатных растворов такая зависимость не наблюдается.
Влияние природы минеральной кислоты и ее концентрации в водной фазе на извлечение молибдена аминами установлено, что из азотнокислых растворов Мо экстрагируется хуже, чем из сернокислых и солянокислых растворов. Усиление конкурирующего влияния анионов в ряду: SO42-<С1-<NО3- связано с различной степенью гидратации анионов и их конкурентной соэкстракций солью амина [22].
Механизм экстракции аминами и состав экстрагируемых соединений зависят от состояния молибдена и вольфрама в растворе. При увеличении кислотности водной фазы изменяется состав соединений как в водной, так и в органической фазах. Происходит резкое увеличение коэффициентов распределения Мо, максимальные значения которых наблюдаются в интервале рН=2-3. При высоких концентрациях металлов экстракция протекает с образованием в органической фазе соединений: (kat)пH6-nMо7O24, (kat)nH4-nMо8O26. Увеличение степени полимеризации анионов сопровождается уменьшением удельного заряда и соответственно энергии гидратации анионов, что приводит к увеличению коэффициентов распределения металлов при анионообменной экстракции.
При рН<2 молибден образует катионные формы, которые не экстрагируются солями алкиламмония.
Из солянокислых растворов извлекаются комплексные анионы Мо типа [МоО2С13-], которые становятся доминирующей формой при 7-8 М НCl. Поэтому зависимость коэффициента распределения DMo от концентрации соляной кислоты имеет максимум при 8 М HС1.
В сернокислых растворах даже при низкой концентрации H2SO4 доминируют комплексные анионы, экстракция протекает в основном по реакции анионного обмена, а коэффициент распределения уменьшается при повышении кислотности вследствие увеличения концентрации конкурирующих анионов HSO4-.
Извлечение Мо из азотнокислых растворов возможно только при низких концентрациях кислоты (менее 1 М), когда в растворе еще присутствуют полианионы. Из растворов с высоким содержанием HNO3 молибден не извлекается.
Из смешанных растворов Мо извлекается солями алкиламмония практически одинаково. Поэтому, ввиду малой избирательности для разделения Мо экстракцией аминами необходимо создание определенных условий. Так, показана возможность отделения Мо триоктиламином из растворов с высоким содержанием (6-8 М) бромистоводородной кислоты, из роданидных растворов, в присутствии оксалат-ионов [23]. Однако данные способы пригодны лишь в аналитической практике из-за высокой стоимости реагентов.
Для извлечения Мо(VI) из слабокислых, нейтральных и щелочных растворов эффективными экстрагентами являются соли четвертичных аммониевых оснований (ЧАО). Исследованию экстракции Мо солями ЧАО из водных растворов различного состава посвящено большое количество работ.
Экстракционные свойства солей ЧАО зависят от типа и длины угле-водороных радикалов. Для экстракции металлов используют соли с числом углеродных атомов не ниже 21. Увеличение длины углеводородных радикалов способствует снижению эмульгируемости и растворимости экстрагента в водной фазе [24].
Механизм экстракции Mo(VI) из слабокислых, нейтральных и щелочных растворов хлоридом тетраоктиламмония (ТеОАХ) и триалкилбензиламмония (ТАБАХ) подробно изучен в работах М.М.Иванова с сотр. [24,25]. Значительное влияние на экстракционное равновесие оказывают состав и кислотность водного раствора. В области рН>7,5 для Мо экстракция может быть описана уравнением:
МеО42- + 2R4N+C1- = (R4N)2MeО4 + 2С1- (1.12)
При подщелачивании водной фазы NaOH DMo не изменяется в интервале рН=7,5-12,0. Авторы объясняют это тем, что константа обмена для реакции:
R4N+C1- + ОН- = (R4N+)OH- + С1- (1.13)
невелика (lgKOH-/Cl~-2,8) и данная реакция существенно не влияет на экстракционное равновесие. При подщелачивании водной фазы содой DMe постоянно уменьшается, что связано с протеканием конкурирующей реакции соэкстракции НСO3- ионов с константой 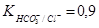 .
.
R4N+C1- + HCO3- = R4N+HCO3- + С1- (1.14)
C увеличением кислотности в водном растворе происходит образование полиядерных соединений Мо, вследствие чего коэффициенты распределения резко возрастают и имеют наибольшие значения при рН~2,5, соответствующее максимальной степени полимеризации молибдат-анионов.
В работе [26] изучена экстракция Мо ТАБАХ и хлоридом триал-килацетиламмония (ТАААХ). Показано, что при рН>5 степень извлечения Мо падает, при этом значительное влияние на экстракцию оказывает присутствие ионов: Сl-, СО32-, SO42- Методами насыщения, изомолярных серий и др. установлен состав экстрагируемых соединений: [R3NCH2C6H5]3·H3Mо7O24 при рН=4-5 и [R3NCH2C6H5]2MоO4 при рН>6. ТАААХ экстрагирует Mo аналогично ТАБАХ.
В литературе [27] рассмотрена экстракция Мо и W раствором хлорида диалкилдиметиламмония из щелочных растворов. Установлено, что оба металла эффективно извлекаются из растворов независимо от того какую кислоту использовали для снижения рН. Максимальная степень извлечения для Мо наблюдается в интервале рН от 2 до 4, при этом коэффициенты распределения составляют ~200. Увеличение рН от 4 до 8 сопровождается резким уменьшением DМe. Различие в экстрагируемости наиболее заметно при нейтрализации растворов H2SO4.
В работе [23] изучены кинетика и механизм экстракции Мо из сернокислых растворов сульфатом ТАБА. Максимальная скорость экстракции наблюдается при рН=2-3. Методами насыщения и сдвига равновесия установлено, что состав экстрагируемого комплекса отвечает формуле: (R4N)3HMo7O23. Высказано предположение, что Мо экстрагируется по анионообменному механизму.
Образование пероксокомплексов Мо и их экстракция солями ЧАО из слабокислых растворов подробно изучены в работах [24]. При экстракции Мо из нитратно-пероксидных растворов нитратом ТАБА DMo имеет максимум при рН=2. При малых концентрациях металла экстракция протекает по реакции простого анионного обмена с образованием в органической фазе соединения R4NHMo2O11 при высоких – R4NHMo2O6.
Нитрат метилтриалкиламмония (МТАА) в интервале рН от 2 до 6 и CМо>5·10-3 M экстрагирует Мо в виде соединения (R4NHMoO6)2·H2MoO6.
При рН>9,0 происходит разрушение пероксидных форм с образованием плохо экстрагируемых оксоанионов.
При экстракции микроколичеств Мо сульфатом метилтриалкиламмония из сульфатно-гороксидных растворов DМо имеет максимум при рН=2,4. Однако при концентрации Мо более 0,01 М анализ насыщенной органической фазы показал, что соотношение R4N+:Mo в экстрактах составляет 1:1,5.Авторы полагают, что дополнительное количество Мо экстрагируется по реакции присоединения с образованием соединения (R4NHMoО6)2H2MoО6 [25].
В ряде работ для экстракции Мо предложено использовать хлорид трикаприлметиламмония (Aliquat-336). Экстракция Mo Aliquat-336 из растворов НС1; КС1, КВг и KI в 0,5 М H2SO4 изучена в [27]. Показано, что Мо количественно извлекается из растворов 4 М по НС1 или растворов, содержащих 20% KI. В работе [43] изучена экстракция Мо из слабокислых (рН=2-3) ренийсодержащих растворов раствором Aliquat-336 в керосине в зависимости от концентрации металла и температуры.
В большинстве рассмотренных работ экстракцию Мо солями ЧАО изучали из слабокислых сред. Технологические растворы (карбонатные или щелочные) первоначально имеют рН>10. Поэтому значительный интерес представляют работы, посвященные экстракционному извлечению Мо солями ЧАО из щелочных и карбонатных растворов.
В работе [44] изучена экстракция Cr(VI), Mo(VI) W(VI) из водных растворов NaOН бензольными растворами гидроксида триоктилметиламмония (МТОА). Методами насыщения и ИК-спектроскопии показано, что в органической фазе образуются соединения состава (R4N)2MeO4,. Установлено также, что в интервале температур от 10 до 40°С коэффициенты распределения металлов при экстракции 0,05 М гидроксидом МТОА из 0,5 М раствора NaOH уменьшаются. Значения DMe уменьшаются в ряду: OH->Cl->HSO4->ClO4- в зависимости от присутствующего в водной фазе аниона.
В работе [25] описана экстракция Мо хлоридом ЧАО (Aliquat-336) из сбросных растворов уранового производства с рН=9,5. Процесс совместного экстракционного извлечения Mo, W и V из аммиачных растворов, полученных при переработке отработанных катализаторов. Экстракцию металлов из растворов с рН=10,0-10,5 проводят Aliquat-336. Реэкстракцию молибдена из органической фазы предложено осуществлять раствором бикарбоната аммония с концентрацией НСO3->75 г/л при рН=7,5-8,5 и, температуре <50°С.
В работе [28] описан способ экстракционного выделения Мо из водного раствора с рH>8,5, содержащего вольфрам. Такой раствор контактируют с экстрагентом, представляющим собой раствор меркаптоароматического комплексообразователя (димеркаптобензол, хлор-ди-меркаптобензол и др.) в органическом разбавителе, например алкилбензоле. В состав экстрагента входит четвертичное аммониевое соединение (Aliquat-336). Молярное соотношение комлексообразователь : ЧАС : Мо должно при этом составлять 2-10 : 2-10:1.
Закономерности экстракции Мо карбонатом МТАА из содовых растворов исследованы в работе [29]. Сделан вывод об отсутствии существенных различий в экстракционном поведении Мо, однако использование карбоната МТАА позволяет на стадии экстракции отделить примесные элементы.
В работе [30] предложен способ селективной экстракции Мо в виде тиосоединений солями ЧАО из щелочного раствора, содержащего вольфрам. К исходному молибденсодержащему раствору вольфрамата натрия добавляют сульфид щелочного металла, например NaHS, в количестве достаточном для превращения всех оксомолибдат-анионов в ионы MoS42- и недостаточном для полного превращения W в тиовольфраматы. Образующийся при рН=8,5-9,5 тиомолибдат экстрагируют раствором хлорида ЧАО (Adogen-464) в алкилбензоле. Реэкстракцию Мо из органической фазы предложено проводить растворами окислителей, преимущественно NaClO. Вольфрам из очищенного от Мо раствора выделяют упариванием в виде Na2WО4, или осаждением CaWО4.
Аналогичный процесс [31] предложено использовать в производстве пара-вольфрамата аммония из шеелитовых концентратов. Щелочной раствор от выщелачивания концентратов, содержащий 85 г/л WO3 и 0,170 г/л Мо, сульфидируют NaHS, нейтрализуют раствор до рН=8,2-8,4 и извлекают тиомолибдаты раствором соли ЧАО (N263) в три-н-бутилфосфате (ТБФ).
Реэкстракцию Мо проводят 30%-ным раствором NaClO. Очищенный от Мо раствор вольфрамата натрия нейтрализуют до рН=2-3 и экстрагируют вольфрам солями третичных аминов.
Процессы экстракционного извлечения и разделения вольфрама и молибдена из карбонатных сред солями ЧАО до настоящего времени не нашли практического применения в промышленном масштабе.
Не исследованы процессы полимеризации молибдена в водной и органической фазах и их влияние на экстракционное равновесие в системах с солями ЧАО. До настоящего времени остаются открытыми вопросы получения концентрированных экстрактов и реэкстрактов молибдена, влияния состава получаемых аммиачно-карбонатных реэкстрактов на качество конечной молибденовой продукции, утилизации оборотных и маточных растворов без образования вредных выбросов в атмосферу и сточных вод.
Практически не изучены особенности разделения молибдена в аммиачных и аммиачно-карбонатных средах с получением конечных товарных продуктов.
Эти и ряд других нерешенных вопросов химии и технологии экстракции молибдена солями ЧАО из карбонатных сред и явились предметом настоящих исследований.
Дата: 2019-04-23, просмотров: 531.