Количественно гидролиз характеризуется степенью гидролиза h и константой гидролиза Кг.
Степень гидролизапредставляет собой отношение числа молекул Nг, подвергшихся гидролизу, к общему числу растворенных молекул Nо, которое определяется концентрацией вещества:
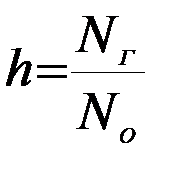 .
.
Степень гидролиза соли, как правило, невелика, зависит от константы гидролиза и концентрации соли и выражается в процентах или долях единицы.Так, в 0,1 м СН3СООNа и NН4Сl при 298 К она составляет примерно 10–4, т.е. в этих растворах гидролизована лишь одна из 10000 молекул. Причина столь низкой степени гидролиза состоит в том, что один из участников реакции – вода – является очень слабым электролитом. Поэтому положение равновесия реакции гидролиза сильно смещено в сторону исходных веществ.
Более конкретной характеристикой является константа гидролиза. Запишем уравнение гидролиза соли КА (здесь К+ - катион металла, А– - анион кислотного остатка) в общем виде:
КА + НОН D НА + КОН.
Этому равновесию отвечает константа равновесия:
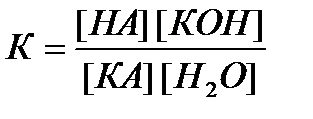 .
.
Концентрация воды в разбавленных растворах представляет собою практически постоянную величину. Обозначая К[Н2О]=Кг, получим:
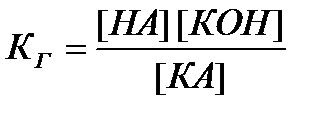 .
.
Величина Кг называется константой гидролиза соли.
Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше Кг(при одинаковых температуре и концентрации соли), тем в большей степени протекает гидролиз.
Например, для реакции гидролиза цианида калия
КСN + Н2О D КОН + НСN
или в ионно-молекулярном виде
CN 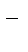 + HOHDHCN +OHˉ,
+ HOHDHCN +OHˉ,
выражение константы гидролиза будет иметь вид
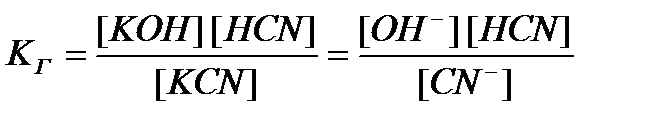 .
.
Выразим из ионного произведения воды Кв концентрацию гидроксид-ионов: [ОНˉ] = Кв/ [H+]. Подставим это соотношение в предыдущее выражение для КГ:
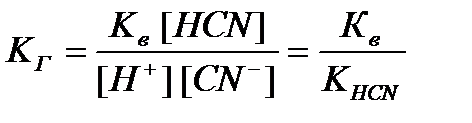 .
.
По этой формуле мы можем вычислить Кг цианида калия, воспользовавшись значением константы диссоциации синильной кислоты:
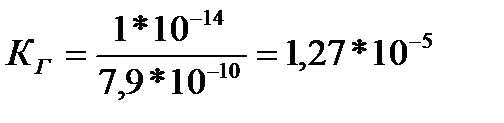 .
.
Таким образом, если соль образована слабой кислотой и сильным основанием, константа гидролиза связана с константой диссоциации кислоты Кдкисл зависимостью
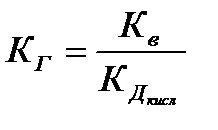 , где Кв– ионное произведение воды.
, где Кв– ионное произведение воды.
Это уравнение показывает, что Кг тем больше, чем меньше Кдкисл. Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
Для солей, образованных слабым основанием и сильной кислотой, аналогичное соотношение связывает константу гидролиза с константой диссоциации основания Кдосн:
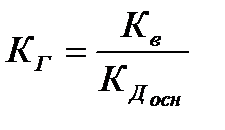 .
.
Поэтому чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза связана с константами диссоциации кислоты и основания следующим соотношением:
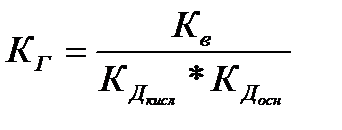 .
.
Эти уравнения служат количественным подтверждением вывода: чем слабее кислота (основание), соль которой (которого) подвергается гидролизу, тем полнее он протекает.
Константа гидролиза связана со степенью гидролиза h уравнением, аналогичным закону разбавления Оствальда для диссоциации слабого электролита:
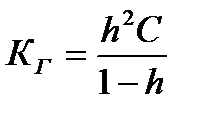 ,
,
где С – молярная концентрация соли в растворе.
Чаще всего гидролизованная часть соли очень мала, а концентрация продуктов гидролиза незначительна. В подобных случаях h<<1, и в знаменателе последней формулы этой величиной можно пренебречь. Тогда связь между Кг и h выразится более простыми соотношениями:
Кг = h2C или 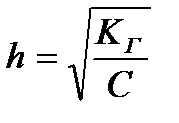 .
.
Из последнего уравнения следует, что степень гидролиза данной соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает.
Влияние различных факторов на глубину процесса гидролиза
На глубину гидролиза, как на обратимый процесс, влияют следующие факторы:
1. Природа соли.
Природа соли проявляется в величине константы гидролиза.
2. Концентрация раствора.
Из последнего уравнения следует, что степень гидролиза данной соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает. Например, уменьшение концентрации раствора Nа2СО3 от 0,1 до 0,001 моль/л при 298 К приводит к увеличению степени гидролиза от 0,029 до 0,34.
Рассмотрим влияние концентрации раствора на глубину гидролиза ацетата натрия. В растворе гидролизующейся соли устанавливается равновесие:
СН3СООNа + Н2О D СН3СООН + NаОН,
которому отвечает константа гидролиза:
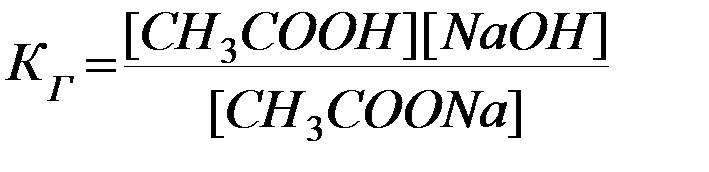
При разбавлении раствора и увеличении в нем относительной концентрации воды в соответствии с принципом Ле Шателье происходит смещения равновесия в сторону прямой реакции, т.е. гидролиз усиливается (увеличивается степень гидролиза соли h).
Разбавим раствор в 10 раз. При этом концентрации всех веществ – СН3СООNа, СН3СООН и NаОН – уменьшаются в 10 раз. Вследствие этого числитель правой части уравнения константы гидролиза уменьшится в 100 раз, а знаменатель–в 10 раз. Но Кг, как всякая константа равновесия, не зависит от концентрации веществ. Поэтому равновесие нарушится. Для того чтобы оно установилось, числитель дроби должен возрасти, а знаменатель – уменьшиться, т.е. некоторое количество соли должно дополнительно гидролизоваться. В результате этого концентрации СН3СООН и NаОН возрастут, а концентрация СН3СООNа – уменьшится. Таким образом, степень гидролиза h увеличится.
3. Температура раствора.
Поскольку обратный гидролизу процесс – реакция нейтрализации протекает с выделением теплоты, то реакция гидролиза представляет собой эндотермический процесс (∆Н > 0). Согласно принципу Ле Шателье, повышение температуры ведет к усилению гидролиза, а понижение температуры – к его ослаблению.
4. Введение в раствор кислоты или основания.
Подавлению гидролиза способствует введение в раствор одного из продуктов гидролиза (кислоты или основания). Для усиления гидролиза надо сделать все наоборот.
Итак, максимальная степень гидролиза достигается при высоких температурах и в разбавленных растворах.
Напротив, для уменьшения степени гидролиза необходимо использовать возможно более концентрированные растворы солей при низких температурах, а также добавлять к раствору один из продуктов гидролиза: кислоту или щелочь.
Комплексные соединения
Комплексными называют соединения, в узлах кристаллов которых находятся комплексы (комплексные ионы), способные к самостоятельному существованию.
Значение комплексных соединений для различных областей техники очень велико. Способность веществ образовывать комплексные соединения используется для разработки эффективных методов получения химически чистых металлов из руд, редких металлов, сверхчистых полупроводниковых материалов, катализаторов, красителей, лекарственных препаратов, очистки природных и сточных вод, растворения накипи в парогенераторах и т.п.
Первые комплексные соединения были синтезированы в середине 19 века. Основоположником теории комплексных соединений стал швейцарский ученый Вернер, разработавший в 1893 г. координационную теорию. Большой вклад в химию комплексных соединений внесли русские ученые Л.А. Чугаев, И.И. Черняев и их ученики.
Структура комплексных соединений:
1. В каждом комплексном соединении различают внутреннюю и внешнюю сферы. Внутреннюю сферу называют комплексом. При написании химических формул комплексных соединений внутреннюю сферу заключают в квадратные скобки.
Например, в комплексных соединениях а) К2[ВеF4], б) [Zn(NH3)4]Cl2, внутреннюю сферу составляют группировки атомов – комплексы а) [ВеF4]2– и б) [Zn(NH3)4]2+, а внешнюю сферу составляют соответственно ионы а) 2К+ и б) 2Сl–.
2. В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, или атом внутренней сферы занимает центральное место и называется комплексообразователем. В формуле комплекса (внутренней сферы) комплексообразователь указывается первым. В приведенных примерах это ионы а) Ве2+ и б) Zn2+.
Комплексообразователями являются атомы или чаще ионы металлов, относящиеся к p-, d-, f- элементам и имеющие достаточное число свободных орбиталей (Cu2+, Pt2+, Pt4+, Ag+, Zn2+, Al3+ и т.д.).
3. Вокруг комплексообразователя расположено (или, как говорят, координировано) некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами (или аддендами). В данном случае это а) ионы F– и б) молекулы NН3.
Лигандами в комплексных соединениях могут служить анионы F– , OH–, CN–, CNS–, NO2–, CO32–, C2O42– и др., нейтральные молекулы Н2О, NН3, СО, NО и др.
Число координационных мест, занятых лигандами вокруг комплексообразователя (в простейших случаях – число лигандов, окружающих комплексообразователь), называется координационным числом (к.ч.) комплексообразователя. Координационные числа различных комплексообразователей имеют значение от 2 до 12.
Ниже сопоставлены наиболее характерные координационные числа в растворах и заряд центрального иона (комплексообразователя):
| Заряд комплексообразователя | +1 | +2 | +3 | +4 |
| к.ч. | 2 | 4, 6 | 6, 4 | 8 |
Примечание: подчеркнуты чаще встречающиеся координационные числа в тех случаях, когда возможны два различных типа координации.
В рассмотренных примерах координационные числа комплексообразователей составляют: а) к.ч. (Ве2+) = 4, б) к.ч. (Zn2+) = 4.
Лиганды, занимающие во внутренней координационной сфере одно координационное место, называются монодентатными.
Лиганды, занимающие во внутренней сфере два или несколько мест (до восьми) за счет образования с комплексообразователем соответствующего числа химических связей, называются полидентатными.
Примерами монодентатных лигандов являются ионы Сl–, F–, ОН–, молекулы NН3, Н2О, СО и др. В качестве бидентатных лигандов часто выступают ионы СО32–, SО42– и им подобные. Одним из наиболее важных полидентатных лигандов (гексадентатным) является анион этилендиаминтетрауксусной кислоты (ЭДТА):
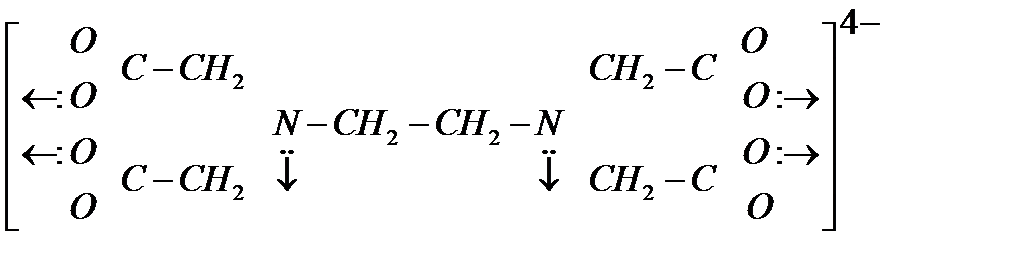
Комплексообразователь и лиганды образуют внутреннюю координационную сферу соединения или комплекс.
Заряд комплекса равен алгебраической сумме зарядов комплексообразователя и лигандов; при этом заряд комплексообразователя принимается равным его степени окисления.
4. Ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от комплексообразователя (центрального иона) и составляют внешнюю координационную сферу.
Внешняя сфера содержит положительно заряженные ионы, если внутренняя сфера комплексного соединения заряжена отрицательно, или отрицательные заряженные ионы, если комплексный ион заряжен положительно. В случае незаряженной внутренней сферы внешняя сфера отсутствует.
Заряд внешней сферы численно равен суммарному заряду внутренней сферы и противоположен ему по знаку.
Например, во внешней сфере комплексного соединения К3[Fe(CN)6] находятся три положительно заряженных иона К+. Следовательно, заряд комплекса (комплексного иона) равен (-3): [Fe(CN)6]3–.
Заряд комплексообразователя равен и противоположен по знаку алгебраической сумме зарядов всех остальных ионов. Так, в комплексном соединении К3[Fe(CN)6] заряд иона железа равен (+3). Сумма зарядов всех частиц, входящих в комплексное соединение, равняется нулю.
Дата: 2019-02-19, просмотров: 451.