Согласно этой теории (1923 г.), свойства кислот и оснований объясняются их составом. С этой точки зрения кислотами являются вещества, способные отдавать протоны (доноры протонов), а основаниями – вещества, способные присоединять протоны (акцепторы протонов). Таким образом, общим для всех кислот является наличие в их составе водорода. Кислотами могут быть как электронейтральные молекулы, так и имеющие электрический заряд катионы и анионы.
Н2О ↔ Н+ + ОН-
кислота основание
H2O + H+ ↔ H3O+
Основание кислота
СН3СООН ↔ Н+ +СН3СОО-
кислота основание
Так, теряя протон, кислота превращается в основание, поскольку в результате обратной реакции образовавшееся вещество может присоединить протон. Аналогичным образом основание, присоединившее протон, становится кислотой.
Сущность кислотно-основного взаимодействия состоит в передаче протона от кислоты к основанию. При этом кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Бренстедом сопряженными:
кислота1 + основание2 ↔ кислота2 + основание1.
Ниже приведены несколько примеров сопряженных кислот и оснований:
| кислота1 | основание2 | кислота2 | основание1 | |||
| H3O+ | + | OH- | ↔ | Н2O | + | H2O |
| НС1 | + | H2O | ↔ | Н3O+ | + | Сl- |
| Н2O | + | NНз | ↔ | NH4+ | + | OH- |
| H2O | + | СО2-3 | ↔ | НСО-3 | + | OH- |
| Н2O | + | НCO-3 | ↔ | Н2СO3 | + | OH- |
По теории Бренстеда-Лоури вещество рассматривается как кислота или основание в зависимости от того, в какие реакции оно вступает. Одно и то же вещество в зависимости от силы акцептора может выступать в роли кислоты или основания.
Так, в присутствии НС1 вода является акцептором протонов, т.е, основанием, а в присутствии аммиака вода оказывается донором протонов, т.е. кислотой:
НС1 + Н2O ↔ Н3O+ + Сl-;
кислота основание
NНз + Н2O ↔ NH4+ + OH-.
основание кислота
В результате взаимодействия кислоты с основанием образуются новая кислота и новое основание. Такие реакции являются обратимыми, а положение равновесия смещено в сторону образования наиболее слабой кислоты и наиболее слабого основания (в приведенных примерах: вправо и влево, соответственно).
Предложенная теория хорошо описывает многие кислотно-основные реакции как в водных, так и в неводных растворах:
НС1 + СН3СОONa ↔ СН3СООН + NаС1
кислота1 основание2 кислота2 основание1;
KNH2 + CH3COOH ↔ CH3COOK + NH3
основание1 кислота2 основание2 кислота1
Основным недостатком этой теории является то, что она исключает проявление кислотного характера веществами, не содержащими водорода.
Электронная теория Льюиса
В теории Льюиса (1923 г.) понятие кислоты и основания было ещё более расширено. Она рассматривает кислотно-основные свойства веществ не на молекулярно-ионном, а на электронном уровне и связывает их с переносом электронной пары от одной частицы к другой. Согласно рассматриваемой теории:
- кислота (Льюиса) – акцептор электронной пары; это может быть молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Например, ионы водорода (Н+), ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот;
- основание (Льюиса) – донорэлектронной пары; это может быть молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода, спирты, галогены.
Взаимодействие между кислотой и основанием заключается в образовании донорно-акцепторной связи между реагирующими частицами и не связываются с присутствием в них какого-либо определенного элемента, в частности водорода, могущего отщепляться в виде протона.
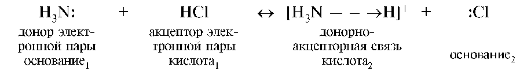
Примеры химических реакций между кислотами и основаниями Льюиса:
- AlCl3 + Cl− → [AlCl4]−;
- BF3 + F− → [BF4]−;
- PCl5 + Cl− → [PCl6]−.
В общем случае представления Льюиса и Бренстеда-Лоури о кислотах и основаниях широко применяются в химии и хорошо дополняют друг друга. Представления Аррениуса также вписываются в рамки этих двух теорий.
С практической точки зрения для объяснения процессов, протекающих в водных растворах, удобно пользоваться представлениями Аррениуса. Для неводных систем и протекающих в них химических реакций –представлениями Льюиса и Бренстеда-Лоури.
Дата: 2019-02-19, просмотров: 389.