Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится встречаться с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. Вследствие динамического характера равновесия скорость процесса растворения осадка будет совпадать со скоростью обратного процесса кристаллизации.
Например, возьмем насыщенный раствор нерастворимого сильного электролита ВаSО4. В растворе устанавливается гетерогенное равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе:
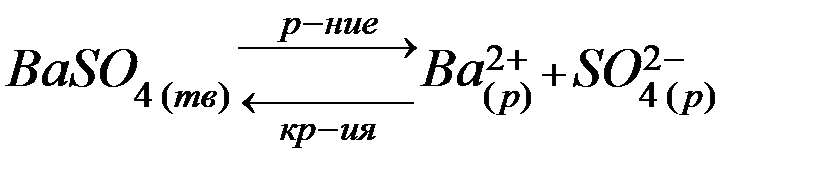 .
.
Его можно охарактеризовать с точки зрения закона действующих масс, записав выражение для константы гетерогенного равновесия К:
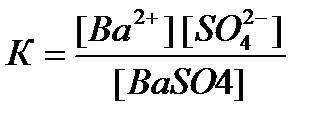 .
.
Преобразуем это выражение к виду: К[ВаSО4]=[Ва2+][SО42‾]; [ВаSО4]=const, как для твердого вещества, то К[ВаSО4]=const при данной температуре. Отсюда следует, что произведение концентраций ионов Ва2+ и SО42‾ также представляет собой постоянную величину. Это произведение называется произведением растворимости ПР:
ПР (BaSO4)= [Ва2+][SO42‾].
В общем виде для насыщенного раствора малорастворимого или нерастворимого сильного электролита АnBm, находящегося в равновесии с его твердой фазой, будет характерен следующий обратимый процесс:
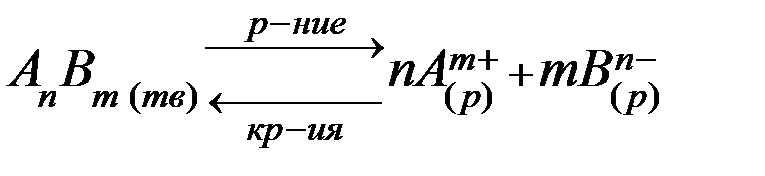 ,
,
для которого
ПР (AnBm)= [Аm+]n[Вn-]m.
Таким образом, гетерогенное равновесие «осадок – насыщенный раствор» подчиняется правилу произведения растворимости:произведение концентраций ионов электролита, содержащихся в его насыщенном растворе, возведенных в степени, соответствующие стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением растворимости (ПР).
Из понятия ПР вытекают три следствия:
1. Условие образования осадка.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов становится больше ПР. При этом равновесие смещается в сторону образования осадка.
Осадок образуется, если произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, больше величины произведения растворимости: [Аm+]n·[Вn-]m >ПР(AnBm).
В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентрации ионов электролита вновь становится равным ПР.
2. Условие растворения осадка.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор становится ненасыщенным, а равновесие между жидкой фазой и осадком сместится в сторону растворения осадка.
Осадок растворяется, если произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, меньше величины произведения растворимости: [Аm+]n·[Вn-]m <ПР (AnBm).
3. Условие получения одного малорастворимого соединения (II) из другого малорастворимого соединения (I): ПРII< ПРI. Например, химическое равновесие приведенной ниже реакции будет смещено вправо, в сторону образования AgI, т.к. ПР(AgI) = 1,5·10‾16 < ПР(AgCl) = 1,56·10‾10:
АgCl↓ + NaIDAgI↓ + NaCl
х.р.
AgCl↓ + I‾ D AgI↓ + Cl‾.
х.р.
Произведение растворимости характеризует растворимость вещества: чем больше ПР, тем больше растворимость. ПР – табличная величина.
Исходя из значений ПР, можно выразить растворимость малорастворимых сильных электролитов в воде и растворах, содержащих другие электролиты.
Пример.
Произведение растворимости йодида свинца (II) при 20°С равно 8·10‾9. Вычислите растворимость соли (в моль/л) при указанной температуре.
| t=20°С ПР(PbI2)= 8·10‾9 | Решение. Уравнение электролитической диссоциации растворенной соли (сильного электролита): PbI2 = Pb2++ 2I‾. Уравнение гетерогенного равновесия в растворе: PbI2 (тв)↓ D Pb2+(р) + 2I‾(р). Обозначим искомую растворимость PbI2 через s (моль/л): s = С (PbI2). |
| S-? |
Концентрация растворившейся соли PbI2 в насыщенном растворе составляет s; за счет диссоциации данного сильного электролита в соответствии со стехиометрическими соотношениями в растворе содержится s моль/л ионов Pb2+ и 2s моль/л ионов I‾, т.е. [Pb2+]=s; [I‾]=2s.
Согласно правилу произведения растворимости и с учетом приведенных соотношений:
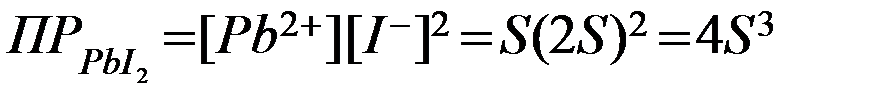 ,
,
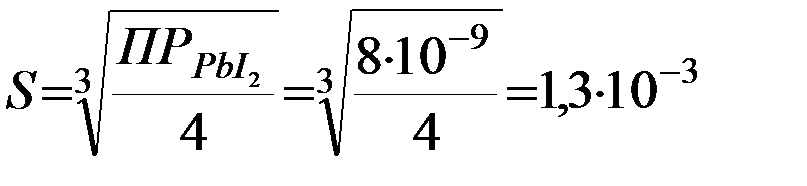 моль/л.
моль/л.
Ответ:S = 1,3∙10-3 моль/л.
Гидролиз солей
Гидролиз – частный случай сольволиза – реакции обмена между растворителем и растворенным веществом, разновидность реакций ионного обмена.
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями.
В результате протекания гидролиза:
- происходит изменение pH среды;
- образуются малодиссоциирующие соединения.
Механизм гидролиза
Для разных типов соединений он различен. Так, гидролиз солей можно рассматривать:
во-первых, как процесс, обратный реакциям нейтрализации;реакция нейтрализации между различными по силе кислотами и основаниями не всегда протекает до конца вследствие протекания обратного процесса – гидролиза образующейся соли, например:
НСN + КОН D КСN + НОН;
во-вторых, как результат поляризационного взаимодействия ионов соли с их гидратной оболочкой (все ионы в растворе гидратированы);чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз.
Рассмотрим возможные случаи поляризующего действия ионов на гидратную оболочку:
1. Катионы.В водном растворе катионы существуют в виде катионных аквакомплексов, которые образуются в результате донорно- акцепторного взаимодействия К–ОН2 ([Cu(H2O)4]2+, [Zn(H2O)4]2+, [Al(H2O)6]3+ и т.д.).
Аквакомплексы, в свою очередь, гидратированы посредством водородных связей. Можно считать, что чем выше заряд и меньше размеры катиона, тем сильнее его акцепторная способность (прочнее связь К–ОН2), тем сильнее поляризуется связь О–Н координированной молекулы воды и тем сильнее водородная связь между координированной молекулой Н2О в комплексе и молекулами воды гидратной оболочки комплекса. Все это может привести к разрыву связи О–Н в координированной молекуле Н2О, к превращению водородной связи Н…ОН2 в ковалентную с образованием ОН  игидроксоаквакомплекса.
игидроксоаквакомплекса. 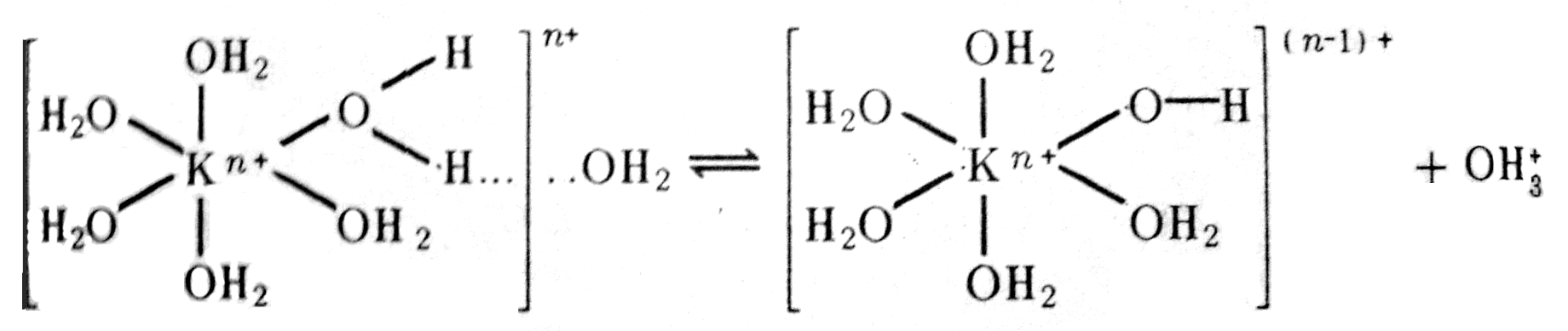
В соответствии с последовательным усилением акцепторной способности катионов (увеличением их заряда и уменьшением размеров) возможны два случая:
1) отсутствие заметного разложения молекул воды:
Na+ + HOH D реакция практически не идет
Подобным образом ведут себя слабые акцепторы электронных пар – катионы щелочных и щелочно-земельных металлов (Na+, K+, Сs+, Rb+, Fr+, Ca2+, Ba2+, Sr2+), т.е. катионы, образующие сильные основания – щелочи;
2) обратимое разложение молекул воды с образованием гидроксоаквакомплексов:
[Al(OH2)6]3+ + HOH D [Al(OH2)5(OH)]2+ + OH3+
или упрощенно: 
Al3+ + HOH D AlOH2+ + H+.
Избыток ионов Н+ обусловливает кислую среду раствора. Этот случай характерен для двух- и трехзарядных катионов (Cu2+,Fe2+, Fe3+, Cr3+ и т.д.), т.е. катионов, образующих слабые основания.
Чем слабее основание, тем интенсивнее протекает гидролиз.
2. Анионы. 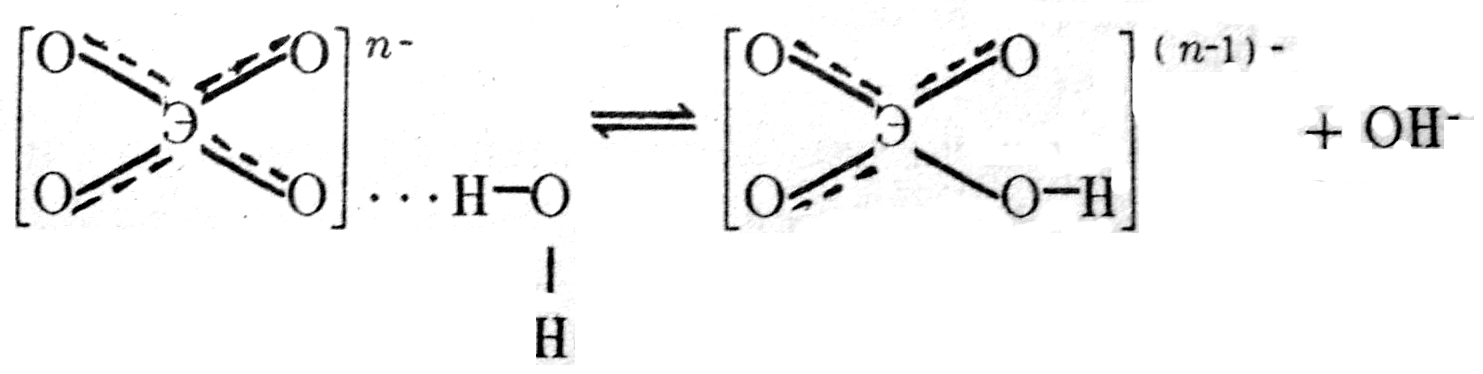
Их гидратация осуществляется за счет водородной связи, которая в результате поляризационного взаимодействия между анионом и молекулами воды может перейти в ковалентную:
Чем больше отрицательный заряд и меньше размер аниона, тем он более сильный донор электронных пар и тем легче отрывает протон от молекулы воды. Например, прочность водородной связи возрастает в ряду анионов, образованных p-элементами III периода:
ClO 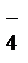 <SO
<SO 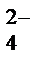 <PO
<PO 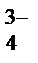 <SiO
<SiO 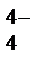 .
.
В зависимости от электродонорной активности анионов возможны два случая:
1) отсутствие заметного разложения молекул воды:
Cl 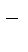 + HOHD реакция практически не идет;
+ HOHD реакция практически не идет;
NO 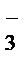 + HOHD реакция практически не идет.
+ HOHD реакция практически не идет.
Подобным образом ведут себя слабые доноры электронных пар – однозарядные анионы (Cl ˉ, Brˉ, I ˉ, NO 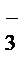 , ClO
, ClO 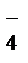 ), анионы SO
), анионы SO 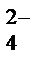 , SiF
, SiF 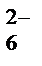 и другие кислотные остатки сильных кислот;
и другие кислотные остатки сильных кислот;
2) обратимое разложение молекул воды:
CO 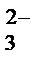 + HOHDHCO
+ HOHDHCO 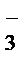
 + OH ˉ.
+ OH ˉ.
Избыток ОНˉ– ионов обусловливает щелочную реакцию среды. Этот случай характерен для одно-двух- и многозарядных анионов (СNˉ, CO 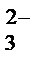 , SO
, SO 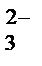 , S
, S 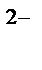 , PO
, PO 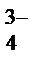 и т.д.), т.е. кислотных остатков слабых кислот и кислот средней силы.
и т.д.), т.е. кислотных остатков слабых кислот и кислот средней силы.
Чем слабее кислота, тем интенсивнее протекает гидролиз.
Суммарный эффект гидролиза определяется природой находящихся в растворе катионов и анионов.Различают следующие варианты взаимодействия солей с молекулами воды:
I. Соли сильных оснований и слабых кислот (KCN, CH3COONa, Na2CO3, Na2S, K2S и т.д.).
При диссоциации данных солей в растворе образуется катионы, слабо поляризующие гидратную оболочку, т.е. практически не взаимодействующие с водой, и анионы, поляризующие гидратную оболочку, т.е. обратимо взаимодействующие с водой. В этом случае гидролиз идет по аниону, при этом образуется щелочная среда (рН > 7).
Пример 1: процесс гидролиза цианида калия, КСN– соль, образована сильным основанием КОН и слабой кислотой НСN.
Уравнение электролитической диссоциации соли:
КCN = K 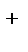 + CN
+ CN 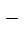 .
.
Ионно-молекулярные уравнения гидролиза:
К+ + НОН D реакция практически не идет,
СN¯ + НОН D НСN + ОН¯.
Молекулярноеуравнение гидролиза: КСN + НОН D НСN + КОН.
Пример 2: гидролиз сульфида натрия,Nа2S – соль образована слабой многоосновной кислотой Н2S и сильным основанием NаОН. Так как диссоциация многоосновных кислот протекает ступенчато, то и гидролиз их солей будет также протекать ступенчато.
Уравнение электролитической диссоциации соли:
Na2S = 2Na 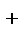 + S
+ S 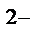 ,
,
I ступень:
Na+ + HOHD реакция практически не идет,
S 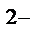 + HOHD НS
+ HOHD НS 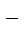 + ОН
+ ОН 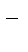
или в молекулярной форме
Nа2S + НОН DNаНS + NаОН.
II ступень:
НS– + НОН D Н2S + ОН–
х.р.
или в молекулярной форме
NаНS + НОН D Н2S + NаОН.
х.р.
Гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Это обусловлено уменьшением константы диссоциации при переходе от Кд1 к Кд2 (для Н2S Кд1 > Кд2): поскольку ион НS 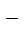 диссоциирует слабее, чем Н2S, то он и образуется в первую очередь при гидролизе Nа2S.
диссоциирует слабее, чем Н2S, то он и образуется в первую очередь при гидролизе Nа2S.
Кроме того, ионы ОН–, образующиеся при гидролизе по первой ступени, способствуют смещению равновесия второй ступени влево, т.е. также подавляют гидролиз по второй ступени.
Вывод: если соль образована сильным основанием и слабой кислотой, то происходит обратимый гидролиз по аниону. Растворы таких солей имеют щелочную среду. В обычных условиях гидролиз по многозарядному аниону протекает по первой ступени с образованием кислых солей, т.к. последующие ступени подавлены из-за накопления в растворе ионов ОН–.
II. Соли слабых оснований и сильных кислот (NH4Cl, CuCl2, CuSO4, ZnCl2, AgNO3 и т.д.).
При диссоциации данных солей образуются катионы, поляризующие гидратную оболочку, т.е. обратимо взаимодействующие с водой, и анионы, слабополяризующие гидратную оболочку, т.е. практически не взаимодействующие с водой. В этом случае гидролиз протекает по катиону, при этом образуется кислая среда (рН<7).
В качестве примера рассмотрим процесс гидролиза СuСl2, соли, образованной слабым двукислотным основанием Сu(ОН)2 и сильной кислотой НСl:
СuСl2 = Сu2+ + Сl 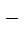 ,
,
Сu2+ + НОН D СuОН+ + Н+,
Сl– + НОН D реакция практически не идет
или в молекулярной форме
СuСl2 + НОН D СuОНСl + НСl.
Так как диссоциация многокислотных оснований протекает ступенчато, то и гидролиз их солей будет протекать также ступенчато, но константа диссоциации Сu(ОН)2 по первой ступени Кд1 больше константы диссоциации по второй ступени Кд2 (Кд1> Кд2). Т.е. ион СuОН+ диссоциирует слабее, чем Сu(ОН)2, то он и образуется в первую очередь при гидролизе. Кроме того, ионы Н+, образующиеся при гидролизе по первой ступени, способствуют смещению равновесия второй ступени влево, т.е. подавляют гидролиз по второй ступени, он происходит в ничтожно малой степени и его не учитывают.
Вывод: если соль образована слабым основанием и сильной кислотой, то происходит обратимый гидролиз по катиону. Растворы таких солей имеют кислую среду. В обычных условиях гидролиз по многозарядному катиону протекает по первой ступени с образованием основных солей, т.к. последующие ступени подавлены из-за накопления в растворе ионов Н+.
III. Соли слабых оснований и слабых кислот (Fe2(CO3)3, Al2S3, (NH4)3PO4 и т.д.).
При диссоциации данных солей в растворе образуются катионы и анионы, поляризующие гидратную оболочку, т.е. взаимодействующие с водой. В этом случае гидролиз протекает и по катиону, и по аниону.
В качестве примера рассмотримпроцесс гидролиза СН3СООNН4– соли, образованной слабой уксусной кислотой СН3СООН и слабым основанием NН4ОН. Запишем ионно-молекулярные уравнения отдельно для процессов гидролиза катиона и аниона, протекающих одновременно:
СН3СООNН4 = СН3СОО– + NН4+,
СН3СОО– + НОН D СН3СООН + ОН–,
х.р.
NН4+ + НОН D NН4ОН + Н+.
х.р.
При гидролизе аниона образуются ионы ОН–, а при гидролизе катиона – ионы Н+. Эти ионы не могут в значительных концентрациях сосуществовать одновременно; они соединяются, образуя молекулы слабого электролита – воды. Это приводит к смещению обоих равновесий вправо. Иначе говоря, в этом случае гидролиз катиона и гидролиз аниона взаимно усиливают друг друга, и в совокупности процесс протекает практически необратимо.
Суммарное ионно-молекулярное уравнение:
СН3СОО– + NН4+ + Н2О = СН3СООН + NН4ОН.
Молекулярное уравнение:
СН3СООNН4 + Н2О = NН4ОН + СН3СООН.
Реакция растворов солей, образованных слабой кислотой и слабым основанием, определяется относительной силой образовавшихся кислоты и основания, зависит от соотношения их констант диссоциации. Если константа диссоциации кислоты больше константы диссоциации основания, то раствор имеет слабокислую реакцию, при обратном соотношении констант диссоциации – слабощелочную, т.е. рН близко к семи (рН ≈ 7).
Рассмотрим еще один пример:Аl2S3 – соль образована слабым основанием Аl(ОН)3 и слабой кислотой Н2S. Ионы, образовавшиеся в растворе при диссоциации данной соли, будут подвергаться гидролизуодновременно. При этом будет происходить взаимное усиление гидролиза каждого из ионов (смещение химического равновесия вправо) из-за связывания ионов Н+ и ОНˉ в молекулы слабого электролита Н2О. Поэтому гидролиз каждого из ионов будет идти по всем ступеням, до конца с образованием слабого основания – Аl(ОН)3 и слабой кислоты – Н2S:
Аl2S3 = 2Аl3+ + 3 S2–
I ступень:
Аl3+ + НОН D АlОН2+ + Н+,
х.р.
S2– + НОН D НS– + ОНˉ;
х.р.
II ступень:
АlОН2+ + НОН D Аl(ОН)2+ + Н+,
х.р.
НS– + НОН DН2S + ОНˉ;
х.р.
III ступень:
Аl(ОН)2+ + НОН = Аl(ОН)3  + Н+.
+ Н+.
Суммарное ионно-молекулярное уравнение:
2Аl3+ + 3S2– + 6Н2О = 2Аl(ОН)3  + 3Н2S.
+ 3Н2S.
Молекулярное уравнение:
Аl2S3 + 6Н2О = 2Аl(ОН)3 + 3Н2S.
Вывод: если соль образована слабым основанием и слабой кислотой, то гидролиз происходит и по катиону, и по аниону, взаимно усиливающий друг друга, протекающий практически необратимо с образованием слабого основания и слабой кислоты. Характер среды близок к нейтральному.
IV. Соли сильных оснований и сильных кислот (NаСl, К2SО4, NаNО3 и т.д.).
В этом случае поляризующее влияние катионов и анионов на молекулы воды невелико. Гидролиз практически не происходит,поэтому растворы таких солей практически нейтральны (рН ≈ 7). Например:
NaCl = Na 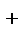 + Cl
+ Cl 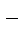 ,
,
Nа+ + НОН D реакция практически не идет,
Сl– + НОН D реакция практически не идет,
NаСl + НОН D реакция практически не идет.
Вывод: если соль образована сильным основанием и сильной кислотой, то гидролиз не происходит; растворы таких солей практически нейтральны (рН≈7).
V. Совместный гидролиз двух солей.
Рассмотрим, что произойдет при сливании растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а другая сильным основанием и слабой кислотой. Например, при сливании растворов FeCl3 и Na2CО3:
2FеСl3 + 3Nа2СО3 + 6Н2О = 2Fе(ОН)3  + 3Н2СО3 + 6NаСl
+ 3Н2СО3 + 6NаСl
I ступень:
Fе3+ + НОН D FеОН2+ + Н+,
х.р.
СО32–+ НОН D НСО3– + ОН–
х.р.
и т.д. по ступеням, как в случае соли, образованной слабой многоосновной кислотой и слабым многокислотным основанием.
Образующиеся ионы Н+ и ОН– будут нейтрализовать друг друга на каждой ступени гидролиза, связываясь в молекулы слабого электролита воды, гидролиз обоих ионов усиливается, что приводит к протеканию всех ступеней гидролиза и образованию конечных продуктов Fе(ОН)3 и Н2СО3. Суммарное ионно-молекулярное уравнение:
2Fе3+ + 3СО32– + 6Н2О = 2Fе(ОН)3↓ + 3Н2СО3.
С учетом разложения Н2СО3 на Н2О и СО2, окончательныеуравнения (суммарное ионно-молекулярное имолекулярное)будут иметь вид:
2Fе3+ + 3СО32– + 3Н2О = 2Fе(ОН)3↓ + 3СО2↑.
2FеСl3 + 3Nа2СО3 + 3Н2О = 2Fе(ОН)3↓ + 3СО2↑ + 6NаСl.
В подобных случаях в осадок выпадает наименее растворимый из возможных продуктов гидролиза. Так, растворимость карбоната гидроксомеди (СuОН)2СО3 меньше, чем гидроксида меди Сu(ОН)2. Поэтому при сливании растворов СuSО4 и Nа2СО3 конечным продуктом гидролиза является именно (СuОН)2СО3:
2СuSО4 + 2Nа2СО3 + Н2О = (СuОН)2СО3↓ + СО2↑ + 2Nа2SО4,
2Сu2+ + 2СО32– + Н2О = (СuОН)2СО3↓ + СО2↑.
Вывод:если в растворе присутствуют две соли, одна из которых гидролизуется по аниону, другая по катиону, то гидролиз обеих солей усиливается, протекает необратимо с образованием конечных продуктов (слабого основания и слабой кислоты). Растворы таких солей имеют среду, близкую к нейтральной (рН ≈ 7).
VI. Существенно отличен характер гидролиза ковалентных соединений.Большинство соединений неметаллов с неметаллами в воде претерпевает необратимое гидролитическое разложение, с образованием соответствующих кислот, например:
SiCl4 + 3HOH = H2SiO3  + 4HCl,
+ 4HCl,
SiS2 + 3HOH = H2SiO3  + 2H2S.
+ 2H2S.
Дата: 2019-02-19, просмотров: 553.