1. Метод электронного баланса.
Здесь подсчет числа присоединяемых и теряемых электронов производится на основании значений с.о. элементов до и после реакции. Обратимся к простейшему примеру:
Na0 + Cl 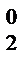 ®Na+Cl
®Na+Cl 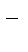
2 2 Na0 – ē ®Na+– окисление
1 Cl2 + 2ē ® 2Cl 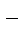 – восстановление
– восстановление
2 Na + Cl2 = 2Na+ + 2Cl 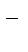
2 Na + Cl2 = 2NaCl
Данный метод используют в том случае, если реакция протекает не в растворе (в газовой фазе, реакции термического разложения и т.д.).
Алгоритм подбора коэффициентов в уравнениях ОВР методом электронного баланса:
1. Записать молекулярную схему реакции.
2. Определить с.о. элементов.
3. Отметить символы элементов, изменивших с.о. в ходе реакции.
4. На основании сравнения с.о. элементов, определить окислитель и продукт восстановления, восстановитель и продукт окисления.
5. Составить электронные уравнения процессов восстановления, окисления, соблюдая при этом баланс по элементам и зарядам.
6. Найти наименьшее общее кратное (НОК) для числа принятых и отданных электронов.
7. Найти основные коэффициенты при каждом электронном уравнении. Для этого полученное в пункте 6 число НОК разделить на число электронов, фигурирующих в данном электронном уравнении.
8. Умножить электронные уравнения полуреакций окисления и восстановления на основные коэффициенты, полученные в п.7, и просуммировать их между собой (т.е. получить суммарное электронное уравнение). В суммарном уравнении электроны отсутствуют, т.к. сокращаются.
9. Подставить коэффициенты из суммарного электронного уравнения в молекулярное уравнение. Остальные коэффициенты подбираем в последовательности: соль, кислота или основание, вода.
10. Осуществить проверку числа атомов кислорода в правой и левой частях уравнения.
Пример. Молекулярная схема реакции:
+3 +2 0 +4
BiCl3 + Na2SnO2 + NaOH → Bi + NaCl + Na2SnO3 +H2O
окислитель восстановитель продукт продукт
восстановления окисления
Электронные уравнения:
| осн. коэффициенты | НОК | ||
| 2 | 6 | Bi+3 +3℮ = Bi | процесс восстановления |
| 3 | Sn+2 -2℮ = Sn+4 | процесс окисления | |
| Суммарная схема электронного баланса 2 Bi+3 + 3Sn+2 = 2 Bi +3Sn+4 | |||
Молекулярное уравнение реакции:
2BiCl3 + 3Na2SnO2 + 6NaOH → 2Bi + 6NaCl + 3Na2SnO3 +3H2O
Проверка:баланс по кислороду:12 = 12.
2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
Данный метод учитывает среду раствора, дает представление о характере частиц реально существующих и взаимодействующих в растворах. Остановимся на нем более подробно.
Алгоритм подбора коэффициентов в уравнениях ОВР методом ионно-электронного баланса:
1. Составить молекулярную схему реакции с указанием исходных веществ и продуктов реакции.
2. Составить полную ионно-молекулярную схему реакции, записывая слабые электролиты, малорастворимые, нерастворимые и газообразные вещества в молекулярном виде, а сильные электролиты – в ионном.
3. Исключив из ионно-молекулярной схемы ионы, не изменяющиеся в результате реакции (без учета их количества), переписать схему в кратком ионно-молекулярном виде.
4. Отметить элементы, изменяющие в результате реакции с.о.; найти окислитель, восстановитель, продукты восстановления и окисления.
5. Составить уравненияполуреакций окисления и восстановления, для этого:
а) указать восстановитель и продукт окисления, окислитель и продукт восстановления;
б) уравнять число атомов каждого элемента в левой и правой частях полуреакций (выполнить баланс по элементам) в последовательности: элемент, изменяющий с.о., кислород, другие элементы;при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы Н2О, ионы Н+ или ОН – в зависимости от характера среды:
| Процесс | Кислая среда | Нейтральная среда | Щелочная среда |
| Связывание избытка кислорода | О-2+2Н+ =Н2О | О-2+Н2О=2ОН ˉ | О-2+Н2О=2ОН ˉ |
| Восполнение недостатка кислорода | Н2О= О-2+2Н+ | Н2О = О-2+2Н+ | 2ОН ˉ=О-2+Н2О |
в) уравнять суммарное число зарядов в обеих частях полуреакций; для этого прибавить или отнять в левой части полуреакций необходимое число электронов (баланс по зарядам).
6. Найти наименьшее общее кратное (НОК) для числа отданных и полученных электронов.
7. Найти основные коэффициенты при каждой полуреакции. Для этого полученное в п.6 число (НОК) разделить на число электронов, фигурирующих в данной полуреакции.
8. Умножить полуреакции на полученные основные коэффициенты, сложить их между собой: левую часть с левой, правую – с правой (получить ионно-молекулярное уравнение реакции). При необходимости “привести подобные” ионы с учетом взаимодействия между ионами водорода и гидроксид-ионами: H++OH ˉ= H2O.
9. Расставить коэффициенты в молекулярном уравнении реакции.
10. Провести проверку по частицам, не участвующим в ОВР, исключенным из полной ионно-молекулярной схемы (п.3). При необходимости коэффициенты для них находят подбором.
11. Провести окончательную проверку по кислороду.
Примеры:
1. Кислая среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + H2SO4® MnSO4 + NaNO3 + H2O + K2SO4
Полная ионно-молекулярная схема реакции:
K++MnO 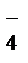 +Na++NO
+Na++NO 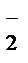 +2H++ SO
+2H++ SO 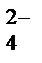 ®Mn2++SO
®Mn2++SO 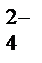 +Na++NO
+Na++NO 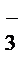 +H2O+2K+ +SO
+H2O+2K+ +SO 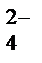
Краткая ионно-молекулярная схема реакции:
+7 +3 +5
MnO 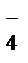 +NO
+NO 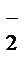 +2H+®Mn2++NO
+2H+®Mn2++NO 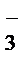 + H2O
+ H2O
ок-ль в-ль прод.в-ния прод.ок-ия
В ходе реакции с.о.Mn понижается от +7 до +2 (марганец восстанавливается), следовательно, MnО 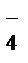 – окислитель; Mn2+– продукт восстановления. С.о. азота повышается от +3 до +5 (азот окисляется), следовательно, NO
– окислитель; Mn2+– продукт восстановления. С.о. азота повышается от +3 до +5 (азот окисляется), следовательно, NO 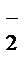 – восстановитель, NO
– восстановитель, NO 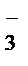 – продукт окисления.
– продукт окисления.
Уравнения полуреакций:
2 НОКMnO 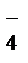 + 8 H+ + 5ē®Mn2+ + 4 H2 O– процесс восстановления
+ 8 H+ + 5ē®Mn2+ + 4 H2 O– процесс восстановления
10 +7 +(-5) = +2
5 NO 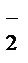 + H2 O – 2ē®NO
+ H2 O – 2ē®NO 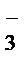 + 2 H+– процесс окисления
+ 2 H+– процесс окисления
-1 -(-2) = +1
_________________________________________________________________________
Суммарное ионно-молекулярное уравнение:
2MnO 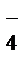 + 16H+ + 5NO
+ 16H+ + 5NO 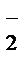 + 5H2O = 2Mn2+ +8H2O + 5NO
+ 5H2O = 2Mn2+ +8H2O + 5NO 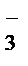 + 1OH+.
+ 1OH+.
В суммарном уравнении исключаем число одинаковых частиц, находящихся как в левой, так и в правой частях равенства (приводим подобные). В данном случае это ионы Н+ и Н2О.
Краткое ионно-молекулярное уравнение будет иметь вид
2MnO 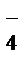 + 6H+ + 5NO
+ 6H+ + 5NO 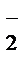 ® 2Mn2+ + 3H2O + 5NO
® 2Mn2+ + 3H2O + 5NO 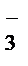 .
.
В молекулярной форме уравнение имеет вид
2KMnO4 + 5 NaNO2 + 3 H2SO4 = 2MnSO4+5NaNO3 + 3H2O + K2SO4.
Проверка: а) баланс по частицам, которые не учавствовали в ОВР: K+ (2=2), Na+ (5=5), SO 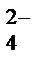 (3=3); б) баланс по кислороду: 30 = 30.
(3=3); б) баланс по кислороду: 30 = 30.
2. Нейтральная среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + H2O ® MnO2  + NaNO3 + KOH
+ NaNO3 + KOH
Ионно-молекулярная схема реакции:
K+ + MnO 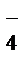 + Na+ + NO
+ Na+ + NO 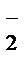 + H2O ® MnO2
+ H2O ® MnO2  + Na+ + NO
+ Na+ + NO 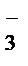 + K+ + OH
+ K+ + OH 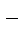
Краткая ионно-молекулярная схема:
+7 +3 +4 +5
MnO 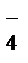 + NO
+ NO 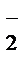 + H2O® MnO2
+ H2O® MnO2  + NO
+ NO 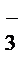 + OH-
+ OH-
ок-ль в-ль продукт в-ния продукт ок-ия
Уравнения полуреакций:
2 НОКMnO 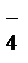 + 2H2O + 3eˉ ®MnO2
+ 2H2O + 3eˉ ®MnO2  +4OH
+4OH 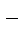 -процесс восстановления
-процесс восстановления
6 -1 +(-3) = -4
3 NO 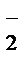 + H2O – 2eˉ ®NO
+ H2O – 2eˉ ®NO 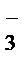 + 2H+ - процесс окисления
+ 2H+ - процесс окисления
-1 - (-2) = +1
Суммарное ионно-молекулярное уравнение:
2MnO 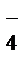 + 4H2O + 3NO
+ 4H2O + 3NO 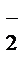 + 3H2O® 2MnO2
+ 3H2O® 2MnO2  + 8 OH- + 3NO
+ 8 OH- + 3NO 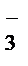 + 6H+.
+ 6H+.
Приводим подобные, учитывая:
8 ОН 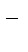 + 6Н+ = 6Н2О + 2ОН
+ 6Н+ = 6Н2О + 2ОН 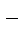 .
.
Краткое ионно-молекулярное уравнение будет иметь вид
2MnO 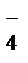 + 3NO
+ 3NO 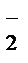 +H2O® 2MnO2
+H2O® 2MnO2  +3NO
+3NO 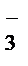 + 2OH
+ 2OH 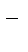 .
.
В молекулярной форме уравнение имеет вид
2KMnO4 + 3NaNO2 + H2O ® 2MnO2 + 3NaNO3 + 2KOH.
Проверка: а) баланс по частицам, которые не участвовали в ОВР: Na+ (3 = 3); K+ (2 = 2); б) баланс по кислороду: 15 = 15.
3. Щелочная среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + KOH ® K2MnO4 + NaNO3 + H2O.
Ионно-молекулярнаясхемареакции:
K++MnO 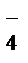 + Na++NO
+ Na++NO 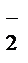 + K++ OH
+ K++ OH 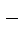 ® 2K++MnO
® 2K++MnO 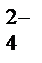 + Na++NO
+ Na++NO 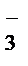 + H2O.
+ H2O.
Краткая ионно-молекулярная схема реакции:
+7 +3 +6 +5
MnO 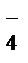 + NO
+ NO 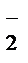 +OH
+OH 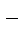 ® MnO
® MnO 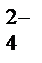 + NO
+ NO 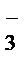 + H2O
+ H2O
oк-ль в-ль продукт в-ния продукт ок-ия
Уравнения полуреакций:
2 НОКMnO 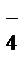 + 1ē®MnO
+ 1ē®MnO 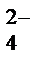 – процесс восстановления
– процесс восстановления
2
1 NO 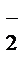 + 2OH
+ 2OH 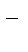 - 2ē®NO
- 2ē®NO 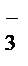 + H2O – процесс окисления
+ H2O – процесс окисления
-3 - (-2) = -1
Суммарное ионно-молекулярное уравнение:
2MnO 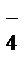 + NO
+ NO 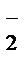 +2OH
+2OH 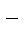 ® 2MnO
® 2MnO 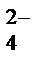 + NO
+ NO 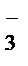 + H2O.
+ H2O.
В молекулярной форме уравнение имеет вид
2KMnO4 + NaNO2 + 2KOH ® 2K2MnO4 + NaNO3 + H2O
Проверка: а) баланс по частицам, которые не участвовали в ОВР: К+ (4 = 4); Na+ (1 = 1); б) баланс по кислороду: 12 = 12.
Восстановители и окислители
Для протекания химической ОВР необходимо присутствие атомов, молекул или ионов, взаимно противоположных по способности отдавать или присоединять электроны.
Окислительно-восстановительные свойства элементов зависят от их положения в периодической системе элементов Д. И. Менделеева и от их степени окисления в составе веществ.
В периодах системы Д. И. Менделеева с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, в 3-м периоде натрий – самый активный восстановитель, а хлор – самый активный окислитель. Объясняется это строением атомов элементов (раздел 2.13).
В подгруппах периодической системы Д. И. Менделеева с повышением порядкового номера элемента, т.е. сверху вниз, возрастают восстановительные свойства простых веществ, а окислительные– убывают. Так, в главной подгруппеVI группы кислород – окислитель, сера проявляет слабые окислительные свойства, а теллур в некоторых реакциях уже является восстановителем. Это объясняется возрастанием сверху вниз числа энергетических уровней атомов, их радиус становится больше и, следовательно, внешние электроны слабее удерживаются.
Атомы металлов присоединять электроны не могут, они обладают только восстановительными свойствами, поэтому металлы часто называют элементами-восстановителями. Атомы типичных металлических элементов содержат на внешнем уровне главным образом по 1-3 электрона. К ним относятся все s-элементы, кроме водорода и гелия, все d- и f-элементы и часть р-элементов (Al, Ga, In, Tl). Исключение: атомы олова Sn, свинца Pb на внешнем уровне имеют четыре электрона, атомы сурьмы Sb, висмута Bi– пять, атомы полония Po – шесть, но из-за большого атомного радиуса обладают восстановительными, металлическими свойствами.
Для неметаллов более характерно присоединение электронов, поэтому часто неметаллы называют элементами – окислителями. Атомы неметаллических элементов содержат на внешнем уровне, как правило, 4-7 электронов.
Наиболее активно присоединяют электроны атомы фтора, который имеет саму высокую электроотрицательность, является самым сильным окислителем и в реакциях не отдаёт электронов. За ним по величине электроотрицательности и, следовательно, по окислительной способности идёт кислород, атомы которого могут отдавать электроны только атомам фтора.
Другие неметаллы могут не только принимать, но и отдавать электроны, а значит, проявляют не только окислительные, но и восстановительные свойства. Последние, однако, у них выражены много слабее, чем окислительные. Все зависит от того, с каким веществом вступает в реакцию данный неметалл. Если это восстановитель, то атом неметалла проявляет окислительные свойства. Например, сера является окислителем в реакции взаимодействия с железом; при взаимодействии с кислородом, наоборот, сера проявляет свойства восстановителя:
Fe + S = FeS S +O2 = SO2
Fe - 2ē = Fe+2 S - 4ē = S+4
S + 2ē = S-2 O2 + 4ē = 2O-2
Наиболее ярко восстановительные и окислительные свойства выражены у атомов элементов «крайних» групп периодической системы – щелочных металлов и галогенов. Лучшими восстановителями являются щелочные металлы и наиболее активный из них– франций. Лучшие окислители – галогены и наиболее активный из них фтор. По мере приближения к середине периодической системы (4 группа), как восстановительные, так и окислительные свойства атомов становятся менее ярко выраженными.
Элементы в составе соединений, находящиеся в высшей степени окисления, могут в ОВР выступать только в качестве окислителей,степень окисления элемента может в этом случае только понижаться. Соответственно молекулы, ионы, содержащие атомы элементов (металлов и неметаллов) в высшей степени окисления, также являются окислителями.
+7 -2 +6 -2 +5 -2 +4 -2
Например, MnO4-, Cr2O72-, NO3-, CO2 и др.
Элементарные ионы металлов (Na+, Ca2+, Fe3+, Сu2+, и т.д.) в высшей степени окисления могут обладать только окислительными свойствами, которые тем сильнее выражены, чем меньше активность металла.
Катионы щелочных и щелочноземельных металлов в водных растворах почти не проявляют окислительных свойств. Напротив, ионы малоактивных металлов в высшей степени окисления (Ag+, Au3+, и т.д.) – достаточно сильные окислители.
Элементы в составе соединений, находящиеся в низшей степени окисления, могут быть, наоборот, только восстановителями; здесь степень окисления может только повышаться. Элементарные анионы проявляют только восстановительные свойства. Например, СI-, Br-, I-, S2-, теряя в процессе реакции электроны, окисляются, соответственно, до свободного хлора, брома, йода, серы. Чем активнее неметаллы как окислители, тем менее активны их элементарные анионы как восстановители. Так, в ряду СI-, Br-, I- восстановительная способность возрастает.
Металлы, как простые вещества, ионы металлов в степенях окисления, близких к низшей, например,Mn2+, Fe2+, Сu+, Sn2+и т. д., также могут проявлять восстановительные свойства.
Если же элемент находится в промежуточной степени окисления, то его атомы, в зависимости от условий, могут, как принимать, так и отдавать электроны. В первом случае с.о. элемента будет понижаться, во втором – повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисления, обладают окислительно-восстановительной двойственностью – способностью вступать в реакции, как с окислителями, так и восстановителями.
Например, азотистая кислота HNO2 и ее соли, где с.о. атома азота равна (+3), вступают в реакции, как с сильными окислителями, так и с сильными восстановителями. В качестве примеров окислительно-восстановительной двойственности азотистой кислоты и ее солей можно привести следующие реакции:
5 KNO2 + 2 KMnO4 + 3H2SO4 = 5 KNO3 + 2 MnSO4 + K2 SO4 + 3H2O
2HNO2 + H2S = 2NO + S + 2H2O
Наиболее часто применяемые восстановители и окислители приведены в табл. 9.1.
Таблица 9.1
Дата: 2019-02-19, просмотров: 398.