Молекулы кислот в водедиссоциируют на ионы водорода (гидроксония-гидратированный ион водорода)и на анионы кислотного остатка.
Например, уравнение диссоциации азотной кислоты имеет вид:
HNO3+H2O = H3O+ + NO3ˉ
или при упрощенной записи:
НNО3 = Н+ + NО3ˉ.
Максимальное число ионов водорода, образующихся из одной молекулы кислоты, определяет ее основность, следовательно, НNО3– одноосновная кислота.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых – в меньшей.
Чем лучше кислота диссоциирует, т.е. чем больше ее константа диссоциации, тем она сильнее. Например, азотная кислота более сильная, чем йодноватая, т.к. Кд (HNO3) = 4,36∙10 > Кд(HIO3) = 1,7∙10-1.
Многоосновные кислоты диссоциируют ступенчато, последовательно отщепляя один ион водорода за другим, и каждая ступень ионизации характеризуется определенной константой диссоциации. Если кислота слабая, то на всех ступенях процесс обратимый. Так, для ортофосфорной кислоты:
1. Н3РО4D Н+ + Н2РО4ˉ 
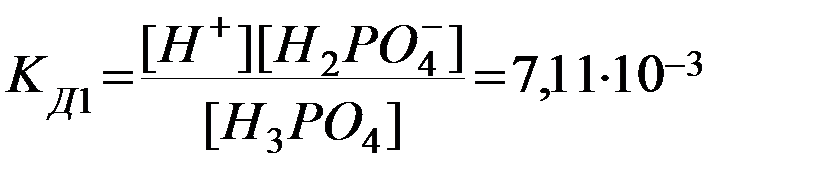 .
. 
2. Н2РО4ˉ D Н+ + НРО42- 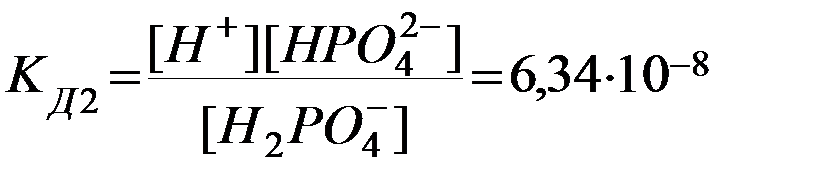 .
.
3. НРО42-D Н+ + РО43- 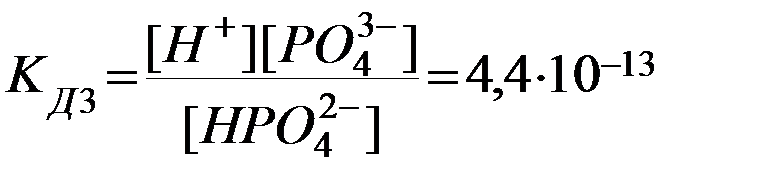 .
.
Из сопоставления приведенных выше значений констант диссоциации следует, что Кд1> Кд2> Кд3. Первый ион водорода отрывается от молекулы легче, последующие все труднее, т.к. возрастает отрицательный заряд кислотного остатка; поэтому в не очень разбавленных растворах фосфорной кислоты ионов РО43- мало. Неравенства Кд1> Кд2> …Кдn характерны и для других многоосновных кислот. Ориентировочно можно считать, что каждая последующая константа диссоциации меньше предыдущей в 105 раз. Они связаны между собой соотношением: КД= КД1∙ КД2∙…∙КДn.
Многоосновные сильные кислоты диссоциируют по первой ступени как сильные электролиты, а по второй – как электролиты средней силы, например:
Н2SО4 = Н+ + НSО4ˉ КД1=1∙103,
НSО4-D Н+ + SО42- КД2=2∙10-2.
Способность многоосновных кислот диссоциировать ступенчато объясняет их склонность к образованию кислых солей.
Сила кислородсодержащих кислот зависит от строения молекулы. Формулу кислородсодержащих кислот в общем виде можно записать ЭОm(OH)n, имея в виду, что в их молекулах имеются связи Н-О-Э и Э=О. Как показывают исследования, сила кислот практически не зависит от n (числа ОН-групп), но заметно возрастает с увеличением m (числа несвязанных в ОН-группы атомов кислорода, т.е. со связями Э=О). По первой ступени ионизации кислоты типа Э(ОН)n относятся к очень слабым (Кд1 = 10-8 – 10-11, рКд1=7 – 11), типа ЭО(ОН)n – к слабым (Кд1=10-2– 10-4, рКд1=1,5 – 4), типа ЭО2(ОН)n – к сильным и типа ЭО3(ОН)n – к очень сильным (табл.8.2).
Таблица 8.2
Классификация кислородсодержащих кислот по их силе в водных растворах
| Тип кислоты | Кислота | КД | рКД | Сила кислот |
| Э(ОН)n | HBrO | 2,06∙10-9 | 8,7 | Очень |
| HClO | 3,2∙10-8 | 7,5 | слабые | |
| HIO | 2,3∙10-11 | 10,64 | ||
| H3AsO3 | 6∙10-10 | 9,2 | ||
| H3BO3 | 5,8∙10-10 | 9,24 | ||
| H4SiO4 | 2∙10-10 | 9,7 | ||
| H6TeO6 | 2∙10-8 | 7,7 | ||
| ЭО(ОН)n | HClO2 | 1,1∙10-2 | 1,97 | Слабые |
| HNO2 | 5,7∙10-4 | 3,29 | ||
| H2CO3 | 1,32∙10-4 | 3,88 | ||
| H2SO3 | 1,3∙10-2 | 1,87 | ||
| H3AsO4 | 6,46∙10-3 | 2,19 | ||
| H3РO4 | 7,25∙10-3 | 2,12 | ||
| H5IO6 | 3,1∙10-2 | 1,57 | ||
| ЭО2(ОН)n | HBrO3 | 2∙10-1 | 0,7 | Сильные |
| HClO3 | ~ -1 | |||
| HIO3 | 1,7∙10-1 | 0,77 | ||
| HNO3 | 4,36∙10 | ~1,64 | ||
| H2MnO4 | ~10-1 | - 1 | ||
| H2SO4 | 1∙103 | -3 | ||
| ЭО3(ОН)n | HClO4 | ~ -10 | Очень | |
| HMnO4 | 1∙103 | ~2,3 | сильные |
Примечание: ∙В таблице приведены значения КД первой ступени ионизации кислот.
Резкое возрастание силы в ряду кислот с увеличением m можно объяснить оттягиванием электронной плотности от связи Н-О на связь Э=О.
С увеличением степени окисления центрального атома Э изменение состава образуемых им кислородсодержащих кислот отвечает увеличению m, например:
| Кислота | +1 HClO | +3 HClO2 | +5 HClO3 | +7 HClO4 |
| Тип кислоты | Cl(OH) | ClO(OH) | ClO2(OH) | ClO3(OH) |
| рКд | 7,25 | 1,97 | -1 | -5 |
В этом проявляется общая закономерность: с увеличением степени окисления элемента в ряду его гидроксидов основные свойства ослабевают, кислотные – усиливаются, например:
| Соединение | +2 Mn(OH)2 | +3 Mn(OH)3 | +4 Mn(OH)4 | +6 H2MnO4 | +7 HMnO4 |
| H4MnO4 | |||||
| Кислотно-основные свойства | Основание средней силы | Основание слабое | А мфотерное соединение | Кислота сильная | Кислота очень сильная |
Молекулы оснований в водедиссоциируют на катионы металлов (исключение - NН4ОН D NН4+ + ОН ˉ) и гидроксид-ионы.
Например, уравнение диссоциации гидроксида натрия имеет вид
NаОН = Nа+ + ОНˉ.
Максимальное число гидроксид-ионов, образующихся из одной молекулы основания, определяет его кислотность, следовательно,NaOH – однокислотное основание.
Чем больше константа диссоциации основания, тем оно сильнее. Например, гидроксид лития более сильное основание, чем гидроксид аммония, т.к. Кд(LiOH) = 6,75∙10-1> Кд (NH4OH) = 1,8∙10-5.
Многокислотные основания диссоциируют ступенчато, последовательно отщепляя один гидроксид – ион за другим, и каждая ступень ионизации характеризуется определенной константой диссоциации. Если основание слабое, то на всех ступенях процесс протекает обратимо, например:
Fе(ОН)3D Fе(ОН)2+ + ОНˉ ,
Fе(ОН)2+D Fе(ОН)2+ + ОНˉ ,
Fе(ОН)2+D Fе3+ + ОНˉ .
Многокислотные сильные основания диссоциируют по первой ступени как сильные электролиты, а по второй – как электролиты средней силы, например:
Са(ОН)2 = СаОН+ + ОНˉ,
СаОН+D Са2+ + ОНˉ.
Этим объясняется способность оснований многовалентных металлов образовывать основные соли, например Zn(ОН)Сl, Fе(ОН)Сl2 и др.
Гидроксиды многих металлов в водных растворах могут диссоциировать и по кислотному, и по основному типу. Соединения, которые в зависимости от условий проявляют как кислотные, так и основные свойства, называются амфотерными или амфолитами.
Амфотерность электролитов объясняется малым различием прочности связей Э-О и О-Н. К амфотерным электролитам относятся :Zn(ОН)2, Al(ОН)3, Be(ОН)2, Ga(ОН)3, Cr(ОН)3, Ge(ОН)2, Sn(ОН)4, Pb(ОН)2 и др. Примером может служить диссоциация гидроксида цинка:
2H+ +[Zn(OH)4]2ˉDZn(OH)2 +2H2OD [Zn(H2O)2]2+ +2OHˉ.
При этом в кислой среде равновесие сдвигается вправо, в щелочной– влево. При взаимодействии гидроксида цинка, например, с азотной кислотой образуется нитрат цинка:
Zn(OH)2 + 2HNO3D Zn(NO3)2 + 2H2O;
при взаимодействии же с гидроксидом калия – тетрагидроксоцинкат калия:
Zn(OH)2 + 2KOH D K2[Zn(OH)4].
Соли при электролитической диссоциации образуют катионы металлов (исключение соли аммония) или комплексные катионы и одноатомные или многоатомные анионы.
Соли бывают средние (нейтральные, например, СаSО4), кислые (СаНРО4), основные (Zn(ОН)Сl), комплексные (K2[Zn(OH)4]).
Средние соли диссоциируют в одну стадию. Например,
Nа2SО4 = 2Nа+ + SО  .
.
В кислых солях отщепляется сначала ион металла по типу сильного электролита, затем – ионы водорода по типу слабого электролита.
Например: NаН2РО4 = Nа+ + Н2РО 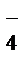 ,
,
Н2РО 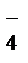 D Н+ + НРО
D Н+ + НРО 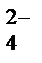 ,
,
НРО 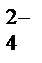 D Н+ + РО
D Н+ + РО 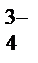 .
.
В последних двух ступенях равновесие сдвинуто влево, поэтому ионов Н+ в растворе очень мало.
В основных солях сначала отщепляется кислотный остаток по типу сильного электролита, затем – гидроксид-ионы по типу слабого электролита. Например,
(ZnОН)2SО4 = 2ZnОН+ + SО 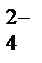 ,
,
ZnОН+D Zn2+ + ОНˉ.
В последней стадии равновесие сдвинуто влево, поэтому ионов ОНˉ в растворе мало.
Дальнейшее развитие теории растворов привело к созданию ряда теорий, описывающих свойства кислот и оснований. К наиболее известным и применимым относятся следующие.
Дата: 2019-02-19, просмотров: 380.