Изучение тщательно очищенной от посторонних примесей воды показало, что она обладает определенной, хотя и незначительной электрической проводимостью, заметно возрастающей с повышением температуры. Так, при 273К удельная электрическая проводимость воды составляет 1,5·10-8 Ом-1·см-1, при 289К – 6,2·10-8 Ом-1·см-1.
Наличие электрической проводимости может быть объяснено только тем, что молекулы воды, хотя и в незначительной степени, распадаются на ионы, т.е. вода является слабым электролитом.
Процесс диссоциации воды может быть записан с учетом электростатического взаимодействия полярных молекул (самоионизации), в ходе которого образуются ионы гидроксония и гидроксид-ионы:
2Н2О D Н3О+ + ОН‾
или в упрощенной форме: Н2О D Н+ + ОН‾.
Выражение константы электролитической диссоциации воды:
 (при 25°С).
(при 25°С).
Ничтожно малая диссоциация воды позволяет считать концентрацию недиссоциированных молекул равной общей концентрации, которая для воды объемом 1л. составляет:
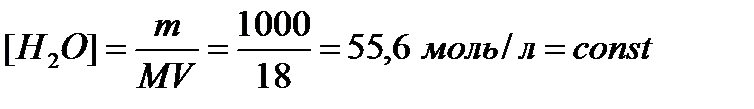 .
.
Найдем из выражения для Кд произведение двух постоянных при данной температуре величин:
Кд·[Н2О] = [Н+][ОН‾] = 1,8·10-16·55,6=10-14.
Произведение [Н+][ОН‾] называется ионным произведением воды (обозначается: КВ илиKw): КВ=[Н+][ОН‾]. Это величина постоянная при данной температуре.
Так при 25°С, ионное произведение воды КВ=[Н+][ОН‾] = 10-14.
Таким образом, для воды, разбавленных водных растворов кислот, щелочей, солей и др. соединений ионное произведение воды практически постоянная величина и зависит только от температуры:
| Температура, 0С | 0 | 25 | 100 |
| КB | 0,113·10-14 | 10-14 | 55·10-14 |
Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называют нейтральными.
В чистой воде и нейтральных растворах при 25°С [Н+] = [ОН‾] =10-7 моль/л. Если [Н+] > 10-7 моль/л, то среда кислая; если [Н+] < 10-7 моль/л, то среда щелочная.
Для удобства количественной характеристики кислотных или щелочных свойств растворов введена величина, называемая водородным показателем (рН) – это отрицательный десятичный логарифм концентрации ионов Н+:
рН= –lg[Н+].
- В нейтральной среде [Н+]=10-7 моль/л, рН= – lg10-7 = 7;
- в кислой среде рН <7;
- в щелочной среде рН > 7.
Аналогично введен гидроксильный показатель (рОН) – это отрицательный десятичный логарифм концентрации гидроксид-ионов:
рОН= – lg[ОН¯].
Прологарифмируем с обратным знаком выражение для КВ при 25°С, используем введенные показатели рН и рОН и получим рН + рОН = 14.
Понятие об индикаторах
Индикаторы – вещества, меняющие свою окраску в определенной области значений рН раствора.
Индикаторами могут быть слабые органические кислоты HInd и основания IndOH, молекулы и ионы которых имеют разную окраску. Будучи введенными в исследуемый раствор, индикаторы диссоциируют по одному из следующих механизмов:
HInd D H+ + Ind¯ (а)
IndOH D Ind+ + OH¯ (б).
Так как процесс диссоциации слабых электролитов обратим, положение равновесия в схемах (а) и (б) зависит от кислотности исследуемого раствора.
В кислых растворах индикаторы, представляющие собой слабые кислоты, в соответствии с принципом Ле-Шателье находятся преимущественно в виде молекул и окраска раствора соответствует молекулярной форме индикатора НInd.
Индикаторы, являющиеся слабыми основаниями, в растворах кислот, напротив, будут находиться в своей ионной форме Ind+, которая обусловливает окраску раствора.
К числу индикаторов, представляющих собой слабые органические кислоты, принадлежат лакмус, фенолфталеин, феноловый красный, ализариновый желтый. К индикаторам, представляющим слабые основания, относятся, например, метиловый оранжевый, метиловый красный. Выбор того или иного индикатора определяется интервалом рН, в котором необходимо поддерживать кислотность исследуемого раствора.
Например, лакмус
НIndDH+ + Ind¯
красный синий
рН < 6 рН > 8
рН = 6÷8 область перехода рН (фиолетовый цвет).
Дата: 2019-02-19, просмотров: 486.