Названия комплексных соединений (солей) образуют по общему правилу:сначала называют анион, а затем – катион в родительном падеже.
1.Название комплексного катионасоставляют следующим образом:
а. Сначала указывают числа (используя греческие числительные) и названия анионных (отрицательно заряженных) лигандов с окончанием «о».
Греческие числительные:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| моно | ди | три | тетра | пента | гекса | гепта | окта | нона | дека |
Названия анионных лигандов:
| Сl– | CN– | SО32– | SО42– | ОН– | NО2– | СNS– | СО32– | N3– |
| хлоро | циано | сульфито | сульфато | гидроксо | нитро | родано | карбонато | азидо |
б. Затем называют числа и названия нейтральных лигандов:
| Н2О | NН3 | СО | NO |
| аква | аммин | карбонил | нитрозил |
в. Последним называется комплексообразователь в родительном падеже с указанием степени его окисления (в скобках римскими цифрами после названия комплексообразователя).
Например, [Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины (II).
Если металл образует ион с одной степенью окисления, то она в название комплекса может не входить. Например, [Zn(NH3)4]Cl2 – дихлорид тетраамминцинка.
2. Название комплексного анионаобразуется аналогичным образом, с добавлением суффикса «ат» к корню латинского названия комплексообразователя (например, феррат, никелат, хромат, кобальтат, купрат и т.д.).
Например:
K2[PtCl6] – гексахлороплатинат (IV) калия;
Ba[Cr(NH3)2(SCN)4]2 – тетрароданодиамминхромат (III) бария;
K3[Fe(CN)6] – гексацианоферрат (III) калия;
K2[BeF4] – тетрафторобериллат калия.
3. Названия нейтральных комплексных частиц образуются так же, как и катионов, но комплексообразователь называют в именительном падеже, а степень его окисления не указывают, т.к. она определяется электронейтральностью комплекса.
Например:
[Pt(NH3)2Cl2] – дихлородиамминплатина;
[Ni(CO)4] – тетракарбонилникель.
Классификация комплексных соединений
Комплексные соединения очень разнообразны по строению и свойствам. Системы их классификации основываются на различных принципах:
1. По характеру электрического заряда различают катионные, анионные и нейтральные комплексы.
Комплекс с положительным зарядом называют катионным, например, [Cu(NН3)4]2+, с отрицательным зарядом – анионным, например, [Cd(СN)4]2–, с нулевым зарядом – нейтральным, например, [Fе(СО)5].
2. По типу лигандов различают:
а. Аквакомплексы или гидраты – комплексные соединения, в которых лигандами являются молекулы воды.
Например: [Cr(H2O)6]Cl3 – хлорид гексааквахрома (III);
[Co(H2O)6]Cl2 – хлорид гексааквакобальта (II).
б. Аммиакаты – комплексные соединения, в которых лигандами являются молекулы аммиака (NН3).
Например:[Zn(NH3)4]SO4 – сульфат тетраамминцинка;
[Ag(NH3)2]Cl – хлорид диамминсеребра (I).
в. Карбонилы металлов – комплексные соединения, в которых лигандами служат молекулы оксида углерода (II).
Например, [Fe(CO)5] – пентакарбонилжелезо.
г. Ацидокомплексы – комплексные соединения, в которых лигандами являются кислотные остатки - анионы каких-либо кислот (F–, Cl–, Br–, I–, CN–, NO2–, SO42–, PO43– и др.). К ацидокомплексам относятся двойные соли и гидроксокомплексы (у них лиганд гидроксид – ион ОН–).
Между этими классами существуют переходные ряды, которые включают комплексы с различными лигандами.
Например: К[Pt(NH3)3Cl3] – трихлоротриамминплатинат (II) калия.
3. По химическим свойствам различают кислоты, основания, соли, неэлектролиты:
а) кислоты, например:H[AuCl4] – тетрахлороаурат (III) водорода;H2[PtCl6] – гексахлороплатинат (IV) водорода;
б) основания, например:[Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II);[Ag(NH3)2]OH – гидроксид диамминсеребра;
в) соли, например:K3[Al(OH)6] – гексагидроксоалюминат калия;
[Cr(H2O)6]Cl3 – хлорид гексааквахрома (III);г) неэлектролиты, например, [Pt(NH3)2Cl2] – дихлородиамминплатина.
Образование химических связей в комплексных соединениях
Для объяснения образования и свойств комплексных соединений в настоящее время применяют ряд теорий:
- метод валентных связей (МВС);
- теория кристаллического поля;
- метод молекулярных орбиталей.
Согласно МВСпри образовании комплексов между комплексообразователем и лигандами возникает ковалентная связь по донорно-акцепторному механизму.
Комплексообразователи имеют вакантные орбитали, т.е. играют роль акцепторов. Как правило, в образовании связей участвуют различные вакантные орбитали комплексообразователя, поэтому происходит их гибридизация.
Лиганды имеют неподеленные пары электронов и играют роль доноров в донорно-акцепторном механизме образования ковалентной связи.
Для примера рассмотрим образование комплекса [Zn(NH3)4]2+. Электронные формулы валентных электронов:
- атома Zn – 3d10 4s2;
- комплексообразователя иона цинка
| E |
| E |
| E |
| E |
| E |
Zn2+ – 3d10 4s0
3d4s4p
Как видно, у иона цинка на внешнем электронном уровне имеются четыре близкие по энергии вакантные атомные орбитали (одна 4s и три 4р), которые будут подвергаться sр3- гибридизации; ион Zn2+, как комплексообразователь, имеет к.ч.=4.
При взаимодействии иона цинка с молекулами аммиака, атомы азота которого имеют неподеленные пары электронов (:NН3), образуется комплекс:
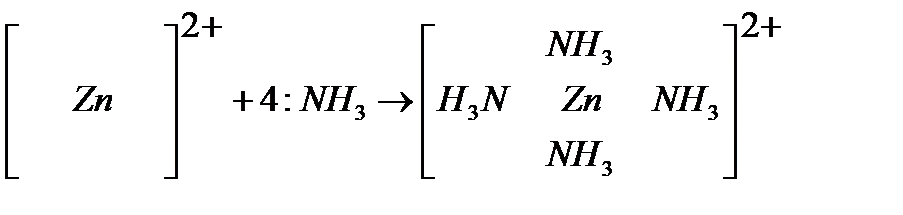
Пространственная структура комплекса определяется типом гибридизации атомных орбиталей комплексообразователя (в данном случае тетраэдр). Координационное число зависит от числа вакантных орбиталей комплексообразователя.
При образовании донорно-акцепторных связей в комплексах могут использоваться не только s- и р- орбитали, но и d-орбитали. В этих случаях происходит гибридизация с участием d-орбиталей. Ниже в таблице приведены некоторые виды гибридизации и соответствующие им пространственные структуры:
| Гибридизация | Структура комплекса | Комплексообразователь |
| sp | Линейная | Ag+, Сu 
|
| sp3 | Тетраэдрическая | Al3+, Zn2+, Co2+, Ti3+, Fe2+, Ni2+ |
| sp2d | Плоская квадратная | Pt2+, Pd2+, Cu2+, Ni2+, Au3+ |
| sp3d2 | Октаэдрическая | Cr3+, Co3+, Ni2+, Pd4+, Pt4+ |
Таким образом, МВС позволяет предсказать состав и структуру комплекса. Однако этот метод не может объяснить такие свойства комплексов, как прочность, цвет и магнитные свойства. Вышеуказанные свойства комплексных соединений описывает теория кристаллического поля.
Дата: 2019-02-19, просмотров: 397.