Внутренняя и внешняя сфера комплексного соединения сильно различаются по устойчивости.
Частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами (ионная связь) и легко отщепляются в водном растворе подобно ионам сильных электролитов.
Диссоциация (распад) комплексного соединения на ионы внешней сферы и комплексный ион (комплекс) называется первичной. Она протекает почти нацело, до конца, по типу диссоциации сильных электролитов.
Например, процесс первичной диссоциации при растворении тетрафторобериллата калия может быть записан по схеме:
К2[ВеF4] = 2К+ + [ВеF4]2–.
Лиганды, находящиеся во внутренней сфере комплексного соединения, связаны с комплексообразователем прочными ковалентными связями, образованными по донорно-акцепторному механизму, и диссоциация комплексных ионов в растворе осуществляется, как правило, в незначительной степени по типу диссоциации слабых электролитов, т.е. обратимо до установления состояния равновесия. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации.
Например, ион тетрафторобериллат диссоциирует лишь частично, что выражается уравнением
[ВеF4]2–D Ве2+ + 4F– (уравнение вторичной диссоциации).
Диссоциация комплекса как обратимый процесс характеризуется константой равновесия, называемой константой нестойкости комплекса Кн.Для рассматриваемого примера
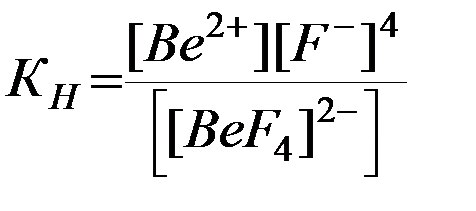 .
.
Кн – табличная (справочная) величина. Константы нестойкости, в выражения которых входят концентрации ионов и молекул, называются концентрационными. Более строгими и не зависящими от состава и ионной силы раствора являются Кн, содержащие вместо концентрации активности ионов и молекул.
Значения Кн различных комплексов колеблются в широких пределах и могут служить мерой их устойчивости. Чем устойчивее комплексный ион, тем меньше его константа нестойкости.
Так, среди однотипных соединений, обладающих различными значениями констант нестойкости:
| Комплекс | [Ag(NO2)2]– | [Ag(NН3)2]+ | [Ag(СN)2]– |
| Кн | 1,3·10–3 | 6,8·10–8 | 1·10–21 |
наиболее устойчив комплекс [Ag(СN)2]–, а наименее устойчив [Ag(NO2)2]–.
Как и любая константа равновесия, константа нестойкости зависит только от природы комплексного иона, комплексообразователя и лигандов, растворителя, а также от температуры и не зависит от концентрации (активности) веществ в растворе.
Чем больше заряды комплексообразователя и лигандов и чем меньше их радиусы, тем выше устойчивость комплексов. Прочность комплексных ионов, образованных металлами побочных подгрупп, выше прочности ионов, образованных металлами главных подгрупп.
Процесс распада комплексных ионов в растворе протекает многоступенчато, с последовательным отщеплением лигандов. Например, диссоциация иона аммиаката меди (II) [Cu(NН3)4]2+ происходит по четырем ступеням, соответствующим отрыву одной, двух, трех и четырех молекул аммиака:
| [Cu(NН3)4]2+D [Cu(NН3)3]2+ + NH3 | КД1= 7,2·10–3 |
| [Cu(NН3)3]2+D [Cu(NН3)2]2+ + NH3 | КД2= 1,3·10–3 |
| [Cu(NН3)2]2+D [Cu(NН3)]2+ + NH3 | КД3 = 3,2·10–4 |
| [Cu(NН3)]2+ D Cu2+ + NH3 | КД4= 7,1·10–5 |
| [Cu(NН3)4]2+ D Cu2+ + 4NH3 | КН |
Для сравнительной оценки прочности различных комплексных ионов пользуются не константой диссоциации отдельных ступеней, а общей константой нестойкости всего комплекса, которую определяют перемножением соответствующих констант ступенчатой диссоциации.
Например, константа нестойкости иона [Cu(NH3)4]2+ будет равна:
KH= KД1· KД2· KД3·KД4 = 2,1·10–13.
Для характеристики прочности (устойчивости) комплексов применяют также величину, обратную константе нестойкости, ее называют константой устойчивости (Куст) или константой образования комплекса:
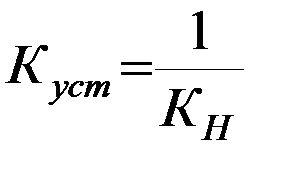 .
.
Равновесие диссоциации комплексного иона может смещаться избытком лигандов в сторону его образования, а уменьшение концентрации одного из продуктов диссоциации, наоборот, может привести к полному разрушения комплекса.
С помощью качественных химических реакций обычно обнаруживаются только ионы внешней сферы или комплексные ионы. Хотя все зависит от произведения растворимости (ПР) соли, образование которой протекало бы при добавлении соответствующих растворов в качественных реакциях. В этом можно убедиться на основании следующих реакций. Если на раствор, содержащий комплексный ион [Ag(NН3)2]+, подействовать раствором какого-нибудь хлорида, то осадка не образуется, хотя из растворов обычных солей серебра при добавлении хлоридов выделяется осадок хлорида серебра. Очевидно, концентрация ионов серебра в растворе слишком мала, чтобы при введении в него даже избытка хлорид-ионов можно было бы достигнуть величины произведения растворимости хлорида серебра (ПРАgСl = 1,8·10–10). Однако после прибавления к раствору комплекса йодида калия выпадает осадок йодида серебра. Это доказывает, что ионы серебра все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, т.к. ПРАgI = 1·10–16, т.е. значительно меньше, чем у хлорида серебра.
Точно так же при действии раствора Н2S получается осадок сульфида серебра Аg2S, произведение растворимости которого равно 10–51.
Ионно-молекулярные уравнения протекающих реакций имеют вид:
[Ag(NН3)2]+ +I–D АgI↓ + 2NН3
х.р.
2[Ag(NН3)2]+ + H2S D Ag2S↓ + 2NH3 + 2NH4+.
х.р.
Комплексные соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, а именно – как соединения молекул.
Например: СаСО3·Nа2СО3; СuСl2·КСl; КСl·MgСl2; 2NaСl·СoСl2.
Двойные солиможно рассматривать как соединения, в узлах кристаллической решетки которых находятся одинаковые анионы, но разные катионы; химические связи в этих соединениях носят преимущественно ионный характер и поэтому в водных растворах они диссоциируют практически полностью на отдельные ионы. Еслирастворить в воде, например, хлорид калия и меди (II), то происходит диссоциация по типу сильного электролита:
CuCl2·KCl = Cu2+ + 3Cl– + K+.
Все образовавшиеся в растворе двойной соли ионы можно обнаружить с помощью соответствующих качественных реакций.
Дата: 2019-02-19, просмотров: 435.