9.1. Общие понятия и определения
Реакции, в ходе которых элементы, входящие в состав реагирующих веществ, изменяют степень окисления, называются окислительно-восстановительными (ОВР).
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Степень окисления (с.о.) – это условный заряд, который приписывается атому в предположении, что все связи в молекуле или ионе предельно поляризованы.
В составе молекулы вещества или ионастепень окисления элемента определяется как число электронов, смещенных от атома данного элемента (положительная степень окисления) или к атому данного элемента (отрицательная степень окисления).
Для вычисления степени окисления элемента в соединении следует исходить из следующих положений (правил):
1. Степень окисления элементов в простых веществах, в металлах в элементном состоянии, в соединениях с неполярными связями равны нулю.Примерами таких соединений являются N20, Н20, Сl20, I20, Мg0, Fe0 и т.д.
2. В сложных веществах отрицательную степень окисления имеют элементы с большей электроотрицательностью.
Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
+1 +7 -2
HCIO4
О-2
О-2 CI 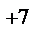 О-2 Н+
О-2 О-2 Н+
О-2
|
|
В некоторых случаях с.о. элемента численно совпадает с валентностью (В) элемента в данном соединении, как, например, в НClО4.
Приведенные ниже примеры показывают, что с.о. и валентность элемента могут численно различаться:
1) N ≡ N В (N)=3; с.о.(N)=0
| 2) СН3ОН Н+ Н+ C-2 О-2 Н+ Н+ |
|
3. Различают высшую, низшую и промежуточные с.о.
Высшая степень окисления – это ее наибольшее положительное значение. Высшая степень окисления, как правило, равна номеру группы (N) периодической системы, в которой элемент находится.
Например, для элементов III периода она равна: Na+, Mg+2, Al+3, Si+4, P+5, S+6, Cl+7.
Исключение составляют фтор, кислород, гелий, неон, аргон, а также элементы подгруппы кобальта и никеля: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся.
У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе.
Низшая степень окисления для неметаллов определяется количеством электронов, недостающих до устойчивого состояния атома ns2nр6и равна (N-8), где N – номер группы периодической системы, в которой элемент находится.
Например, для неметаллов III периода она равна: Si-4, P-3, S-2,Clˉ.
Низшая степень окисления для металлов равна 0, которую они проявляют в простых веществах.
Все остальные встречающиеся степени окисления элемента называют промежуточными.
Например, для серы с.о., равная +4, является промежуточной.
4. Ряд элементов проявляют в сложных соединениях постоянную степень окисления:
| № п.п. | Элемент | с.о. | В |
| 1 | Щелочные металлы: Li, Na, K, Rb, Cs, Fr | +1 | 1 |
| 2 | Металлы. 2 гр.(А и В подгрупп) за исключением Hg (может.проявлять с.о. +1 и +2) | +2 | 2 |
| 3 | Металлы 3А группы за исключением Tl (может проявлять степени окисления +1 и +3) | +3 | 3 |
| 4 | F | -1 | 1 |
| 5 | Н (кроме гидридов металлов (NaH, CaH2 и т.д.), где его с.о. (-1)) | +1 | 1 |
| 6 | О в большинстве соединений –О-2 (исключение: пероксиды элементов (Н2О2, СаО2 и т.д.), где с.о. кислорода равна -1, надпероксиды элементов (КО2, NaO2 и т.д.), с.о.= – ½, фторид кислорода ОF2, с.о.= +2) | -2 | 2 |
5. Большинство элементов в соединениях могут проявлять разную степень окисления.При определении с.о. пользуются правилом:сумма с.о. элементов в электронейтральных молекулах равна нулю, а в сложных ионах – заряду этих ионов.
Вычислим с.о. фосфора в ортофосфорной кислоте Н3РО4. Сумма с.о. всех элементов, входящих в составмолекулы, равна нулю.Обозначим с.о. фосфора через х и составим следующее уравнение: (+1)∙3+х∙1+(-2)∙4 = 0, из которого х = +5.
Вычислим с.о. хрома в составе дихромат–иона (Cr2О7)2-.
Сумма всех степеней окисления в сложном ионе равна заряду иона, т.е. -2.Обозначим с.о. хрома через х и составим уравнение 2·х+7∙(-2) = -2, из которого х = +6.
Для большинства соединений понятие степень окисления имеет условный характер, т.к. не отражает реальный эффективный заряд атома. В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного
+1 -1 +2 -1 +3 -1
атома к другому: NaI, MgCl2, AlF3. Для соединения с полярной ковалентной связью фактический эффективный заряд меньше степени окисления, однако это понятие весьма широко используется в химии.
Дата: 2019-02-19, просмотров: 374.