В растворах электролитов реагирующими частицами являются ионы (точнее сольватированные или гидратированные ионы). Реакции, осуществляющиеся в результате обмена ионами между электролитами, называются ионообменными (или реакциями ионного обмена). Отличительной чертой реакций ионного обмена (РИО) является сохранение элементами их степеней окисления (реакции протекают без изменения заряда простых и сложных ионов).
Различают обратимые и необратимые РИО. Все реакции между ионами обратимы, протекают очень быстро. Однако в некоторых случаях равновесие сильно смещено в сторону образования продуктов реакции из-за удаления их из сферы реакции (т.е. реакции практически идут до конца, необратимы). РИО протекают практически необратимо, если исходные компоненты – сильные электролиты и растворимые вещества, а в ходе реакции образуются:
- осадки (нерастворимые или малорастворимые);
- газообразные вещества;
- слабые электролиты (малодиссоциирующие вещества);
- комплексные соединения.
В уравнениях необратимых РИО принято ставить знак « = ».
Закономерности, характерные для обратимых ионнообменных реакций:
1. Реакция ионного обмена обратима (может протекать в двух направлениях), если среди исходных и образующихся веществ есть слабые электролиты, нерастворимые, малорастворимые или газообразные вещества или если и исходные, и образующиеся вещества являются растворимыми и сильными электролитами. В уравнениях таких реакций ставят знак обратимости «D».
2. Равновесие такой реакции смещается в направлении наиболее полного связывания ионов (их наименьшей концентрации в растворе).
Реакции обмена, написанные в молекулярной форме, не отражают особенностей взаимодействия между ионами в растворе. Сущность взаимодействия в растворах электролитов отражают ионно-молекулярные уравнения – полные и краткие. При составлении ионно-молекулярных уравнений:
1) сильные электролиты и одновременно растворимые вещества записывают в виде ионов;
2) слабые электролиты (малодиссоциирующие), нерастворимые, малорастворимые и газообразные вещества записывают в виде молекул с соответствующими значками: ↓ или ↑;
3) краткое ионно-молекулярное уравнение получают из полного путем исключения из него тех ионов, которые присутствуют в неизменном виде и количестве в правой и левой частях.
Примеры:
1. Молекулярное уравнение:
ВаСl2 + Nа2SО4 = ВаSО4↓ + 2NаСl.
Полное ионно-молекулярное уравнение:
Ва2+ + 2Сl 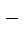 + 2Nа+ + SО
+ 2Nа+ + SО 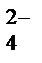 = ВаSО4↓ + 2Nа+ + 2Сl
= ВаSО4↓ + 2Nа+ + 2Сl 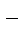 .
.
Сущность ионного процесса выражает краткое ионно-молекулярное уравнение:
Ва2+ +SО 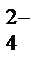 = ВаSО4↓.
= ВаSО4↓.
Поскольку ВаSО4 выпадает в осадок, который не участвует в обратной реакции, то и равновесие рассматриваемого процесса сильно смещено вправо, т.е. реакция практически идет до конца (∆G°= -60 кДж).
2. Nа2СО3 + Н2SО4 = Nа2SО4 + 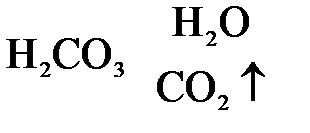 ,
,
2Nа+ + СО 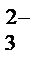 + 2Н+ + SО
+ 2Н+ + SО 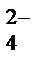 = 2Nа+ + SО
= 2Nа+ + SО 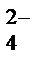 + Н2О + СО2↑,
+ Н2О + СО2↑,
СО 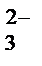 + 2Н+ = Н2СО3 = Н2О + СО2↑.
+ 2Н+ = Н2СО3 = Н2О + СО2↑.
В результате реакции получается газообразное вещество и слабый электролит.
3. 2КСN + Н2SО4 = 2НСN + К2SО4,
Н+ +СN 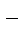 = НСN.
= НСN.
В результате реакции получается малодиссоциирующее соединение (слабый электролит) – НСN.
Обобщая этот пример, можно сделать вывод, что сильные кислоты вытесняют слабые из растворов их солей (аналогично сильные основания вытесняют слабые основания из растворов их солей).
К обменным ионным процессам относятся также реакции нейтрализации, в результате которых образуется слабый электролит – вода.
Например: НСl + КОН = Н2О + КСl,
Н+ + ОН ˉ = Н2О.
Реакции нейтрализации любых других сильных кислот и оснований протекают аналогично. Поскольку соль полностью диссоциирует на ионы, реакция в любом случае протекает лишь между ионами Н+ и ОН ˉ.
4. ZnСl2 + 4КОН = К2[Zn(ОН)4] + 2КCl,
Zn2+ + 4ОН‾ = [Zn(ОН)4]2‾.
В результате реакции образуется комплекс (комплексный ион).
5. НСN + СН3СООNа D СН3СООН + NаСN,
х.р.
НСN + СН3СОО‾ D СН3СООН + СN‾.
х.р.
NН4ОН + НСl D Н2О + NН4Сl,
х.р.
NН4ОН + Н+D Н2О + NН4+.
х.р.
Слабые электролиты есть и в левой, и в правой частях уравнений реакций. Равновесие обратимого процесса в этих случаях смещается в сторону образования вещества, обладающего меньшей константой диссоциации. В первой реакции равновесие смещено влево (КНСN=4,9·10‾10, КСН3СООН=1,8·10‾5), во второй – вправо (КН2О=1,8·10‾16, КNН4ОН=1,8·10‾5). Это отвечает значениям ∆G°=43 кДж и (-84 кДж), соответственно, для первой и второй реакций.
Дата: 2019-02-19, просмотров: 434.