Теория слабых электролитов. Константа диссоциации
В растворах слабых электролитов процесс диссоциации протекает обратимо, т.е. идет до установления состояния равновесия, следовательно, к нему может быть применен закон действующих масс для обратимых процессов.
Обратимый процесс диссоциации слабого электролита характеризу-етсяконстантой равновесия.Так, для процесса диссоциации слабого электролита
КmАnD mКn+ + nАm–
можно записать константу равновесия:
| КД |

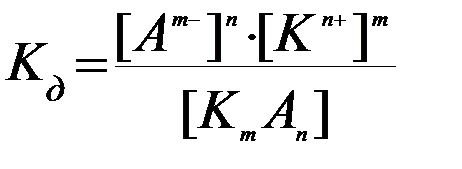 ,
,
где [Кn+],[Аm–],[КmАn] – равновесные концентрации компонентов раствора;m и n – стехиометрические коэффициенты компонентов в уравнении диссоциации;Кд – константа равновесия для процесса диссоциации слабого электролита, называемая константой диссоциации..
Например, для процесса диссоциации уксусной кислоты
СН3СООН D СН3СОО- + Н+
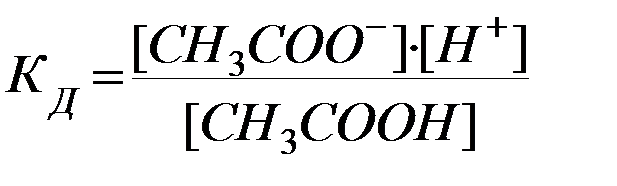 .
.
Кд представляет собой важную характеристику слабых электролитов, т.к. указывает на прочность их молекул в данном растворе. Чем меньше Кд в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы. Кд – табличная величина.
Как и любая константа равновесия, константа диссоциации зависитот природы растворенного вещества и растворителя, от температуры и не зависит от концентрации раствора.
С повышением температуры константа диссоциации обычно уменьшается. Например, константа диссоциации уксусной кислоты при 293, 298 и 373 К соответственно равна 1,85·10-5, 1,75·10-5, 1,35·10-5 (т.е. процесс диссоциации является экзотермическим).
Следует отметить, что строго законы химического равновесия применимы только к слабым электролитам, поэтому описание электролитической диссоциации законом действующих масс является одним из основных признаков слабых электролитов.
Между Кд и α существует количественная зависимость. Примем для процесса диссоциации бинарного электролита
КА D К+ + А–
молярную концентрацию растворенного вещества КА равной С, а степень диссоциации α, тогда равновесные концентрации ионов в растворе будут равны [А-]=[К+]= αС, а равновесная концентрация недиссоциированных молекул [КА] = С – αС, то
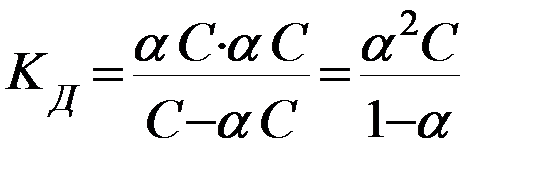 ,
,
где (1-α) – доля недиссоциированных молекул вещества. Полученное соотношение называется законом разбавления Оствальда. В случае слабых электролитов если α<<1, то
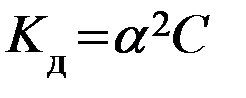 и
и 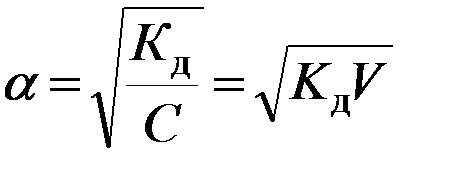 ;
;
здесь 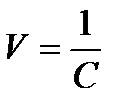 –разбавление раствора.
–разбавление раствора.
Значения Кд для разных электролитов приведены в справочной литературе.
Для расчетов, связанных с диссоциацией кислот, часто удобно пользоваться не константой Кд, а так называемым показателем константы диссоциации рК, который определяется соотношением
рК = – lg Кд.
Очевидно, что с возрастанием Кд, т.е. с увеличением силы кислоты, значение рК уменьшается; следовательно, чем больше рК, тем слабее кислота.
Степень диссоциации электролита α связана с изотоническим коэффициентом i соотношением:
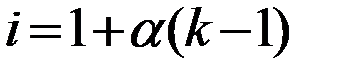 или
или 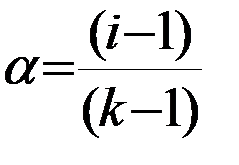 ;
;
где k – число ионов, на которые распадается при диссоциации молекула электролита (для КСlk = 2, для ВаСl2 и Nа2SО4 k=3 и т.д.).
Таким образом, найдя по опытным величинам ∆р, ∆tзам и т.п. значение i, можно вычислить степень диссоциации электролита в данном растворе. При этом следует иметь в виду, что в случае сильных электролитов найденное таким способом значение α выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие кажущейся степени диссоциации от единицы связано с межионными взаимодействиями в растворах сильных электролитов.
Теория сильных электролитов.
В водных растворах сильные электролиты полностью диссоциируют, поэтому число ионов в них больше, чем в растворах слабых электролитов той же концентрации. И если в растворах слабых электролитов концентрация ионов мала, расстояние между ними велико и взаимодействие между ионами незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнительно мало. Между ними возникает электростатическое взаимодействие, которое приво 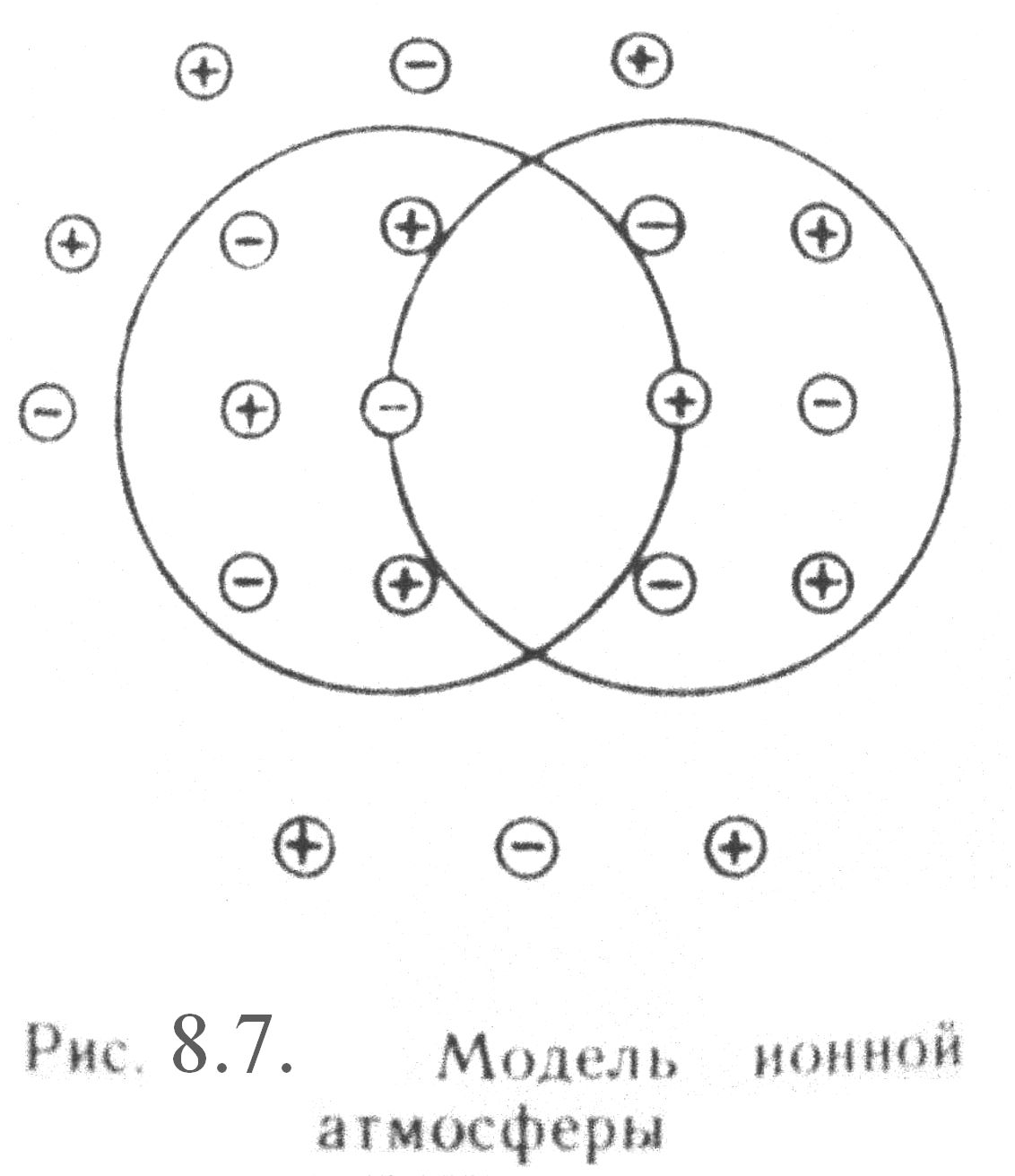
| Рис. 8.7. Модель ионной атмосферы |
Благодаря притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы», в то время как ионы одноименного знака располагаются дальше (рис. 8.7). При этом ионы сольватируются (гидратируются), что также отражается на их свойствах и свойствах растворителя.
Впервые понятие «ионная атмосфера» было предложено Дебаем и Хюккелем. Ионные атмосферы обладают следующими характерными особенностями:
- в их состав входят катионы и анионы, однако преобладают ионы, противоположные по знаку заряду центрального иона;
- cуммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку;
- все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона;
- за счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т.е. ионная атмосфера носит динамический характер.
Межионные силы влияют на все свойства растворов (электрическая проводимость, tкип и tзам, давление насыщенного пара, осмотическое давление).
В отсутствие внешнего электрического поля ионная атмосфера симметрична и силы, действующие на центральный ион, взаимно уравновешиваются. Если же приложить к раствору постоянное электрическое поле, то разноименно заряженные ионы будут перемещаться в противоположных направлениях. При этом каждый ион стремится двигаться в одну сторону, а окружающая его ионная атмосфера – в противоположную.Вследствие этого направленное перемещение иона замедляется, следовательно,уменьшается число ионов, проходящих через раствор в единицу времени, т.е. уменьшается сила тока. Чем больше концентрация раствора, тем сильнее проявляется тормозящее действие ионной атмосферы на электрическую проводимость раствора.
Следовательно,в результате межионных взаимодействий все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита.
Для оценки состояния ионов в растворе пользуются величиной, называемой активностью.
Под активностьюиона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях.
Активность иона a равна его истинной концентрации С, умноженной на коэффициент активности иона f:
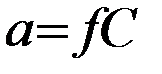 .
.
Коэффициент активности иона f– безразмерная величина, характеризующая степень отклонения свойств данного раствора от свойств идеального раствора: 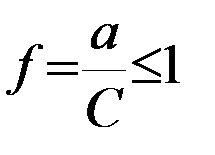 .
.
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от заряда и природы иона, от концентрации раствора, от температуры.
В разбавленных растворах (С ≤ 0,5 моль/л) природа иона слабо сказывается на значении его коэффициента активности f. Приближенно можно считать, что в разбавленных растворах коэффициент активности иона f в данном растворителе практически не зависит от природы иона, зависит только от заряда иона и ионной силы раствора I, которая равна полусумме произведений концентрации С каждого иона на квадрат его заряда z:
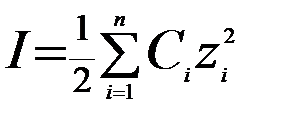 .
.
В химических справочниках значения f ионов в разбавленных растворах приводятся в зависимости от их зарядов z и ионной силы раствора I. Приближенно коэффициент активности иона в разбавленном растворе можно вычислить по формуле
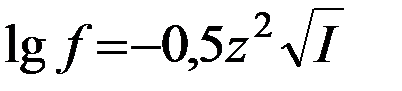 .
.
Активность и коэффициент активности можно определить на основании экспериментальных данных (по повышению tкип, понижению tзам, по давлению насыщенного пара над растворами и т.д.).
Подстановка величины активности (а) вместо концентрации (С) в уравнение закона действующих масс делает его справедливым при любых концентрациях.
Так, для обратимого процесса КА D К+ + А–,
отражающего диссоциацию слабого электролита в растворе, константа равновесия будет равна
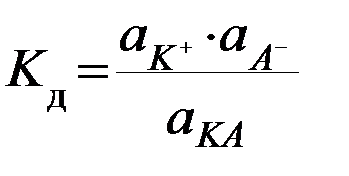 (термодинамическая константа диссоциации).
(термодинамическая константа диссоциации).
Для предельно разбавленных (близких к идеальным)растворов, где отсутствуют силы взаимодействия ионов между собой из-за их отдаленности друг от друга, f=1, т.е. a=С. При обсуждении последующего материала примем, что концентрации разбавленных растворов электролитов существенно не отличаются от их активностей.
Дата: 2019-02-19, просмотров: 380.