Главная причина диссоциации–поляризационное взаимодействие полярных молекул растворителя с молекулами растворенного вещества. Например, молекула воды – полярна, ее дипольный момент μ=1,84 D, т.е. она обладает сильным поляризующим действием. В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны два случая:
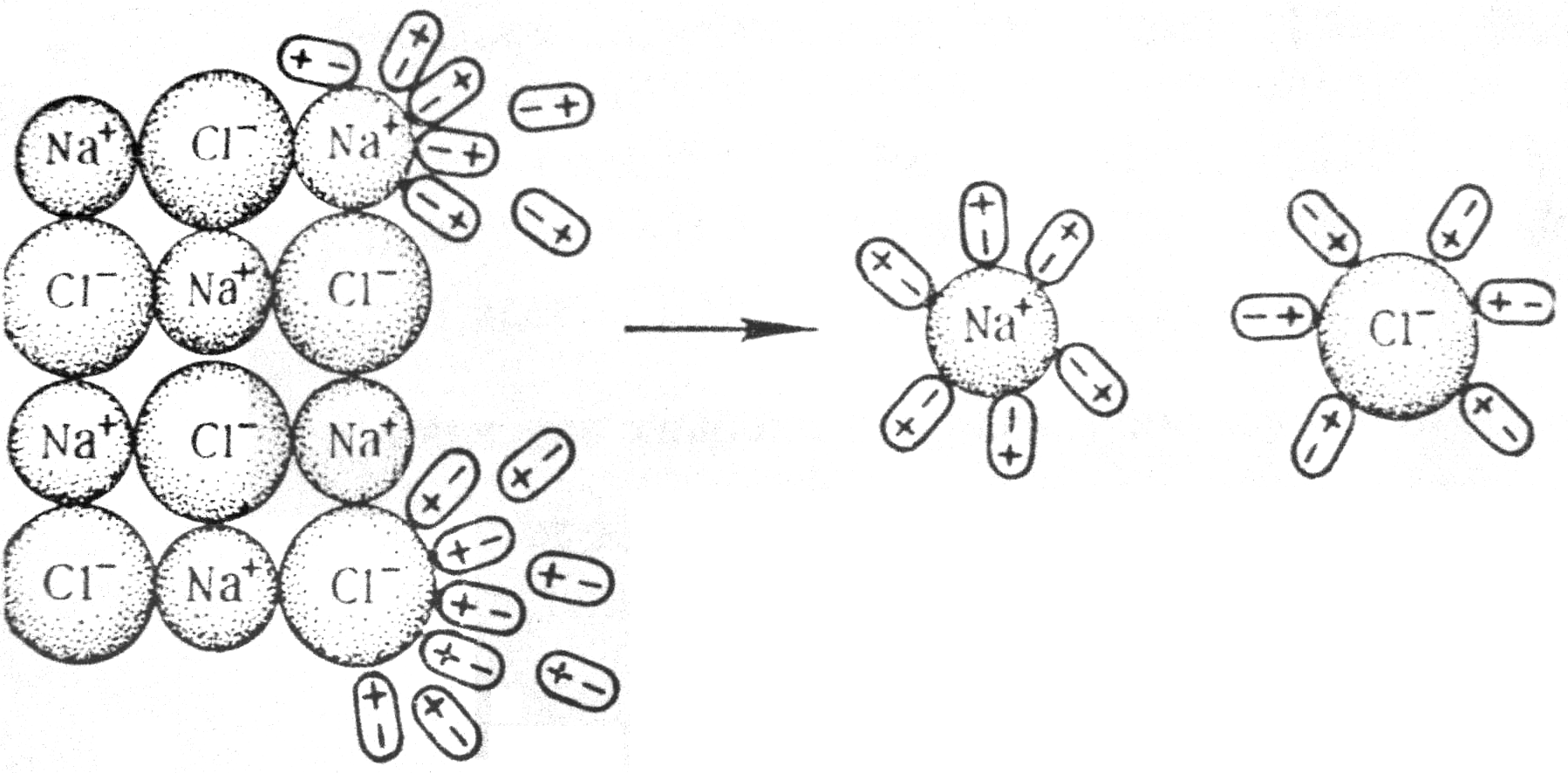
| Рис.8.6. Схема электролитической диссоциации хлорида натрия в водном растворе |
2. Растворенное вещество с полярной ковалентной связью (например, молекулы НCl, H2SO4, H2S и др.). Здесь также вокруг каждой полярной молекулы вещества ориентируются соответствующим образом диполи воды с образованием гидратов (рис.8.5). В результате такого диполь-дипольного взаимодействия связующее электронное облако (электронная пара) практически полностью сместится к атому с большей электроотрицательностью, при этом полярная молекула превращается в ионную (стадия ионизации молекулы) и затем распадается на ионы, которые переходят в раствор в гидратированном виде. Диссоциация может быть полной или частичной – все зависит от степени полярности связей в молекуле.
Различие между рассмотренными случаями заключается в том, что в случае ионной связи ионы существовали в кристалле, а в случае полярной – они образуются в процессе растворения. Соединения, содержащие одновременно и ионные, и полярные связи, сначала диссоциируют по ионным, а затем по ковалентным полярным связям. Например, гидросульфат натрия NаНSО4 полностью диссоциирует по связи Na-O, частично–по связи H-O и практически не диссоциирует по малополярным связям серы с кислородом.
Таким образом, при растворении диссоциируют только соединения с ионной и ковалентной полярной связью и только в полярных растворителях.
Степень диссоциации. Сильные и слабые электролиты
Количественной характеристикой электролитической диссоциации является степень диссоциации электролита в растворе. Эта характеристика была введена Аррениусом.
Степеньдиссоциации,a– это отношение числа молекул N, распавшихся на ионы, к общему числу молекул растворенного электролита N0:

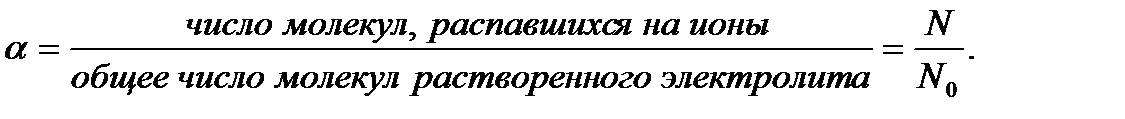
α выражают в долях единицы или в %.
По степени диссоциации электролиты делят на сильные или слабые.
При растворении в воде сильные электролиты диссоциируют практически полностью, процесс диссоциации в них необратим. У сильных электролитов степень диссоциации в растворах равна единице (α=1) и почти не зависит от концентрации раствора.
В уравнениях диссоциации сильных электролитов ставят знак«=».
Так, уравнение диссоциации сильного электролита сульфата натрия имеет вид
Nа2SО4 = 2Nа+ + SО42-.
К сильным электролитам в водных растворах относят:
- почти все соли;
- основания щелочных и щелочноземельных металлов;
- сильные кислоты: H2SO4, HNO3, HCl, HBr, HI, HСlO4, HClO3, HBrO4, HBrO3, HIO3, H2SeO4, HMnO4, H2MnO4, HCNS,H2CrO4, H2Cr2O7и т.д.
К слабым электролитам относятся электролиты, степень диссоциации которых в растворах меньше единицы (α<1) и она уменьшается с ростом концентрации.
Процесс диссоциации слабых электролитов протекает обратимо до установления равновесия в системе между нераспавшимися молекулами растворенного вещества и его ионами. В уравнениях диссоциации слабых электролитов ставят знак «обратимости» (D). Так, уравнение диссоциации слабого электролита гидроксида аммония имеет вид
NН4ОН D NН4+ + ОН-
К слабым электролитам в водных растворах относят:
- воду;
- почти все органические кислоты (муравьиная, уксусная, бензойная и т.д.);
- слабые неорганические кислоты (H2SO3, HNO2, H2CO3, H3AsO4, H3AsO3, H3BO3, H3PO4, H2SiO3, H2S, H2Se, H2Te, HF, HCN);
- нерастворимые основания p-, d-, f-элементов (Al(OH)3, Cu(OH)2, Fe(OH)2 и т.д.);
- гидроксид аммония;
- гидроксиды магния и бериллия;
- некоторые соли (CdI2, CdCl2, HgCl2, Hg(CN)2, Fe(CNS)3 и т.д.).
Численное значение степени электролитической диссоциации зависит от различных факторов:
1. Природа растворителя.
Это связано с величиной диэлектрической проницаемости растворителя ε. Как следует из закона Кулона, сила (f) электростатического притяжения двух разноименно заряженных частиц зависит не только от величины их зарядов (q1 и q2), расстояния между ними r, но и от природы среды, в которой взаимодействуют заряженные частицы, т.е. от ε:
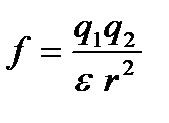 .
.
Например, при 298 К ε(Н2О) = 78,25, а ε(С6Н6) = 2,27. Такие соли, как KCl, LiCl, NaCl и др., в воде полностью диссоциированы на ионы, т.е. ведут себя как сильные электролиты; в бензоле эти соли диссоциируют лишь частично, т.е. являются слабыми электролитами. Таким образом, одни и те же вещества могут проявлять различную способность к диссоциации в зависимости от природы растворителя.
2. Температура.
У сильных электролитов с повышением температуры степень диссоциации уменьшается, у слабых – при повышении температуры до 60°С α увеличивается, а затем начинает уменьшаться.
3. Концентрация раствора.
Если рассматривать диссоциацию как равновесный химический процесс, то в соответствии с принципом Ле Шателье добавление растворителя (разбавление водой), как правило, увеличивает количество продиссоциированных молекул, что приводит к увеличению α. Процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.
4. Наличие одноименных ионов.
Добавление одноименных ионов уменьшает степень диссоциации, что также согласуется с принципом Ле Шателье. Например, в растворе слабой азотистой кислоты при электролитической диссоциации устанавливается равновесие между недиссоциированными молекулами и ионами:
НNО2D Н+ + NО2ˉ.
При введении в раствор азотистой кислоты нитрит-ионов NO2ˉ (прибавлением раствора нитрита калия КNО2) равновесие сместится влево, следовательно, степень диссоциации α уменьшится. Аналогичный эффект даст и введение в раствор ионов Н+.
Необходимо отметить, что не следует путать понятия «сильный электролит» и «хорошая растворимость». Так, растворимость СН3СООН в Н2О неограниченная, однако уксусная кислота относится к слабым электролитам ( 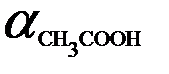 = 0,014 в 0,1 М растворе). С другой стороны, ВаSО4 –нерастворимая соль (ее растворимость при 20°С составляет < 1 мг в 100 г Н2О), но относится к сильным электролитам, так как все молекулы, перешедшие в раствор, распадаются на ионы Ва2+ и SО42-.
= 0,014 в 0,1 М растворе). С другой стороны, ВаSО4 –нерастворимая соль (ее растворимость при 20°С составляет < 1 мг в 100 г Н2О), но относится к сильным электролитам, так как все молекулы, перешедшие в раствор, распадаются на ионы Ва2+ и SО42-.
Дата: 2019-02-19, просмотров: 428.