При изучении свойств водных растворов кислот, щелочей и солей, относящихся к электролитам, было установлено, что они не подчиняются законам Рауля и Вант-Гоффа. Они имеют бо́льшие, чем вычисленные по соответствующим формулам, понижениедавления насыщенного пара растворителя над раствором (DР), повышение температуры кипения (Dtкип)и понижение температуры замерзания (Dtзам), осмотическое давление (Росм).
Чтобы распространить на растворы электролитов расчетные формулы законов Рауля и Вант-Гоффа, в них был введен поправочный коэффициент i, называемый также изотоническим коэффициентом (ввел Вант-Гофф – 1887г.). Тогда
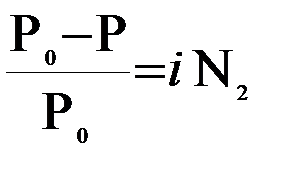 ;
;
∆tкип =i Кэб · Сm;
∆tзам =i Ккр ·Сm;
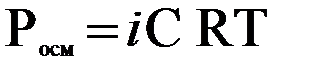 .
.
Изотонический коэффициент показывает, во сколько раз экспериментальные величины 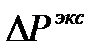 ,
, 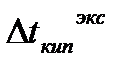 ,
, 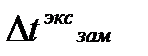 ,
, 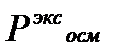 больше теоретических, т.е. вычисленных по формулам для растворов неэлектролитов:
больше теоретических, т.е. вычисленных по формулам для растворов неэлектролитов:
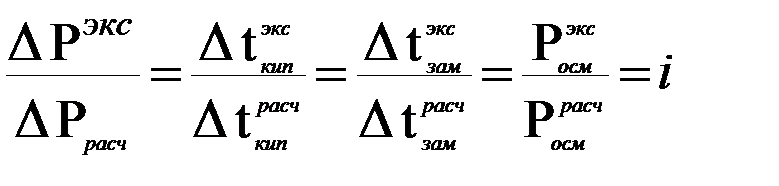 .
.
Т.е коэффициент i показывает меру отклонения свойств растворов электролитов от закономерностей для неэлектролитов;он всегда больше единицы (i>1), стремится к целому числу.
Электролитическая диссоциация
Наблюдаемые отклонения для растворов электролитов, а также их способность проводить электрический ток были объяснены на основе теории электролитической диссоциации, созданной шведским ученым Аррениусом (1883 г.).
Основные положения теории электролитической диссоциации:
1.Электролитическая диссоциация – распад молекул электролитов на ионы в среде растворителя.
2. Электролиты при растворении в воде распадаются (диссоциируют) на положительно и отрицательно заряженные ионы.
3. Под действием электрического тока положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называют катионами, вторые – анионами.
4. Сумма положительных зарядов в растворе равна сумме отрицательных зарядов, поэтому раствор в целом электронейтрален.
5. Ионы представляются как точечные заряды, взаимодействия между которыми отсутствуют (подобны идеальным газовым смесям).
6. Диссоциация – процесс обратимый, поскольку одновременнопротекаютпроцесс распада молекул на ионы (диссоциация) и процесс соединения ионов в молекулы (ассоциация). Например, уравнение диссоциации молекулы электролита КА на катион К+ и анион Аˉ записывается так:
КА DК+ +  Аˉ.
Аˉ.
Согласно теории Аррениуса, вследствие диссоциации электролитов на ионы, с одной стороны, увеличивается общее число частиц в растворе, а следовательно, возрастают понижение давления пара и изменение температуры кипения и замерзания, с другой стороны – ионы обусловливают способность раствора проводить электрический ток.
Физический смысл изотонического коэффициента iсостоит в увеличении общего числа частиц в растворе за счет диссоциации растворенного вещества на ионы.
Достоинство теории Аррениуса состоит в возможности построения на ее основе номенклатуры кислот и оснований, а также в том, что она позволяет правильно описывать многие реакции нейтрализации в водных растворах.
Однако теория Аррениуса рассматривала ионы как свободные не зависимые от молекул растворителя частицы, не учитывала всей сложности явлений в растворах. Она часто критиковалась учёными его времени. Наиболее полная и четкая формулировка основных недостатков теории Аррениуса и путей их преодоления дана в трудах Д.И.Менделеева. В работах Д.П. Коновалова, И.А. Каблукова, В.А.Кистяковскиго, Г. Льюиса, П. Дебая и Э. Хюккеля, основная причина недостатков теории состоит в том, что она не учитывает взаимодействия частиц растворенного вещества между собой, а также с молекулами растворителя.
К основным недостаткам теории Аррениуса относятся:
- рассмотрение свойств растворов электролитов связано с одним растворителем – водой, в то время как существует множество реакций, протекающих в неводных растворителях или без растворителя. Кроме того, известны многие вещества, не высвобождающие в водном растворе ионы гидроксида, но обладающие основными свойствами;
- невозможность описания свойства концентрированных растворов электролитов.
Теории Аррениуса противостояла химическая, или гидратная, теория растворов Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. В преодолении кажущегося противоречия обеих теорий большая заслуга принадлежит русскому ученому И. А. Каблукову, впервые высказавшему предположение о гидратации ионов. Развитие этой идеи привело в дальнейшем к объединению теории Аррениуса и Менделеева.
В создании современной физико-химической теории растворов большую роль сыграли работы русских ученых Д. И. Менделеева, И. А. Каблукова, Д.П. Коновалова, В. А. Кистяковского и др.
Сольватация (гидратация)
По современным представлениям причиной электролитической диссоциации является физико-химическое взаимодействие между полярными молекулами и ионами растворяемого вещества и полярными молекулами растворителя (сольватация), приводящее к образованию соединений сольватов (комплексов). В случае, если вода – растворитель, говорят о гидратации и образовании гидратов.
Взаимодействие между молекулами и ионами растворяемого вещества и молекулами воды может состоять из нескольких процессов, протекающих последовательно или одновременно: молекулярной диссоциации, образования сольватов, ионизации и электролитической диссоциации. В зависимости от типа растворяющихся веществ число стадий может изменяться. Так, в случае ионных кристаллов стадии образования гидратов и электролитическая диссоциация совмещены.
В случае ассоциированных веществ первой стадией является молекулярная диссоциация растворенного вещества. Процесс молекулярной диссоциации происходит вследствие химического взаимодействия между молекулами растворяемого вещества КА, (m+n) молекулами воды с образованием гидратированной молекулы КА(m+n)Н2О:
КА + (m+n)Н2О D КА(m+n)Н2О. (а)
Образующийся гидрат диссоциирует на гидратированные ионы (стадия электролитической диссоциации):
КА(m+n)Н2О D К+·mН2О + А–·nН2О. (б)
Схематично процесс гидратации, на примере реакций (а) и (б), представлен 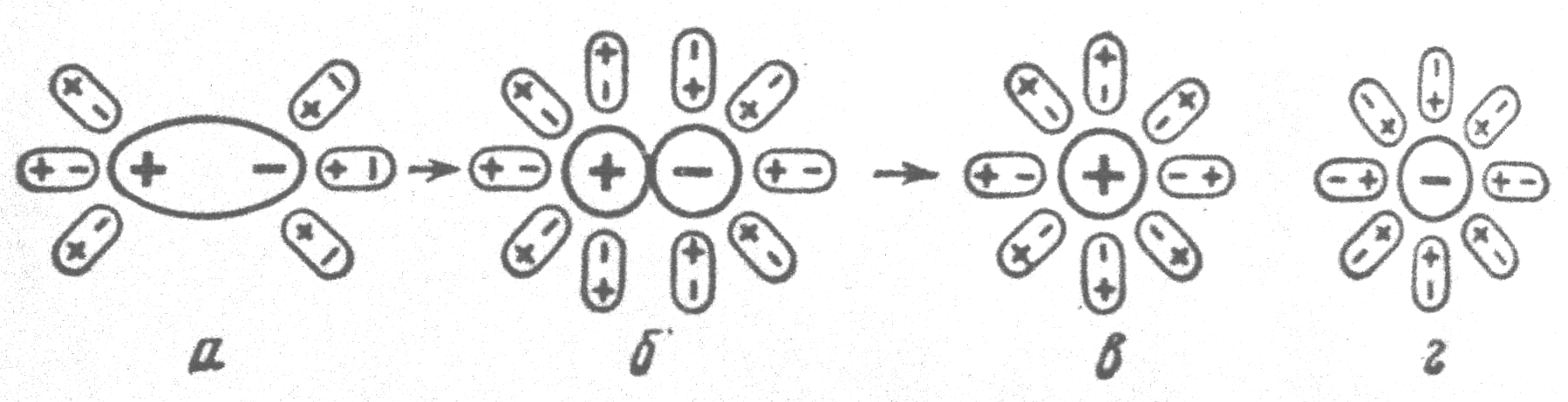
| Рис.8.5. Схема взаимодействия полярной молекулы растворяемого вещества с полярными молекулами воды(гидратация):а – полярная молекула в начале гидратации; б – переход полярной структуры в ионную под действием диполей воды; в – гидратированный катион; г – гидратированный анион |
Процесс гидратации может остановиться на любой стадии. Если процесс гидратации останавливается на стадии (а), то система представляет собой раствор неэлектролита. Она характеризуется отсутствием ионов в растворе и соответственно не обладает ионной электрической проводимостью. Если процесс гидратации протекает до стадии (б), то система является раствором электролита, т.е. имеет место электролитическая диссоциация с образованием ионов. Уравнение электролитической диссоциации можно записать, опустив промежуточные стадии, указав лишь начальные и конечные продукты реакции:
КА + (m+n)Н2О D К+·mН2О + А–·nН2О.
Особенностью гидратов (сольватов) как химических соединений является то, что коэффициенты n и m меняются с изменением концентрации, температуры и других параметров раствора. Поэтому приведенные формулы гидратов (сольватов) не отражают их истинного стехиометрического состава, и в уравнениях химических реакций гидратированные ионы обычно записывают, например, К+·aq, А–· aq.
Однако часто в подобных уравнениях опускают молекулы растворителя, записывая их в таком виде:
КА D К+ + А–.
Электролитическая диссоциация протекает самопроизвольно (∆G<0). Понижение изобарно-изотермического потенциала обусловлено образованием гидратированных (сольватированных) ионов. Энергии гидратации (сольватации) достаточно для разрушения химических связей в молекулах или ионных кристаллах.
Дата: 2019-02-19, просмотров: 570.