Гликопротеин LW [CD242, или ICAM-4 (intercellular adhesion molecules)] вместе с другими дифференцировочными антигенами – CD54 (ICAM-1), CD102 (ICAM-2), CD50 (ICAM-3) – выполняет в организме функцию рецепторов кле-точной адгезии (Wang и соавт. [66], Parsons и соавт. [43]), являясь лигандом бо-лее 20 различных типов интегринов, обеспечивающих межклеточное взаимо-действие (Hynes [25], Spring и соавт. [59]).
758
Молекулы адгезии ICAM-1, ICAM-2 и ICAM-3 присутствуют на лимфоци-тах, гранулоцитах и моноцитах, в то время как ICAM-4 (LW-антигены) свой-ственны эритроидным клеткам и тканям плаценты (Parsons и соавт. [43]).
Фиксация эритроцитов в селезенке макрофагами, распознающими адгезив-ные ICAM-4-молекулы, может служить одним из механизмов удаления из кро-вотока стареющих или, наоборот, атипично молодых форм.
Взаимодействие выделенного из эритроцитов ICAM-4-адгезиного вещества
в моноцитами, Т-, В- и NK-клетками блокировалось антителами анти-CD18; взаимодействие с Т-клетками блокировалось также анти-CD11а-антителами
(Bailly и соавт. [2]).
LW-гликопротеины эритроцитов связываются αV-интегринами эндотелиаль-ных клеток и тем самым способствуют закупорке мелких сосудов у больных c серповидно-клеточной анемией. Экспрессия LW-антигенов на эритроцитах этих больных может быть повышенной.
Антигены LW найдены в эритроцитах всех исследованных приматов: шим-панзе, горилл, орангутангов, бабуинов и многих других обезьян. Эти антиге-ны отсутствуют у мышей, крыс, кроликов, кошек, коз, овец, лошадей (Levine, Celano [33], Shaw [50]).
Список литературы
\endash \e Bailly P., Hermand P., Callebaut I. et al. The LW blood group glycoprotein is homologous to intercellular adhesion molecules // Proc. Natl. Acad. Sci. USA. – 1994. – V. 91. –
5306‒5310.
\endash \e Bailly P., Tontti E., Hermand P. et al. The red cell LW blood group protein is an intercellular adhesion molecule which binds to CD11 / CD18 leukocyte integrins // Eur. J. Immunol. – 1995. – V. 25. – P. 3316‒3320.
\endash \e Beck M.L. The LW system: a review and current concepts // AABB: A Seminar on Recent Advances in Immunohematology. – Arlington, 1973. – P. 83‒100.
\endash \e Blanchard D., Hermand P., Petit-Le Roux Y. et al. Preparation of monoclonal antibodies directed against the ICAM-4 / LW blood group protein [Abstract] // Vox Sang. – 2000. –
78 (Suppl.1). – P. 024.
и Bloy C., Blanchard D., Hermand P. et al. Properties of the blood group LW glycoprotein and preliminary comparison with Rh proteins // Mol. Immunol. – 1989. – V. 26. – P. 1013‒1019.
и Bloy C., Hermand P. Blanchard D. et al. Surface orientation and antigen properties of Rh and LW polypeptides of the human erythrocyte membrane // J. Biol. Chem. – 1990. – V. 265. – P. 21482‒21487.
и Bloy C., Hermand P., Cherif-Zahar B. et al. Comparative analysis for two-dimensional iodopeptide mapping of the RhD protein and LW glycoprotein // Blood. – 1990. – V. 75. –
2245‒2249.
и Bony V., Gane P., Bailly P., Cartron J.-P. Time-course expression of polypeptides carrying blood group antigens during human erythroid differentiation // Brit. J. Haemat. – 1999. – V. 107. –
263‒274.
и Celano M.J., Levine P. Anti-LW specificity in autoimmune acquired hemolytic anemia // Transfusion. – 1967. – V. 7. – P. 265‒268.
и Chaplin H., Hunter V.L., Rosche M.E., Shirey R.S. Long-term in vivo survival of Rh(D)-negative donor red cells in a patient with anti-LW // Transfusion. – 1985. – V. 25. – P. 39‒43.
и Chown B., Kaita H., Lowen B., Lewis M. Transient production of anti-LW by LW-positive people // Transfusion. – 1971. – V. 11. – P. 220‒222.
759
в Cummings E., Pisciotto P., Roth G. Normal survival of Rho(D) negative, LW(a + ) red cells in a patient with allo-anti-LW a // Vox Sang. – 1984. – V. 46. – P. 286‒290.
в Daniels G. Effect of enzymes and chemical modifications of high-frequency red cell antigens // Immunohematology. – 1992. – V. 11. – P. 220‒222.
в DeVeber L.L., Clark D.W., Hunking M., Stroup M. Maternal anti-LW // Transfusion. – 1971. – V. 11. – P. 33‒35.
в Devenish A. An example of anti-LW a in a 10-month-old infant // Immunohematology. – 1994. – V. 10. – P. 127‒129.
в Fisk R.T., Foord A.G. Observations on the Rh agglutinogen of human blood // Amer. J. Clin. Path. – 1942. – V. 12. – P. 545‒552.
в Gibbs M.B. The quantitative relationship of the Rh-like (LW) and D antigens of human erythrocytes // Nature. – 1966. – V. 210. – P. 642‒643.
в Giles C.M. The LW blood group: a review // Immunol. Commun. – 1980. – V. 9. – P. 225–245.
в Giles C.M., Lundsgaard A. A complex serological investigation involving LW // Vox Sang. – 1967. – V. 13. – P. 406‒413.
в Hermand P., Gane P., Lucien N. et al. Erythrocyte restricted expression of the LW blood group antigens [Abstract] // Transfus. Clin. Biol. – 1996. – V. 3. – 52S.
в Hermand P., Gane P., Mattei M.G. et al. Molecular basis and expression of the LW a / LW b blood group polymorphism // Blood. – 1995. – V. 86. – P. 1590‒1594.
в Hermand P., Huet M., Callebaut I. et al. Binding sites of leukocyte β2 integrins (LFA-1, Mac-1) on the human ICAM-4 / LW blood group proteins // J. Biol. Chem. – 2000. –
275. – P. 26002‒26010.
в Hermand P., LePennec P.Y., Rouger P. et al. Characterization of the gene encoding the human LW blood group protein in LW + and LW– phenotypes // Blood. – 1996. – V. 87. –
2962‒2967.
В Herron R., Bell A., Poole J. et al. Reduced survival of isotope-labelled Rh(D)-negative donor red cells in a patient with anti-LW ab // Vox Sang. – 1986. – V. 51. – P. 314‒317.
В Hynes R.O. Integrins: versality, modulation and signaling in cell adhesion // Cell. – 1992. –
69. – P. 11‒25.
В Komatsu F., Kajiwara M. Transient depression of LW a antigen with coincident production of anti-LW ab repeated in relapses of malignant lymphoma // Transfus. Med. – 1996. – V. 6. –
139‒143.
и Konigshaus G.J., Holland T.I. The effect of dithiothreitol on the LW antigen // Transfusion. – 1984. – V. 24. – P. 536‒537.
и Landsteiner K., Wiener A.S. An agglutinable factor in human blood recognized by immune sera for rhesus blood // Proc. Soc. Exp. Biol. NY. – 1940. – V. 43. – P. 223.
и Levine P. Rh and LW blood factors // Int. Convoc. Immunol., – Buffalo, NY, 1968. – Basel: Karger 1969. – P. 140‒143.
и Levine P., Celano M., Fenichel R. et al. ‘D-like’ antigen in rhesus monkey, human Rh-positive and human Rh negative red blood cells // J. Immunol. – 1961. – V. 87. – P. 747‒752.
и Levine P., Celano M., Fenichel R., Singher H. A ‘D-like’ antigen in rhesus red blood cells and in Rh-positive and Rh-negative red cells // Science. – 1961. – V. 133. – P. 332‒333.
и Levine P., Celano M.J. Agglutinating specificity of LW factor in guinea pig and rabbit anti-Rh serums // Science. – 1967. – V. 156. – P. 1744‒1746.
и Levine P., Celano M.J. Presence of ‘D-like’ antigens on various monkey red blood cells // Nature. – 1962. – V. 193. – P. 184‒185.
и Levine P., Celano M.J., Vos G.H., Morrison J. The first human blood, – – –/– – –, which lacks the ‘D-like’ antigen // Nature. – 1962. – V. 194. – P. 304‒305.
и Levine P., Celano M.J., Wallace J., Sanger R. A human ‘D-like’ antibody // Nature. – 1963. –V. 198. –P. 596‒597.
760
CCCC Levine P., Stetson R.E. An unusual case of intragroup agglutination // J. AMA. – 1939. –
113. – P. 126‒127.
DDDD Lomas C.G., Tippett P. Use of enzymes in distinguishing anti-LW a and anti-LW ab from anti-D // Med. Lab. Sci. – 1985. – V. 42. – P. 88‒89.
EEEE Mallinson G., Martin P.G., Anstee D.J. et al. Identification and partial characterization of the human erythrocyte membrane component(s) that express the antigens of the LW blood-group system // Biochem J. – 1986. –V. 234. – P. 649‒652.
FFFF Moore S. Identification of red cell membrane components associated with rhesus blood group antigen expression // Red Cell Membrane Glycoconjugates and Related Genetic Markers / J.-P. Cartron, C. Rouger, C. Salmon eds. – Paris: Librarie Arnette, 1983. – P. 97‒106.
GGGG Murray J., Clark E.C. Production of anti-Rh in guinea pigs from human erythrocyte extracts
Nature. – 1952. –V. 169. –P. 886‒887.
HHHH Napier J.A.F., Rowe G.P. Transfusion significance of LW a allo-antibodies // Vox Sang. – 1987. – V. 53. – P. 228‒230.
IIII Oliveira O.L.P., Thomas D.B., Lomas C.G., Tippett P. Restricted expression of LW antigen on subsets of human B and T lymphocytes // J. Immunogenet. – 1984. – V. 11. – P. 297‒303.
JJJJ Parsons S.F., Spring F.A., Chasis J.A., Anstee D.J. Erythroid cell adhesion molecules Lutheran and LW in health and disease // Bailliere’s Best Prac. Clin. Haemat. – 1999. –
12. – P. 729‒745.
KKKK Perkins H.A., McIllroy M., Swanson J. et al. Transient LW-negative red blood cells and anti-LW in a patient with Hodgkin disease // Vox Sang. – 1977. – V. 33. – P. 299–303.
LLLL Perrault R. ‘Cold’ IgG autologous anti-LW: an immunological comparison with immune anti-LW // Vox Sang. – 1973. – V. 24. – P. 150‒164.
MMMM Polesky H.F., Swanson J., Olson G. Guinea pig antibodies to ? Rh-Hr precursor // Proc. 11-th Cong. Int. Soc. Blood Transfus. – 1966 / Bibl. Haemat. – 1968. – V. 29(1). – P. 384‒387.
NNNN Poole J., Ford D., Tozer R. et al. A case of LW(a −b −) in Papua New Guinea [Abstract] // 24-th Cong. Int. Soc. Blood Transfus. – 1996. – P. 144.
OOOO Race R.R., Sanger R. Blood Groups in Man. – 6-th ed. – Oxford: BSP, 1975. – 659 p.
PPPP Reid M.E., O’Day T.M., Toy P.T.C.Y., Carlson T. Anti-LW in a transient LW(a −b −) individual: serologic characteristics and clinical significance // J. Med. Technol. – 1996. –
3. – P. 117–119.
QQQQ Shaw M.A. Monoclonal anti LW ab and anti-D reagents recognize a number of different epitopes: use of red cells of non-human primates // J. Immunogenet. – 1986. – V. 13. –
377–386.
18. Sistonen P. A phenotypic association between the blood group antigen Ne a and Rh antigen D // Med. Biol. – 1981. – V. 59. – P. 230–233.
19. Sistonen P., Green C.A., Lomas C.G., Tippett P. Genetic polymorphism of the LW blood group system // Ann. Hum. Genet. – 1983. – V. 47. – P. 277–284.
20. Sistonen P., Nevanlinna H.R., Virtaranta-Knowles K. et al. Ne a, a new blood group antigen in Finland // Vox Sang. – 1981. – V. 40. – P. 352–357.
21. Sistonen P., Tippett P. A ‘new’ allele giving further insight into the LW blood group system
Vox Sang. – 1982. – V. 42. – P. 252–255.
22. Sistonen P., Virtaranta-Knowles K., Denisova R. et al. The LW b blood group as a marker of prehistoric Baltic migrations and admixture // Hum. Hered. – 1999. – V. 49. – P. 154–158.
23. Sonneborn H.-H., Ernst M., Voak D. A new monoclonal anti-LW (BS 87) [Abstract] // Vox Sang. – 1994. – V. 67 (Suppl. 2). – P. 114.
24. Sonneborn H.-H., Uthelmann H., Tills D. et al. Monoclonal anti-LW ab // Biotest Bull. – 1984. – V. 2. – P. 145–148.
25. Southcott M.J.G., Tanner M.J.A., Anstee D.J. The expression of human blood group antigens during erythropoiesis in a cell culture system // Blood. –1999. – V. 93. – P. 4425–4435.
761
39. Spring F.A., Parsons S.F., Ortlepp S. et al. Intercellular adhesion molecule-4 binds α4β1 and αv-family integrins through novel integrin-binding mechanisms // Blood. – 2001. – V. 98. –
458–466.
40. Swanson J., Matson G.A. Third example of a human ‘D-like’ antibody or anti-LW // Transfusion. – 1964. – V. 4. – P. 257–261.
41. Swanson J., Polesky H.F., Matson G.A. The LW antigen of adult and infant erythrocytes // Vox Sang. – 1965. – V. 10. – P. 560–566.
42. Swanson J., Scofield T., Krivit W. et al. Donor-derived LW, Rh and M antibodies in post BMT chimera [Abstract] // Joint. Congr. Int. Soc. Blood Transfus and AABB, 1990. – P. 34.
43. Swanson J.L., Azar M., Miller J., McCullough J.J. Evidence for heterogeneity of LW antigen revealed in a family study // Transfusion. – 1974. – V. 14. – P. 470–474.
44. Villalba R., Ceballos P., Fornes G. et al, Clinically significant anti-LW ab by monocyte assay // Vox Sang. – 1995. – V. 68. – P. 66–67.
45. Vos G.H., Petz L.D., Garratty G., Fudenberg H.H. Autoantibodies in acquired hemolytic anemia with special reference to the LW system // Blood. – 1973. – V. 42. – P. 445–453.
46. Wang J., Springer T.A. Structural specializations of immunoglobulin superfamily members for adhesoin to integrins and viruses // Immunol. Rev. – 1998. – V. 163. – P. 195–215.
47. White J.C., Rolih S., Wilkinson S.L. et al. A new example of anti-LW and further studies on heterogeneity of the system // Transfusion. – 1975. – V. 15. – P. 368–372.
48. Wiener A.S., Moor-Jankowski J., Brancato G.J. LW factor // Haematologia. – 1969. –
3. – P. 385–393.
с Wiener A.S., Socha W.W., Gordon E.B. Fractionation of human anti-Rho sera by absorption with red cells of apes // Haematologia. – 1971. – V. 5. – P. 227–240.
762
Глава 19.
Система Chido / Rodgers
Антигены Chido / Rodgers (Чидо / Роджерс), подобно антигенам Lewis, не яв-ляются эритроцитарными, а адсорбируются на эритроциты из плазмы. Они, так же как и антигены Lewis, обнаружены с помощью реакции агглютинации эри-троцитов, и лишь позднее было установлено, что эти антигены присущи не эри-троцитам, а C4d-компоненту комплемента. Некоторое количество комплемента всегда присутствует на мембране эритроцитов, и соответствующие антикомпле-ментарные антитела могут вызвать их агглютинацию.
Несмотря на то что антигены Chido и Rodgers являются гуморальной суб-станцией, систему Chido / Rodgers классифицируют не с сывороточными, а с эритроцитарными антигенными системами. Ей присвоен номер ISBT 017.
с систему Chido / Rodgers входят шесть антигенов Chido (Ch1–Ch6), два ан-тигена Rodgers (Rg1 и Rg2) и гибридный антиген WH, возникающий в случае сочетания антигенов Ch6 и Rg1 (Giles и соавт. [25, 34]) (табл. 19.1).
Таблица 19.1
Номенклатура антигенов системы Chido / Rodgers
| Обозначение | Код ISBT | |||
| традиционное | ISBT | |||
| Ch1 | CH / RG1 | 017001 | ||
| Ch2 | CH / RG2 | 017002 | ||
| Ch3 | CH / RG3 | 017003 | ||
| Ch4 | CH / RG4 | 017004 | ||
| Ch5 | CH / RG5 | 017005 | ||
| Ch6 | CH / RG6 | 017006 | ||
| WH | CH / RG7 | 017007 | ||
| Rg1 | CH / RG11 | 017011 | ||
| Rg1 | CH / RG12 | 017012 | ||
К номенклатуре ISBT антигены Ch1–Ch6 получили обозначения CH / RG1– CH / RG6, детерминанта WH обозначена как CH / RG7, антигенам Rg1 и Rg2 присвоены буквенно-цифровые обозначения: CH / RG11 и CH / RG12 (см. табл. 19.1). Символы CH / RG8–CH / RG10 оставили для антигенов Ch / Rg,
которые могут быть открыты.
Частота антигена Ch1 у европеоидов составляет 96 %, у монголоидов – 100 % (табл. 19.2) (Giles [24], Middleton, Crookston [54]). Частота антигена WH более 15 %.
763
Посемейные исследования показали кодоминантный характер наследования гена Ch и его тесную взаимосвязь с локусом HLA (Awdeh и соавт. [3], Middleton
с соавт. [55]).
Таблица 19.2
Распределение фенотипов Ch / Rg с англичан и японцев*
| Фенотип | Частота (%) среди | ||
| англичан (n=309) | японцев (n=89) | ||
| Rg:1,2 | 95 | 100 | |
| Rg:1,–2 | 3 | 0 | |
| Rg:–1,–2 | 2 | 0 | |
| Ch:1,2,3 | 88 | 75 | |
| Ch:1,–2,3 | 5 | 24 | |
| Ch:1,2,–3 | 3 | 0 | |
| Ch:–1,–2,–3 | 4 | 1 | |
| Ch:–1,2,–3 | Очень редко | ||
| Ch:1,–2,–3 | Очень редко | ||
* По Giles и соавт. [37].
С4-компонент комплемента
Компонент С4 комплемента представляет собой полипептидную цепь с мол. массой 200 кДа, состоящую из трех фрагментов: α (95 кДа), β (75 кДа) и
У (30 кДа). Все три полипептида гликозилированы и связаны между собой дис-ульфиднми мостиками (рис. 19.1). Цепи α С4А и С4В имеют мол. массу 96 и 94 кДа соответственно (Lundwall и соавт. [48], Roos и соавт. [78, 79]), обладают наибольшей биологической активностью и обусловливают антигенные разли-чия С4-компонента комплемента. Они состоят из относительно большого фраг-мента C4b и короткого N-терминального фрагмента C4a. Связанный с мембра-ной полипептид C4b под влиянием фактора I комплемента преобразуется в C4d. Сходное действие в отношении C4b оказывает трипсин (Law, Reid [45]).
Rosenfield и соавт. [80], использовав метод электрофореза, установили, что компонент С4 комплемента неоднороден и состоит из отдельных фракций.
Последующие исследования с помощью иммуноэлектрофореза в геле позволи-ли O’Neill и соавт. [67], Teisberg и соавт. [89] определить, что С4-компонент компле-мента у большинства людей присутствует в виде одного из трех типов (рис. 19.2). Первый тип комплемента – С4А (acidic, кислый) – характеризуется четырьмя бы-стро мигрирующими полосами, второй – С4В (basic, щелочной) – четырьмя мед-ленно мигрирующими полосами, третий (С4АВ) имеет обе группы полос. Авторы различали также C4F (fast, быстрый) и C4S (slow, медленный) типы.
Основываясь на результатах посемейных исследований O’Neil и соавт. [67, 68] заключили, что протеины С4А и С4В являются продуктом не двух
764
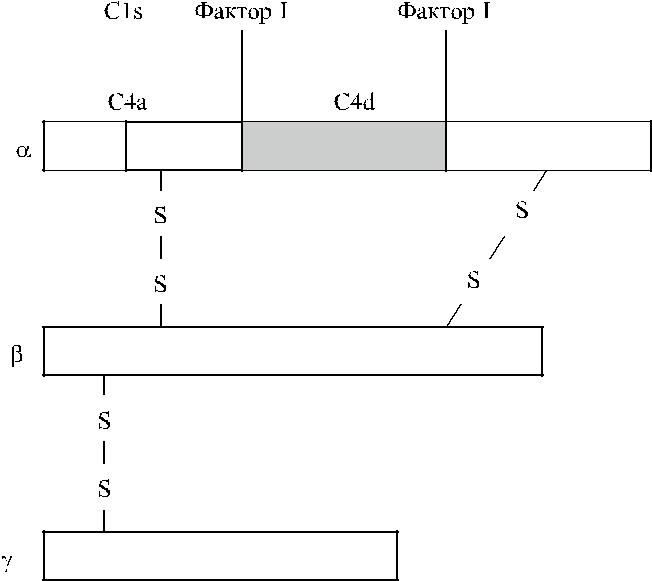
Рис. 19.1. Строение молекулы С4-компонента ком-племента. Три цепи соединены дисульфидными свя-зями. Темной штриховкой выделен участок C4d, в котором размещаются детерминанты Chido/Rodgers.
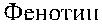
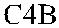
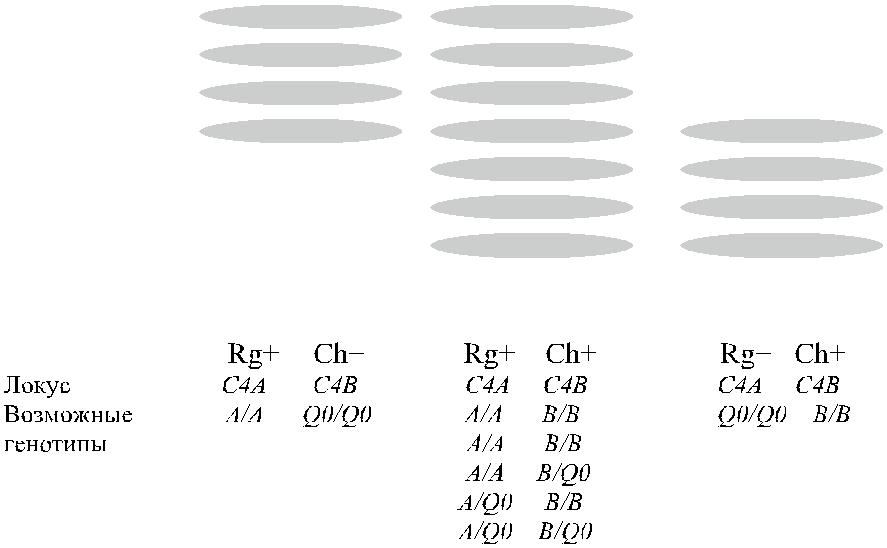
Рис. 19.2. Электрофоретические различия компонента С4 комплемента у лиц с разным фенотипом по системе Chido/Rodgers (по Law и соавт. [45], O’Neill и соавт. [68]).
кодоминантных аллелей, а двух тесно связанных между собой локусов С4А и С4В, в каждом из которых нередко встречаются молчащие аллели. Последние получили обозначения C4А*Q0 и C4B*Q0 (Q0 – аббревиатура от quantity null, ноль вещества). Небольшое число лиц с врожденным дефицитом С4 объясня-ли низкой частотой гаплотипа C4А*Q0 C4B*Q0. По этой причине гомозиготные по указанному гаплотипу С4-дефицитные индивиды встречаются крайне редко.
765
O’Neil и соавт. [67] показали, что антигены Ch и Rg связаны с С4-компонентом комплемента. Плазма лиц Ch + Rg + имела оба изотипа (С4А и С4В) компонента С4, плазма индивидов Ch + Rg− содержала С4В-изотип, а плазма лиц Ch −Rg + – изотип С4А (см. рис. 19.2). Таким образом, антигены Ch и Rg вели себя как про-изводные локусов С4В и С4А соответственно. Дефицит С4-компонента наблюда-ли только у лиц Ch −Rg − (Atkinson и соавт. [2], Crookston и соавт. [14], Giles и со-авт. [36], O’Neill и соавт. [66, 68]). Эритроциты С4-дефицитных лиц реагирова-ли с некоторыми сыворотками анти-Ch и анти-Rg, однако, как было установле-но позднее Giles и соавт. [36], положительные реакции были обусловлены присут-ствием в этих сыворотках сопутствующих анти-HLA-антител.
Как отмечалось выше, эритроциты, сенсибилизированные комплементом in vitro, приобретают фенотип донора плазмы, в которой они были инкуби-рованы. Адсорбированный на эритроцитах компонент C4d устойчив к дей-ствию трипсина: выраженность эпитопов Ch и Rg на нем сохраняется (Tilley
У соавт. [92]).
Двухлокусная генетическая модель протеина С4, предложенная O’Neil и со-авт. [66], в целом подтвердилась, хотя последующие исследования показали, что антигены Ch и Rg более полиморфны, чем это должно быть при наличии толь-ко двух локусов.
Антигены Ch и Rg
Структурный полиморфизм
Широкие исследования компонента С4, в том числе субстратов, лишенных сиаловых кислот, показали, что указанный протеин полиморфен (Awdeh и соавт. [3], Bruun-Petersen и соавт. [9], Mauff и соавт. [51], Olaisen и соавт. [69]). К на-стоящему времени известно более 50 его разновидностей, отличающихся элек-трофоретической подвижностью: 24 разновидности компонента С4А и 27 раз-новидностей компонента С4В, включая нулевые фенотипы C4A*Q0 и C4B*Q0 (Mauff и соавт. [49, 50, 52]).
Изотипы компонента С4, богатые сиаловыми кислотами и движущиеся к аноду при проведении электрофореза, обозначены С4А, изотипы, движущихся к катоду, – С4В.
Вариантам С4-компонента комплемента и образующим их генам присвоены идентификационные номера [95].
Для европеоидов характерны четыре фенотипа С4А (С4А2, С4А3, С4А4 и С4А6) и три фенотипа C4B (С4В1, С4В2 и С4В3). Наиболее частые варианты С4А3 и С4В1.
Установлено, что С4А эффективнее связывается с аминокислотными остат-ками, в то время как С4В лучше взаимодействует с гидроксильными группами (Dodds и соавт. [16]). С4В более активен по сравнению с С4А в реакции опосре-дованного антителами гемолиза эритроцитов (Awdeh и соавт. [3]).
766
Протеин С4А экспрессирует антигены Rg, протеин С4В – антигены Ch. Существуют исключения из этого правила в виде так называемой обратной ан-тигенности. Так, протеин С4А1 реагирует с анти-Ch-антителами, но не ре-агирует с антителами анти-Rg, а протеин С4В5 взаимодействует с анти-Rg-антителами и некоторыми образцами анти-Ch (Rittner [75], Roos и соавт.[78]).
Генетический полиморфизм
Гены, кодирующие антигены Ch1 и Rg1, идентифицированы Barba и соавт.
[5], Schneider и соавт. [82] посредством ПЦР.
Локус С4А имеет величину 22 кб и состоит из 41 экзона; С4В имеет протя-женность 16 или 22 кб, возникновение укороченного варианта связано с утратой интрона величиной 6,8 кб (Carroll и соавт. [10], Yu [98]).
Гены С4А и С4В весьма консервативны. При секвенировании ДНК и опре-делении аминокислотных последовательностей выявлено сходство обоих про-теинов, превышающее 99 % (Belr и соавт. [6]). Восемь аминокислотных разли-чий внутри α-цепи C4d-фрагмента определяют различия аллотипов С4А и С4В (Belr и соавт. [6, 7], Moulds [58]). Четыре аминокислотных остатка, кодируемых экзоном 26, определяют изотип внутри группы. Так, С4А имеет последователь-ность Pro-Cys-Pro-Val-Leu-Asp в позициях 1101–1106, для С4В характерна по-следовательность Leu-Ser-Pro-Val-Ile-His в тех же позициях (Yu и соавт. [101]). Аминокислотные замены в положениях 1054, 1157, 1188 и 1191, кодируемые эк-зонами 25 и 28, определяют специфичность антигенных детерминант Ch и Rg.
Изменения С4-гаплотипов могут быть обусловлены дупликацией генов С4А
в С4В. Некоторые из удвоенных генов (С4А*3А*2 и С4В*2В*1) встречаются с частотой около 1 % среди европеоидов (Bruun-Petersen и соавт. [9], Carroll и со-
авт. [11], Giles и соавт. [38], Nordhagen и соавт. [62], Raum и соавт. [73]).
Примерно половина молчащих аллелей обусловлена делецией участка ДНК протяженностью 28 кб (Schneider и соавт. [81].
Carrol и соавт. [12] предположили, что дупликация и делеции приводят к неэквивалентному кроссинговеру. Молчащий аллель С4А*Q0 может возникать в результате встраивания участка ДНК величиной 2 пн в экзоне 29. Это приво-дит к формированию стоп-кодона в следующем за ним экзоне 30 (Barba и со-авт. [4]). Локус С4В может быть полностью заменен копией С4А в случае ген-ной конверсии (Braun и соавт. [8], Palsdottir и соавт. [70]). Неэквивалентный кроссинговер с образованием гибридных генов С4А / В объясняет возникнове-ние обратной антигенности. При этом возникают протеины С4А и С4В, экс-прессирующие необычные антигенные детерминанты Ch и Rg (Giles и соавт. [28], Roos и соавт. [78]).
Молекулярно-генетический анализ 76 гаплотипов показал, что в 58 случаях при-сутствовало два С4-локуса, в 12 – один, в 6 – сразу четыре (Teisberg и соавт. [90]).
Локус С4В фланкирован геном CYP21B (ген стероидной 21-гидроксилазы), а локус С4А – псевдогеном CYP21A. Указанные генетические структуры тесно
767
связаны между собой на хромосоме 6 в регионе III большого комплекса гисто-совместимости. Некоторые гаплотипы С4А и HLA показывают высокую степень неравновесного сцепления. Так, гаплотип C4A*Q0 у европеоидов ассоциирован
в фенотипом HLA-A1,B8,DR3, у негроидов – с фенотипом HLA-В44,DR2, га-плотип C4В*Q0 чаще встречается у лиц HLA-B5,B12.
Серологический полиморфизм
помощью реакции нейтрализации специфических антител выявлено три фенотипа Rodgers: Rg +, Rg − и частично ингибирующий Rg + (Longster, Giles [47]), а также четыре фенотипа Chido: Ch +, Ch − и два частично ингибирующих
Ch + (Giles и соавт. [24], Nordhagen и соавт. [63]).
Идентифицированы две разновидности антител анти-Rodgers (анти-Rg1 и анти-Rg2) и три разновидности антител анти-Chido (анти-Ch1, анти-Ch2 и анти-Ch3), распознающих антигены, имеющие высокую частоту (Giles и соавт. [24, 22, 23]).
Плазма Rg +, полностью ингибирующая анти-Rodgers-антитела, была по-лучена от лиц с фенотипом Rg:1, 2. Плазма Rg −, не ингибирующая указанные антитела, принадлежала индивидам Rg:−1,−2. Частичную ингибицию анти-Rodgers-антител вызывала плазма лиц Rg:1, −2. Фенотип Rg: −1, 2 не найден.
Плазма, ингибирующая активность анти-Chido-антител, получена от лиц Ch:1, 2, 3, плазма, не обладающая такой способностью, – от индивидов
Ch:− 1, −2, −3. Плазма лиц Ch:1, −2, 3, Ch:1, 2, −3 и Ch:1, −2,3 вызывала частич-
ную ингибицию антител анти-Chido. Три последних фенотипа встречаются ред-
ко (Giles и соавт. [38], Skanes и соавт. [85]). Фенотипы Ch: −1, 2, 3 и Ch: −1, −2, 3
не найдены (Yu и соавт. [100]).
Молекулы С4 экспрессируют антиген Rg1 или Ch1. Оба антигена вместе на эритроцитах не присутствуют.
Частично ингибирующий фенотип Rg:1, −2 находят преимущественно у лиц, наследующих гаплотип С4А*3А*2В*Q0. Отмечена выраженная ассоциация фенотипа Ch:1, −2, 3 с гаплотипом С4В*2, фенотипа Ch:1,2, −3 с гаплотипами С4А*6В*1 и С4А*3В*1. В остальном фенотипы Ch и Rg не коррелируют с алло-
типами С4 (Giles и соавт. [28]).
Серология системы Ch / Rg еще более усложнилась после открытия Giles [27] трех новых часто встречающихся антигенов: Ch4, Ch5 и Ch6. Антитела к этим детерминантам могут быть выявлены только с использованием эритроцитов Ch: −1, −2, −3, нагруженных компонентом С4 различных аллотипов, в том числе
С обратной антигенностью Ch / Rg.
Антиген Ch4 свойствен всем С4В-аллотипам, но не встречается при наличии нулевых гаплотипов: C4B*Q0 и C4A*1B*Q0. Последний кодирует антигены Ch1 и Ch3 в отсутствие Rg1 и Rg2.
Антиген Ch5 ассоциирован с Ch2 на протеине С4В, но может присутствовать на С4А1 без Ch2.
768
Антиген Ch6 ассоциирован с Ch3 на протеине С4В, однако в отличие от Ch3 всегда присутствует у лиц Rg:1, −2.
Еще один антиген системы Ch / Rg – WH – был выявлен Giles, Jones [34] у мужчины, получавшего множественные гемотрансфузии. Сыворотка реципиен-та содержала также антитела анти-Ch1 и анти-Ch4.
Антиген WH экспрессируется в том случае, если присутствуют антигены Ch6 и Rg1 одновременно, а антиген Rg2 отсутствует (Giles, Jones [34], Moulds
и соавт. [59]).
Yu и соавт. [99, 100, 101] предложили модель, объясняющую формирование антигенных детерминант Ch / Rg (рис. 19.3). Согласно этой модели, антигены системы Ch / Rg разделяются на два типа.
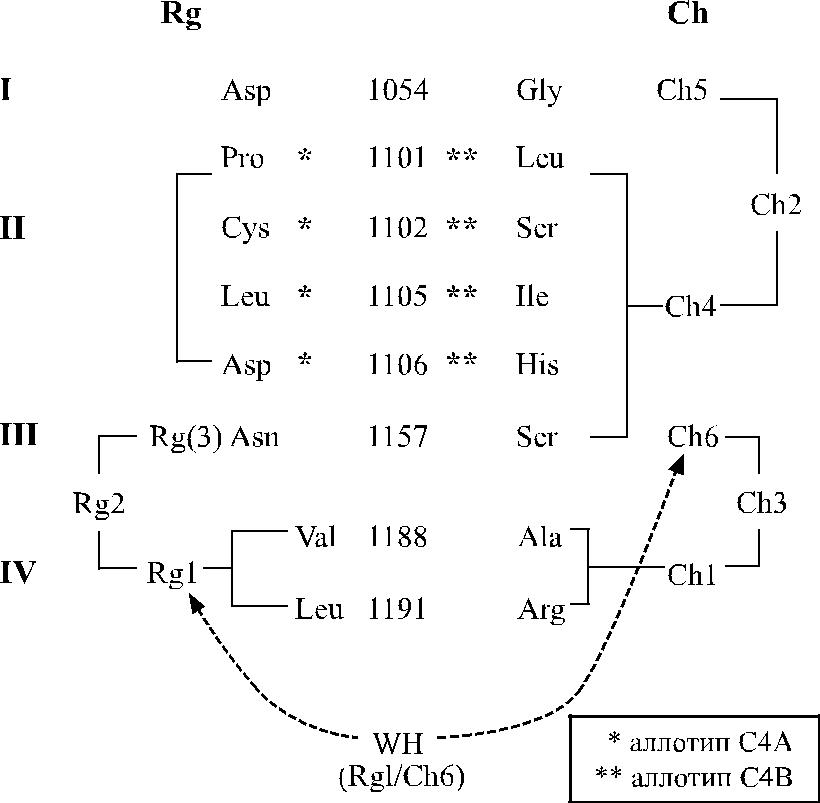
Рис. 19.3. Антигенная модель системы Chido/Rodgers (по Giles
в соавт. [39], Yu и соавт. [100].
Первый тип – мутационные антигены (антигены последовательностей), то есть антигены, специфичность которых обусловлена разной последовательно-стью (заменами) аминокислот в одних и тех же позициях протеина. К этому типу относятся антигены Ch1, Ch4, Ch5, Ch6 и Rg1.
Второй тип – конформационные антигены. Их экспрессия зависит от того или иного сочетания мутационных антигенов. К конформационным антигенам относятся Ch2, Ch3 и Rg1.
769
Молекулярная основа мутационных антигенов:
для экспрессии антигена Ch1 необходимо присутствие Ala 1188 и Arg 1191, для экспрессии антигена Ch6 необходимо присутствие Ser 1157,
эпитоп Ch4 формируется Leu 1101, Ser 1102, Ile 1105 и His 1106, эпитоп Ch5 формируется Gly 1054,
антиген Rg1 присутствует при последовательности Val 1188 и Leu 1191.
Молекулярная основа конформационных антигенов:
эпитоп Ch2 формируется при одновременном присутствии антигенов Ch4 и Ch5, для эпитопа Ch3 необходимо присутствие антигенов Ch1 и Ch6,
антиген Rg2 требует присутствия антигена Rg1 и последовательности Asn 1157.
Полагают, что должен существовать еще один мутационный антиген – Rg3, необходимый для конформационного эпитопа Rg2. Одной из его предполагае-мых характеристик должна быть последовательность Asn 1157.
Конформационным по своей природе является антиген WH. Он возникает при наличии Val 1188 и Leu 1191 (эпитопа Rg1), а также Ser 1157 (эпитопа Ch6) (Giles, Jones [34], Hellman и соавт. [41]).
Результаты исследования, проведенные Giles и соавт. [37, 39] в 325 семьях, полностью согласуются с моделью, предложенной Yu и соавт. [99, 100, 101].
Методы определения
Эритроциты, сенсибилизированные in vitro протеином С4, непосредствен-но агглютинируются антителами анти-Ch и анти-Rg. Нативные эритроциты ре-агируют с указанными антителами только в непрямой антиглобулиновой пробе (Tilley и соавт. [92]). Эта особенность связана с низким уровнем адсорбции эри-троцитами протеина С4 in vivo (Atkinson и соавт. [2]).
Сенсибилизацию эритроцитов комплементом in vitro проводят посредством их инкубации со свежей нативной сывороткой в 10 % сахарозе. При этом клетки могут быть сенсибилизированы как собственным комплементом, так и привне-сенным с плазмой другого АВО-совместимого лица (Giles [26], Tilley и соавт. [92]). Этот методический прием используют при определении группы Ch / Rg, а также при стандартизации антиглобулиновых реагентов (для выявления анти-комплементарных анти-С4-антител, которые считаются нежелательными при выполнении непрямой антиглобулиновой пробы).
Антигены Ch / Rg на нативных эритроцитах, не сенсибилизированных ком-плементом в 10 % сахарозе, разрушаются трипсином, химотрипсином, папаином, фицином и проназой (Atkins [1], Longster, Giles [47], Middleton, Crookston [54], Nordhagen и соавт. [61], Tilley и соавт. [92]). Путем подсчета молекул С4d, связан-ных с эритроцитами, было показано, что их количество уменьшается в 2 раза по-сле обработки трипсином (Giles и соавт. [29]). Антигены Ch / Rg устойчивы к дей-ствию сульфгидрила и сиалидазы, однако эритроциты, обработанные сиалидазой, утрачивают способность адсорбировать комплемент в растворе сахарозы (Wilfert и соавт. [97]). На этом основании полагают, что связывание компонента С4 с
770
эритроцитами отчасти зависит от сиаловых кислот. В эритроцитах лиц, имеющих редкие группы крови En(a −) и M k по системе MN, содержание сиаловой кислоты низкое, и антигены Ch / Rg на них также слабо выражены (Tippett и соавт. [93]).
Отмечена низкая экспрессия указанных детерминант на эритроцитах пупо-винной крови, однако сыворотки крови новорожденных ингибировали антите-ла анти-Ch и анти-Rg так же активно, как и плазма взрослых людей (Atkins [1], Middleton, Crookston [54], Nordhagen и соавт. [61].
Существуют 4 основных серологических метода для определения фенотипа Ch / Rg (Daniels [15]).
–– прямая агглютинация исследуемых эритроцитов реагентами анти-Ch и анти-Rg;
–– нейтрализация активности стандартных реагентов анти-Ch и анти-Rg плазмой обследуемого лица с последующим учетом результатов по пас-сивной агглютинации стандартных эритроцитов;
–– агглютинация эритроцитов, сенсибилизированных собственным ком-плементом;
–– агглютинация аллогенных эритроцитов, сенсибилизированных компле-ментом обследуемого индивида.
Антигены Ch1, Ch2 и Ch3 выявляют используя нативные эритроциты, без предварительной сенсибилизации комплементом (Atkins [1]).
Предложено несколько методов определения аллотипов С4: иммунофик-сация десиалилированной плазмы, электрофорез в полиакриламидном геле (SDS-PAGE), иммуноблоттинг с антителами анти-С4, анти-Ch и анти-Rg (Giles, Robson [35], Roos и соавт. [78, 79]).
Антитела анти-Ch и анти-Rg
Антитела анти-Ch обнаружили Harris, Tegoli, Swanson и соавт. в 1967 г. [40]. Все образцы сывороток анти-Ch, имевшихся в распоряжении авторов, были получены от реципиентов, которым производили гемотрансфузии. Шесть из 7 сывороток со-держали моноспецифические анти-Ch-антитела. Авторы квалифицировали их как нечеткие из-за низкой авидности положительных реакций. Выраженность антиге-на, открываемого антителами анти-Ch, сильно варьировала. В некоторых случаях слабоположительные пробы трудно было отличить от отрицательных. Пробы с ад-сорбцией антител на эритроцитах также не давали стабильных результатов.
Позднее Middleton и Crookston [54] обнаружили, что активность анти-Ch-антител ингибируется плазмой крови, полученной от лиц Ch +. Плазма лиц Ch− анти-Ch-антитела не ингибировала.
Atkins [1] отметил, что выраженной ингибирующей способностью обладает плазма лиц и со слабоэкспрессированным на эритроцитах антигеном Ch. Таким образом было показано, что реакция нейтрализации специфических анти-Ch-антител плазмой исследуемого лица более приемлема для определения антиге-нов Chido, чем прямая реакция гемагглютинации.
771
Molthan [56] и Swanson [87] установили, что эритроциты Ch − можно преоб-разовать в Ch + путем инкубации в плазме лиц Ch +, что еще раз подчеркивает происхождение этого антигена из плазмы.
В 1976 г. Longster и Giles [47] описали анти-Rg-антитела, напоминавшие анти-Ch. Они выявляли антиген, имевший частоту приблизительно 97 %, ингибирова-лись плазмой от лиц Rg +. Экспрессия антигена, подобно Ch, также варьировала в широких пределах. Около 3 % обследованных имели фенотип Ch −Rg −. Оказалось, что этот фенотип ассоциирован с наличием у таких лиц антигена HLA-B8 системы HLA (Giles и соавт. [32], James и соавт. [43]). Ген Rg наследовался кодоминантно.
Образцы плазмы лиц Rg + проявляли неодинаковую активность в реакции ингибиции специфических антител. Как было установлено Giles и соавт. [22, 23, 24], Nordhagen и соавт. [62, 63, 64], неполная ингибиция антител обусловле-на присутствием в сыворотках нескольких разновидностей антител анти-Ch и анти-Rg. Использование стандартизированных реагентов давало более удовлет-ворительные результаты (Lomas и соавт. [46], Rittner и соавт. [76]).
Особенностью антител системы Chido / Rodgers является их низкая авид-ность в реакции с нативными эритроцитами, даже если антитела имеют высо-кий титр. Эритроциты, предварительно сенсибилизированные комплементом в растворе сахарозы, приобретают способность непосредственно агглютиниро-ваться указанными антителами. Этот методический прием часто используют при фенотипировании по Chido / Rodgers и скрининге антител этой системы.
При установлении специфичности антител большое значение придают те-стам на ингибицию активности антител смесями сывороток от нескольких лиц. Для ее проведения достаточно 30-минутной экспозиции тестовой сыворотки с исследуемой смесью при комнатной температуре (Issitt, Anstee [42]). Далее ак-тивность антител исследуется повторно с эритроцитами, сенсибилизированны-ми комплементом. Исчезновение активности указывает на присутствие антиге-
нов системы Chido / Rodgers.
Практически все сыворотки анти-Rg содержат антитела анти-Rg1 и анти-Rg2. Все сыворотки анти-Ch содержат анти-Ch1-антитела, которые часто оказы-ваются моноспецифическими (Giles и соавт. [22, 23, 33]).
Частота антител в анти-Ch-сыворотках составила: анти-Ch4 – 75 %, анти-Ch2 – 25 %, анти-Ch5 – 16 %, анти Ch3 – 10 %.
Обнаружено всего по два образца сывороток с антителами анти-Ch6 и анти-WH.
Антитела анти-Ch обычно находили у лиц с нулевым фенотипом –
Ch: −1, −2, −3, −4, −5, −6. Антитела анти-Rg присутствовали у индивидов Rg: −1, −2.
Описаны анти-Ch2 + Ch5-антитела у человека, имевшего фенотип
Ch:1, −2,3,4, −5,6 (Giles и соавт. [33]). Анти-Ch2 + Ch4-антитела найдены у инди-вида Ch:1, −2, 3, −4, 5, 6 (Fisher и соавт. [21]), анти-Ch1-антитела – у лица группы Ch: −1, −2, −3, −4, 5, 6 (Poole и соавт. [71]). Комбинированные анти-Ch1 + Ch3 + Ch4-
антитела присутствовали у индивида Ch: −1, −2, −3, −4,5 (Poole и соавт. [71]).
772
с сыворотках крови лиц Ch −Rg − (С4-дефицитных) найдены антитела, ко-торые отличались от всех других антител системы Ch / Rg (Giles, Swanson [36]).
с двух сыворотках анти-Rg, содержавших антитела анти-Rg1 и анти-Rg2, были найдены сопутствующие антитела, открывающие антигенные детерми-нанты на β-цепях компонента С4 (Robson и соавт. [77]). Антитела не удалось отделить путем адсорбции от анти-Rg2, что указывает на определенную связь между антигеном Rg2 и антигенами β-цепи С4.
К настоящему времени получено большое количество мышиных монокло-нальных антител к С4-компоненту комплемента человека. Некоторые из них обладают специфичностью анти-Ch1, анти-Rg1 и анти-Ch3 (Chrispeels и соавт. [13], Giles и соавт. [30, 31]).
Клиническое значение
Антитела системы Chido / Rodgers чаще представлены иммуноглобулинами субклассов IgG2 и IgG4 (Szymanski и соавт. [88]), в связи с чем их не относят
а трансфузионно опасным. Указанные антитела ни разу не описаны в качестве причины посттрансфузионных осложнений и ГБН.
Тесты с радиоактивной меткой показали, что сроки циркуляции эритроцитов Ch +, введенных реципиентам, имеющим анти-Ch-антитела, не отличаются от контрольных (Harris и соавт. [40], Middleton [53], Moore и соавт. [57], Nordhagen, Aas [60], Silvergleid и соавт. [84], Strohm, Molthan [86], Tilley и соавт. [91]).
Антитела указанной системы описаны как причина анафилактических ре-акций, которые развились после переливания свежезамороженной плазмы
(Lambin и соавт. [44], Westhoff и соавт. [94], Wibaut и соавт. [96]).
Биологическая роль
Компонент С4, как и другие факторы комплемента, участвует в системе им-мунологического надзора, обеспечивая постоянство внутренней среды организ-ма, элиминацию стареющих и перерождающихся клеток.
Каскадная активация факторов 1–9 комплемента во взаимодействии с анти-телами приводит к разрыву мембраны клеток-мишеней и их гибели.
Связь с заболеваниями
Дефицит С4-компонента комплемента и сопровождающий его нулевой фено-тип Ch−Rg− наблюдают при системной красной волчанке (СКВ). Одной из при-чин этого заболевания является неэффективная элиминация аутоиммунных ком-плексов из-за отсутствия компонента С4 (Moulds [58], Porter [72]).
и больных СКВ наблюдалась делеция гена, контролирующего синтез С4А (Dunckley и соавт. [17], Fan и соавт. [19], Fielder и соавт. [20], O’Neill и соавт. [65], Reveille и соавт. [74]).
Симптомы СКВ существенно чаще проявлялись у лиц Rg−, гомозиготных по гаплотипу C4A*Q0, чем у индивидов Rg + (Edwards-Moulds и соавт. [18]).
773
Выявлена также корреляция между гаплотипом C4A*Q0 и другими видами аутоиммунной патологии: ревматоидным артритом, подострым склерозирую-щим панэнцефалитом, хроническим активным гепатитом и инсулин-зависимым диабетом (Schenkel-Brunner [83]).
Список литературы
В Atkins C.J. Chido and Rodgers: a serological study of their variations on the red cells and plasma // MSc thesis. – Brunel University, 1985.
В Atkinson J.P., Chan A.C., Karp D.R. et al. Origin of the fourth component of complement related Chido and Rodgers blood group antigens // Complement. – 1988. – V. 5. – P. 65–76.
В Awdeh Z.I., Alper C.A. Inherited structural polymorphism of the fourth component of human complement // Proc. Natl. Acad. Sci. USA. – 1980. – V. 77. – P. 3576–3580.
В Barba G., Rittner C., Schneider P.M. Genetic basis of human complement C4A deficiency: detection of a point mutation leading to nonexpression // J. Clin. Invest. – 1993. – V. 91. –
1681–1686.
В Barba G.M.R., Braun-Heimer L., Rittner C., Schneider P.M. A new PCR-based typing of the Rodgers and Chido antigenic determinants of the fourth component of human complement // Eur. J. Immunogenet. – 1994. – V. 21. – P. 325–339.
В Belr K.T., Carroll M.C., Porter R.R. The structural basis of the multiple forms of human complement component C4 // Cell. – 1984. – V. 36. – P. 907–914.
В Belr K.T., Yu C.Y., Carroll M.C., Porter R.R. Polymorphism of human component complement C4 // Immunogenetics. – 1985. – V. 21. – P. 173–180.
В Braun L., Schneider P.M., Giles C.M. et al. Null alleles of human complement C4: evidence for pseudogenes at the C4A locus and for gene conversion at the C4B locus // J. Exp. Med. – 1990. – V. 171. – P. 129–140.
В Bruun-Petersen G., Lamm L.U., Jakobsen B.K., Kristensen T. Genetics of complement C4: two homoduplication haplotype C4S C4S and C4F C4F in a family // Hum. Genet. – 1982. – V. 61. – P. 36–38.
В Carroll M.C., Alper C.A. Polymorphism and molecular genetics of human C4 // Brit. Med. Bull. – 1987. – V. 43. – P. 50–65.
В Carroll M.C., Belt T., Palsdottir A., Porter R.R. Structure and organization of C4 genes // Phil. Trans. R. Soc. London B. – 1984. – V. 306. – P. 379 –388.
В Carroll M.C., Palsdottir A., Belt K.T., Porter R.R. Deletion of complement C4 and steroid 21-hydroxylase genes in the HLA class III region // EMBO J. – 1985. – V. 4. – P. 2547–2552.
В Chrispeels J., Grabbe J., Stradmann B. et al. Rapid purification of the fourth component of human complement and production of C4-specific monoclonal antibodies including isotype-specific ones [Abstract] // Complement. – 1987. – V. 4. – P. 142.
В Crookston M.C., Tilley C.A. Antigens acquired from plasma by red blood cells and lymphocytes: ABH, Lewis, and C4 (Chido and Rodgers) // Blood Groups and Other Red Cell Surface Markers in Health and Disease / C. Salmon, ed. – N.Y: Masson, 1982. –
111–123.
В Daniels G.L. Human Blood Groups. – 2-nd ed. – Oxford: Blackwell Science, 2002. – 560 p.
В Dodds A.W., Law S.-K.A. Porter R.R. The purification and properties of some less common allotypes of the fourth component of human complement // Immunogenetics. – 1986. – V. 24. –
279–285.
В Dunckley H., Gatenby P.A., Hawkins B. et al. Deficiency of CA is a genetic determinant of systemic lupus erythematosus // J. Immunogenet. – 1987. – V. 14. – P. 209–218.
В Edwards-Moulds J., Arnett F.C., Moulds J.J. Increased incidence of Rodgers negative individuals observed in systemic lupus erythematosus patients [Abstract] // Transfusion. – 1989. – V. 29. – 16S.
774
и Fan Q., Uring-Lambert B., Weill B. et al. Complement component C4 deficiencies and gene alterations in patient with systemic lupus erythematosus // Eur. J. Immunogenet. – 1993. – V. 20. – P. 11–21.
и FielderA.H.L., Walport M.J., Batchelor J.R. et al. Family study of the major histocompatibility complex in patients with systemic lupus erythematosus: importance of null alleles of C4A and C4B in determining disease susceptibility // Brit. Med. J. – 1983. – V. 286. – P. 425–428.
и Fisher B., Laycock C., Poole J., Powell H. A new allo anti-Ch specificity in a patient with a rare Ch positive phenotype [Abstract] // Transfus. Med. – 1993. – V. 3 (Suppl.). – P. 84.
и Giles C.M. «Partial inhibition» of anti-Rg and anti-Ch reagents. I. Assessment for Rg / Ch typing by inhibition // Vox Sang. – 1985. – V. 48. – P. 160–166.
и Giles C.M. «Partial inhibition» of anti-Rg and anti-Ch reagents. II. Demonstration of separable antibodies for different determinants // Vox Sang. – 1985. – V. 48. – P. 167–173.
и Giles C.M. A new genetic variant for Chido // Vox Sang. – 1984. – V. 46. – P. 149–156.
и Giles C.M. Antigenic determinants of human C4, Rodgers and Chido // Exp. Clin. Immunogenet. – 1988. – V. 5. – P. 99–114.
и Giles C.M. Antigens in plasma // AABB: A Seminar on Antigens on Blood Cells and Body Fluids. – Arlington, 1980. – P. 33–49.
и Giles C.M. Three Chido determinants detected on the B5Rg + allotype of human C4: their expression in Ch-typed donors and families // Hum. Immunol. – 1987. – V. 18. – P. 111–122.
и Giles C.M., Batchelor J.R., Dodi I.A. et al. C4 and HLA haplotypes associated with partial inhibition of anti-Rg and anti-Ch // J. Immunogenet. – 1984. – V. 11. – P. 305–317.
и Giles C.M., Davies K.A., Walport M.J. In vivo and in vitro binding of C4 molecules and agglutination // Transfusion. – 1991. – V. 31. – P. 222–228.
и Giles C.M., Fielder A.H.L., Lord D.K. et al. Two monoclonal anti-C4d reagents reacts with epitopes closely related to Rg:1 and Ch:1 // Immunogenetics. – 1987. – V. 26. – P. 309–312.
и Giles C.M., Ford D.S. A monoclonal anti-C4d that demonstrates a specificity related to anti-Ch // Transfusion. – 1986. – V. 26. – P. 370–374.
и Giles C.M., Gedde-Dahl T., Robson E.B. et al. Rg a (Rodgers) and HLA region: linkage and associations // Tissue Antigens. – 1976. – V. 8. – P. 143–149.
и Giles C.M., Hoffman M., Moulds M. et al. Allo-anti-Chido in a Ch-positive patient // Vox Sang. – 1987. – V. 52. – P. 129–133.
и Giles C.M., Jones J.W. A new antigenic determinant for C4 of relatively low frequency // Immunogenetics. – 1987. – V. 26. – P. 392–394.
и Giles C.M., Robson T. Immunoblotting humanC4 bound to human erythrocytes in vivo and in vitro // Clin. Exp. Immunol. – 1991. – V. 84. – P. 263–269.
и Giles C.M., Swanson J.L. Anti-C4 in the serum of transfused C4-deficient patient with systemic lupus erythematosus // Vox Sang. – 1984. – V. 46. – P. 291–299.
и Giles C.M., Tokunaga K., Zhang W.J. et al. The antigenic determinants Rg / Ch / H, expressed by Japanese C4 allotypes // J. Immunogenetics. – 1988. – V. 15. – P. 267–275.
и Giles C.M., Uring-Lambert B., Boksch W. et al. The study of a French family with two duplicated C4A haplotypes // Hum. Genet. – 1987. – V. 77. – P. 359–365.
и Giles C.M., Uring-Lambert B., Goetz J. et al. Antigenic determinants expressed by human C4 allotypes: a study of 325 families provides evidence for structural antigenic model // Immunogenetics. – 1988. – V. 27. – P. 442–448.
и Harris J.P., Tegoli j., Swanson J. et al. A nebulous antibody responsible for cross-matching difficulties (Chido) // Vox Sang. – 1967. – V. 12. – P. 140–142.
и Hellman U., Eggersten G., Lundwall A. et al. Primary sequence differences between Chido and Rodgers variants of tryptic C4d on the human complement system // FEBS. Lett. – 1984. – V. 170. – P. 254–258.
и Issitt P.D., Anstee D.J. Applied Blood Group Serology. – 4-th ed. – Durham, NC, USA: Montgomery Sc. Publ., 1998. – 1208 p.
775
У James J., Stiles P., Boyce F., Wright J. The HL-A type of Rg(a −) individuals // Vox Sang. – 1976. – V. 30. – P. 214–216.
У Lambin P., LePennec P.Y., Hauptmann G. et al. Adverse transfusion reactions associated with a precipitating anti-C4 antibody of anti-Rodgers specificity // Vox Sang. – 1984. –
47. – P. 242–249.
У Law S.K.A., Reid K.B.M. Complement. – 2-nd ed. – Oxford: IRL Press, 1995.
У Lomas C.G., Green C.A., Akins C., Daniels G.L., Tippett P. A simple method for Ch and Rg testing // Med. Lab. Sci. – 1983. – V. 40. – P. 65–66.
У Longster G., Giles C.M. A new antibody specificity, anti-Rg a, reacting with a red cell and serum antigen // Vox Sang. – 1976. – V. 30. – P. 175–180.
У Lundwall A., Hellman U., Eggersten G., Sjoquist J. Isolation of tryptic fragments of human C4 expressing Chido and Rodgers antigens // Mol. Immunol. – 1982. – V. 19. – P. 1655– 1665.
У Mauff G., Alper C.A., Awdeh Z. et al. Statement on the nomenclature of human C4 allotypes
Immunology. – 1983. – V. 164. – P. 184–191.
У Mauff G., Alper C.A., Dawkins R. et al. C4 nomenclature statement (1990) // Complement Inflamm. – 1990. – V. 7. – P. 261–268.
У Mauff G., Bender K., Giles C.M. et al. Human C4 polymorphism: pedigree analysis of qualitative, quantitative, and functional parameters as a basis for phenotype interpretations
Hum. Genet. – 1984. – V. 65. – P. 362–372.
У Mauff G., Luther B., Schneider P.M. et al. Reference report for complement component C4
Exp. Clin. Immunogenet. – 1998. – V. 15. – P. 249–260.
У Middleton J. Anti-Chido: a crossmatching problem // Can. J. Med. Technol. – 1972. – V. 34. –
41–62.
и Middleton J., Crookston M.C. Chido-substance in plasma // Vox Sang. – 1972. – V. 23. –
256–261.
и Middleton J., Crookston M.C., Falk J.A. et al. Linkage of Chido, HL-A // Tissue Antigens. – 1974. – V. 4. – P. 366–373.
и Molthan L. The Chido antigen: some developments [Abstract] //Joint. Mtg. Am. Assoc. Blood Banks and Int. Soc. Haematol. – 1972. – P. 57.
и Moore H.C., Issitt P.D., Pavone B.G. Successful transfusion of Chido-positive blood to two patients with anti-Chido // Transfusion. – 1975. – V. 15. – P. 266–269.
и Moulds J.M. Association of blood group antigens with immunologically important proteins
Immunobiology of Transfusion Medicine / G. Garratty, ed. – N.Y.: Dekker, 1994. –
273–297.
и Moulds J.M., Roberts S.L., Wells T.D. DNA sequence analysis of the C4 antigen WH: evidence for two mechanisms of expression // Immunogenetics. – 1996. – V. 44. – P. 104– 107.
и Nordhagen R., Aas M. Survival studies of 51Cr Ch(a + ) red blood cells in a patient with anti-Ch a, and massive transfusion of incompatible blood // Vox Sang. – 1979. – V. 37. –
242–249.
и Nordhagen R., Heier Larsen A.M., Beckers D. Chido , Rodgers and C4: in vivo and in vitro coating of red blood cells, grouping and antibody detection // Vox Sang. – 1979. –
37. – P. 170–178.
В Nordhagen R., Olaisen B., Teisberg P. et al. C4 haplotype products and partial inhibition of anti-Rodgers sera // J. Immunogenet. – 1981. – V. 8. – P. 485–491.
В Nordhagen R., Olaisen B., Teisberg P., Gedde-Dahl T. Association between the electrophoretically-determined C4M haplotype product and partial inhibition of anti-Ch a //
Immunogenet. – 1980. – V. 7. – P. 301–306.
776
с Nordhagen R., Olaisen B., Teisberg P., Gedde-Dahl T. Heterogeneity of the Chido and Rodgers antigens // Proc. 9 Int. Tagung. Gesellschaffr. Forens. Blutgruppenkunde, 1981. –
507–517.
с O’Neill G.J., Berger R., Ballow M. et al. Chido, Rodgers and C4 deficiency // Transplant. Proc. – 1979. – V. 11. – P. 1941–1943.
с O’Neill G.J. The genetic control of Chido and Rodgers blood groups substances // Semin. Hematol. – 1981. – V. 18. – P. 32–38.
с O’Neill G.J., Yang S.Y., Dupont B. Two HLA-linked loci controlling the fourth component of complement // Proc. Natl. Acad. Sci. USA. – 1978. – V. 75. – P. 5165–5169.
с O’Neill G.J., Yang S.Y., Tegoli J., Berger R., Dupont B. Chido and Rodgers blood groups are distinct antigenic components of human complement C4 // Nature. – 1978. – V. 273. –
668–670.
с Olaisen B., Teisberg P., Gedde-Dahl T. The C4 system: formal and popular genetics // Hum. Genet. – 1979. – V. 50. – P. 187–192.
с Palsdottir A., Arnason A., Fossdal R., Jensson O. Gene organization of haplotypes expressing two different C4A allotypes // Hum. Genet. – 1987. – V. 76. – P. 220–224.
с Poole J., Moulds J.M., Fisher B. et al. Two Ch + individuals with allo anti-Ch [Abstract] // Transfusion. – 1996. – V. 36. – 55S.
с Porter R.R. Complement polymorphism, the major histocompatibility complex and associated diseases: a speculation // Mol. Biol. Med. – 1983. – V. 1. – P. 161–168.
с Raum D., Awdeh Z., Andersen J. et al. Human C4 haplotypes with duplicated C4A of C4B
Amer. J. Hum. Genet. – 1984. – V. 36. – P. 72–79.
с Reveille J.D., Arnett F.C., Wilson R.W. et al. Null alleles of the fourth component of complement and HLA haplotypes in familial systemic lupus erythematosus in three ethnic groups // J. Immunogenet. – 1985. – V. 21. – P. 299–311.
с Rittner C., Gils C.M., Roos M.H. et al. Genetics of human C4 polymorphism: detection and segregation of rare and duplicated haplotypes // Immunogenetics. – 1984. – V. 19. –
321–333.
с Rittner Ch., Tippett P., Giles C.M. et al. An international reference typing for Ch and Rg determinants on rare human C4 allotypes // Vox Sang. – 1984. – V. 46. – P. 224–234.
с Robson T., Heard R.N.S., Giles C.M. An epitope on C4β light (L) chains detected by human anti-Rg; its relationship with β chain polymorphism and MHC associations // Immunogenetics. – 1989. – V. 30. – P. 344–349.
с Roos M.H., Giles C.M. Demant P. et al. Rodgers (Rg) and Chido (Ch) determinants of human C4: characterization of two C4 B5 subtypes, one of which contains Rg and Ch determinants // J. Immunol. – 1984. – V. 133. – P. 2634–2640.
с Roos M.H., Mollenhauer E., Demant P., Rittner C. A molecular basis for the two locus model of human complement component 4 // Nature. – 1982. – V. 29. – P. 854–856.
с Rosenfield S.I., Ruddy S., Austen K.F. Structural polymorphism of the fourth component of human complement // J. Clin. Invest. – 1969. – V. 48. – P. 2283–2292.
с Schneider P.M., Carroll M.C., Alper C.A. et al. Polymorphism of the human complement C4 and steroid 21-hydroxylase genes: restriction fragment length polymorphisms revealing structural deletions, homoduplications, and size variants // J. Clin. Invest. – 1986. – V. 87. –
650–657.
с Schneider P.M., Stradman-Bellinghausen B., Rittner C. Genetic polymorphism of the fourth component of human complement: Population study and proposal for a revised nomenclature based on genomic PCR typing of Rodgers and Chido determinants // Eur.
Immunogenet. – 1996. – V. 23. – P. 335–344.
36. Schenkel-Brunner H. Human Blood Groups. Chemical and Biochemical Basis of Antigen Specificity. – 2-nd. ed. – Wien, NY: Springer-Verlag, 2000. – 637 p.
37. Silvergleid A.J., Wells R.F., Hafleigh E.B. et al. Compatibility test using 51Chromium-labeled red blood cells in cross-match positive patient // Transfusion. – 1978. – V. 18. – P. 8–14.
777
52. Skanes V.M., Larsen B., Giles C.M. C4B3 allotype with a novel Ch phenotype // Immunogenet. – 1985. – V. 22. – P. 609–616.
53. Strohm P.L., Molthan L. Successful transfusion results using Rg(a + ) blood in four patients with anti-Rg a // Vox Sang. – 1983. – V. 45. – P. 48–52.
54. Swanson J.L. Laboratory problems associated with leukocyte antibodies // AABB: A Seminar on Recent Advances in Immunohematology. – Arlington, 1973. – P. 121–153.
55. Szymanski I.O., Huff S.R., Delsignore R. An autoanalyzer test to determine immunoglobulin class and IgG subclass of blood group antibodies // Transfusion. – 1982. – V. 22. – P. 90–95.
56. Teisberg P., Akeson I., Olaisen B. et al. Genetic polymorphism of C4 in man and localization of a structural C4 locus to the HLA gene complex of chromosome 6 // Nature. – 1976. –V. 264. – P. 253.
57. Teisberg P., Jonassen R., Mevag B. et al. Restriction fragment length polymorphisms of the complement component C4 loci on chromosome 6: studies with emphasis on the determination of gene number // Ann. Hum. Genet. – 1985. – V. 52. – P. 77–84.
58. Tilley C.A., Crookston M.C., Haddad S.A. Shumak K.H. Red blood cell survival studies in patients with anti-Ch a, anti-Yk a, anti-Ge, and anti-Vel // Transfusion. – 1977. – V. 17. – P. 169–172.
59. Tilley C.A., Romans D.G., Crookston M.C. Localisation of Chido and Rodgers determinants to the C4d fragment of human C4 // Nature. – 1978. – V. 276. – P. 713–715.
60. Tippett P., Storry J.R., Walker P.S. et al. Glycophorin A-deficient red cells may have a weak expression of C4-bound Ch and Rg antigens // Immunohematology. – 1996. –
№ 12. – P. 4–7.
61. Westhoff C.M., Sipherd B.D., Wylie D.E., Toalson L.D. Severe anaphylactic reactions following transfusions of platelets to a patient with anti-Ch // Transfusion. – 1992. – V. 32. –
576–579.
111. WHO-IUIS Nomenclature Sub-Committee. Revised nomenclature for human complement component C4 // Eur. J. Immunogenet. – 1993. – V. 20. – P. 301–305.
112. Wibaut B., Mannessier L., Horbez C. et al. Anaphylactic reactions associated with anti-Chido antibody following platelet transfusions // Vox Sang. – 1995. – V. 69. – P. 150–151.
113. Wilfert K., Atkins C.J., Tippett P. Ch and Rg antigens on sialidase treated red cells [Abstract] // Transfus. Med. – 1991. – V. 1 (Suppl.). – P. 57.
114. Yu C.Y. The complete exon - intron structure of a human complement component C4A gene: DNA sequences, polymorphism, and linkage to the 21-hydroxylase gene // J. Immunol. – 1991. – V. 146. – P. 1057–1066.
115. Yu C.Y., Belr K.T., Giles C.M. et al. Structural basis of the polymorphism of human complement components C4A and C4B: gene size, reactivity and antigenicity // EMBO
// – 1986. – V. 5. – P. 2873–2881.
116. Yu C.Y., Campbell R.D., Porter R.R. A structural model for the location of the Rodgers and Chido antigenic determinants and their correlation with the human complement component C4A / C4B isotypes // Immunogenetics. – 1988. – V. 27. – P. 399–405.
117. Yu C.Y., Campbell R.D., Porter R.R. Definitive RFLPs to distinguish between human complement components C4A / C4B isotypes and the major Rodgers / Chido determinants: application to the study of C4 null alleles // Immunogenetics. – 1987. – V. 25. – P. 383–390.
778
Глава 20.
Система Gerbich
систему Gerbich (Гербич) входят 8 антигенов, 3 из них – часто встречающи-еся, 5 встречаются редко (табл. 20.1). Они располагаются в сиалогликопротеинах мембраны эритроцитов, получивших название гликофорин С (GPC) и гликофорин D (GPD). Гликофорин D представляет собой укороченный вариант гликофорина C.
Синтез указанных двух гликофоринов контролируется одним геном – GYPC.
101. нем имеются два инициирующих участка, обеспечивающих синтез длинных и укороченных цепей, – GPC и GPD соответственно. Ген GYPC в составе четы-рех экзонов размещен на хромосоме 2 в позиции q14–q21.
Часто встречающиеся антигены Gerbich (Ge2, Ge3 и Ge4) представлены со-ответствующими аминокислотными последовательностями. Редко встречающи-еся антигены (Wb, An a и Dh a) являются результатом отдельных точковых мута-ций в различных участках гена GYPC. Редкий антиген Ls a возникает вследствие дупликации экзона 3 указанного гена (см. табл. 20.1).
Таблица 20.1
| Антигены Gerbich* | ||||
| Обозначение | Относительная | Локализация на гликофорине | ||
| традиционное | ISBT | частота, % | ||
| Ge2 | GE2 | > 99 | N-терминальный участок GPD | |
| Ge3 | GE3 | > 99 | Аминокислоты в позициях 42–50 GPC и 21 – 29 GPD | |
| Ge4 | GE4 | > 99 | N-терминальный участок GPС | |
| Webb | GE5 | < 1 | Asn 8 Ser GPС | |
| Ls a | GE6 | < 1 | GPС и GPD, кодируемый GYPC с дупликацией экзона 3 | |
| An a | GE7 | < 1 | Ala 2 Ser GPD | |
| Dh a | GE8 | < 1 | Leu 14 Phe GPC | |
| GEIS | GE9 | < 1 | Thr 32Asn GPC и Thr 11 Asn GPD | |
* Daniels [24], Issitt, Anstee [41], Reid и соавт. [97, 99].
Выделяют 3 редких фенотипа Gerbich, для которых характерно отсут-ствие одного антигена и более: Ge: −2, 3, 4 (фенотип Yussef, сокращенноYus), Ge: −2, −3, 4 (фенотип Gerbich) и Ge: −2, −3, −4 (фенотип Leach). Указанные три фенотипа являются следствием трех вариантов делеций: экзона 2, экзона 3, эк-зонов 3 и 4 одновременно.
779
Лица, не содержащие антигенов Ge2, Ge3 и Ge4, встречаются, в основ-ном, среди аборигенов Меланезии и Австралии. Редкие антигены обнаруже-ны у представителей всех рас. Большинство антител системы Gerbich – IgM естественного происхождения, некоторые из них (анти-Ge2 и анти-Ge3) от-носятся к IgG. Трансфузионных осложнений и ГБН антитела Gerbich не вы-зывают.
Гликофорины С и D
гликофоринам относят гликопротеины с высоким содержанием сиаловых кислот. Они идентифицируются посредством электрофореза в додецилсульфат-ном полиакриламидном геле (SDS-PAGE). Большая часть гликофоринов мем-браны эритроцитов (более 90 %) представлена вариантами А и В. Эти гликофо-рины несут антигены системы MNS.
Меньшую по величине долю (около 7 %) составляют два других высокого-мологичных варианта гликофорина – С и D. Их представительство в мембране эритроцитов составляет 6 и 1 % соответственно (Furthmayr [33]). Гликофорины
126. и D несут антигены Gerbich.
Гликофорины А и В не связаны с гликофоринами С и D. Их синтез контроли-руют гены, расположенные на разных хромосомах.
Гликофорин С известен как протеин CD236C, β- и γ-сиалогликопротеин, PAS-2ʹ. Гликофорин D имеет синонимы: компонент D и компонент Е.
Мол. масса гликофоринов С и D 40 и 30 кДа соответственно (Reid [92], Colin, Le Van Kim [17], King [46]). Исследования с использованием Fab-фрагментов МКА к антигенам Gerbich показали, что один эритроцит содержит 143 тыс. мо-лекул гликофорина С и 82 тыс. молекул гликофорина D (Smythe и соавт. [115]).
Расшифрована аминокислотная последовательность гликофоринов С и D (рис. 20.1) (Colin и соавт. [19], Dahr и соавт. [20]).
| NH2 | ** * ♦ * | * | * *** | *** | ||||||||||
| MWSTRSPNST | AWPLSLEPDP | GMASASTTMH | TTTIAEPDPG | MSGWPDGRME | ||||||||||
| GPC | 1 | 22 | 50 | |||||||||||
| GPD | 1 | 29 | ||||||||||||
| TSTPTIMDIV | VIAGVIAAVA | IVLVSLLFVM | LRYMYRHKGT | YHTNEAKGTE | ||||||||||
| GPC | 51 | 79 | 100 | |||||||||||
| GPC | 30 | |||||||||||||
| FAESADAALQ | GDPALQDAGD | SSRKEYFI | COOH | |||||||||||
| GPC | 101 | 128 | ||||||||||||
| GPD | 80 | 107 | ||||||||||||
Рис. 20.1. Аминокислотная последовательность гликофоринов С и D.
171. участки О-гликозилирования; ♦ участок N-гликозилирования; одной линией выделе-ны аминокислотные последовательности трансмембранного домена, двумя линиями – участки связывания для протеинов 4.1R и p55 соответственно.
Гликофорин С имеет три домена . Первый из них, экстрацеллюлярный N-терминальный гликозилированный (позиции 1–57) содержит N-связанный
780
олигосахарид в положении Asn 8 и 12 участков О-гликозилирования. Второй домен – трансмембранный гидрофобный (позиции 58–81), третий домен – цитоплазматический С-терминальный (позиции 82–128) (Colin и соавт. [19], High, Tanner [38]). Цитоплазматический домен гликофорина С связан с ци-тоскелетоном. N-терминальный участок ассоциирован с трансмембранными гликофоринами А и В.
Аминокислотная последовательность гликофорина D определена частично, поскольку N-терминальный участок его блокирован (El-Maliki и соавт. [32]). Гликофорин D представляет собой укороченный вариант гликофорина С без N-терминальной последовательности из 21 аминокислоты. Он идентичен глико-форину С по аминокислотам в позициях 22–128.
Гликофорин D не имеет участков N-гликозилирования, поскольку не содер-жит N-терминального домена (Dahr и соавт. [21]). Антиген Ge3, представлен-ный аминокислотной последовательностью в позициях 40–50 на гликофорине С, присутствует также на гликофорине D (High и соавт. [39]);
Антигенные детерминанты, распознаваемые ксеногенными моно- и по-ликлональными антителами, расположены на цитоплазматических доменах гликофоринов С и D (El-Maliki и соавт. [32], King и соавт. [48], Reid и со-авт. [94]).
Структура гена GYPC
Несмотря на высокую степень гомологии гликофоринов С и D, гомолог гена GYPC на уровне кДНК идентифицировать не удалось. Это свидетель-ствует о том, что самостоятельного гена, контролирующего синтез глико-форина D, не существует. Оба типа гликофоринов кодирует один и тот же ген GYPC (Le Van Kim и соавт. [52], Tanner и соавт. [120]). Как установи-ли Tanner и соавт., различия гликофоринов С и D обусловлены мутацией иРНК гена GYPC, в результате чего трансляция начинается с двух разных то-чек, соответственно, синтезируются два гомологичных полипептида разной длины.
Структура гена GYPC и схема его функционирования исследованы (рис. 20.2–20.5, табл. 20.2).
Рис. 20.2. Генетическая карта локуса GYPC (по Reid, Lomas-Francis [97]).
781
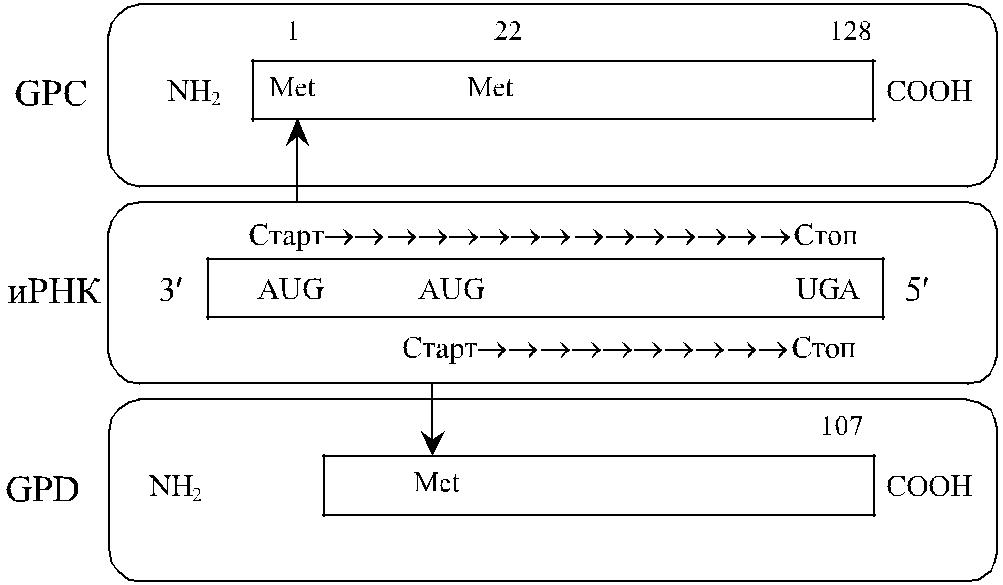
Рис. 20.3. Схема синтеза гликофоринов С и D геном GYPC из двух стартовых точек (по Daniels [24]).
| Таблица 20.2 | ||||
| Организация гена GYPC | ||||
| Экзон | Позиции кодируемых аминокислот | Локализация и специфичность антигена | ||
| в гликофорине | ||||
| GPC | GPD | |||
| 1 | 1–16 | N-терминальный участок и часть экстра- | ||
| целлюлярного домена GPC; N-гликан; Ge4 | ||||
| Met 22 на GPC, часть экстрацеллюляр- | ||||
| 2 | 17–35 | 1–14 | ного домена GPC и GPD, включая его | |
| N-терминальный участок, Ge2 на GPD | ||||
| Часть экстрацеллюлярного домена GPC и | ||||
| 3 | 36–63 | 15–42 | GPD, участок расщепления для трипсина на | |
| обоих гликофоринах, Ge3 | ||||
| 4 | 64–128 | 43–107 | Трансмембранный и цитоплазматические | |
| домены обоих гликофоринов | ||||
Трансляция начинается с AUG-кодона (метионина), представлен-ного в ДНК триплетом AЕG. Вновь синтезированные полипепти-ды имеют метионин в N-области, хотя последний отщепляется от зрело-го протеина. Последовательность РНК вблизи стартового кодона гликофори-на С (CCAGGAAUGU) отдалена от стартовой последовательности (CC(A / G) CCAUGG). Последовательность (CCGGGGAUGG) кодона метионина в пози-ции 22 на гликофорине С находится ближе к стартовому участку (Tanner и со-авт. [120]). Таким образом, первая стартовая точка (для метионина в позиции 1),
782
183. которой начинается трансляция, иногда не считывается. Второй участок, с ко-торого может начаться трансляция, кодирует метионин в позиции 22. В этом случае синтезируется гликофорин D, который, как отмечалось выше, идентичен гликофорину С в позициях 22–128 (см. рис. 20.3). Возможность двух вариантов трансляции одного и того же гена подтверждена экспериментами с трансфек-цией кДНК GYPC в клетки COS-7. Указанные клетки продуцировали оба типа гликофоринов. Трансфекция этой линии кДНК с делециями ATG (кодона мети-онина) приводила к продукции только гликофорина D. В случае замены ATG на ACG в позиции 22 синтезировался гликофорин С. В случае замены обоих ко-донов ATG в позициях 1 и 22 гликофорины не синтезировались. Мутация в ну-клеотиде 4 (ATG T → ATG G) повышала экспрессию гликофорина С в 2 раза по сравнению с выраженностью гликофорина D (Le Van Kim и соавт. [54]).
Ген GYPC представлен четырьмя экзонами общей протяженностью 13,5 кб
(см. табл. 20.2, рис. 20.2) (Colin и соавт. [18], High и соавт. [39]).
Экзоны 1–3 кодируют экстрацеллюлярные домены гликофоринов С и D, эк-зон 4 – трансмембранный и цитоплазматический домены. Экзоны 2 и 3 имеют высокую степень сходства, что объясняется происхождением экзонов путем ду-пликации, хотя при этом экзон 3 содержит вставочную последовательность из 27 пар нуклеотидов, которой нет в экзоне 2. Указанная вставка кодирует амино-кислоты в позициях 42–50 гликофорина С (Colin и соавт. [16]), Le Van Kim и со-
авт. [53]).
На рис. 20.4 и 20.5 представлена схема неравновесного кроссинговера и ва-рианты гена GYPC, приводящие к возникновению редких антигенов и феноти-
пов Gerbich.
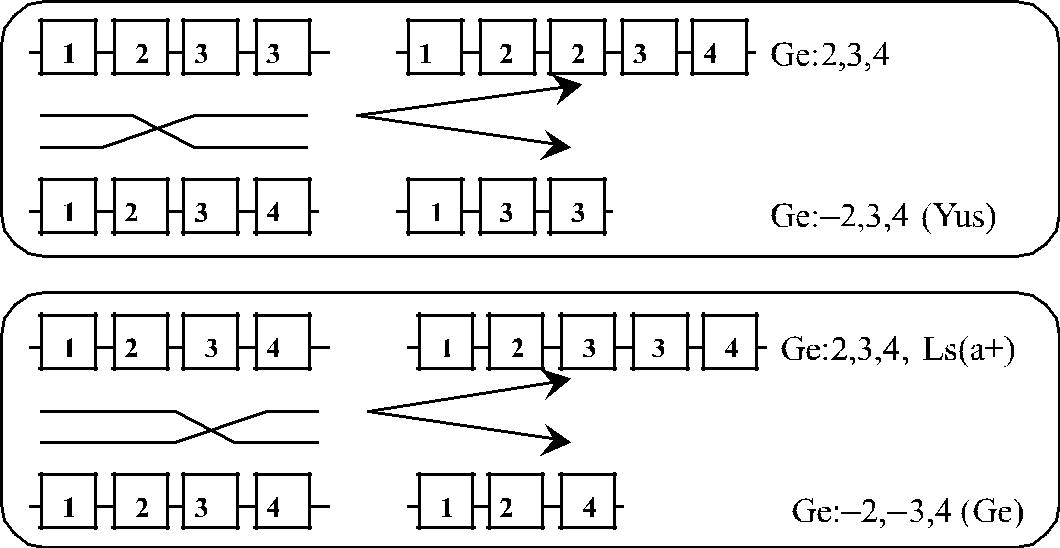
Рис. 20. 4. Неравновесный кроссинговер, приводящий к возникновению необыч-ных вариантов гена GYPC (по Daniels [24]).
783
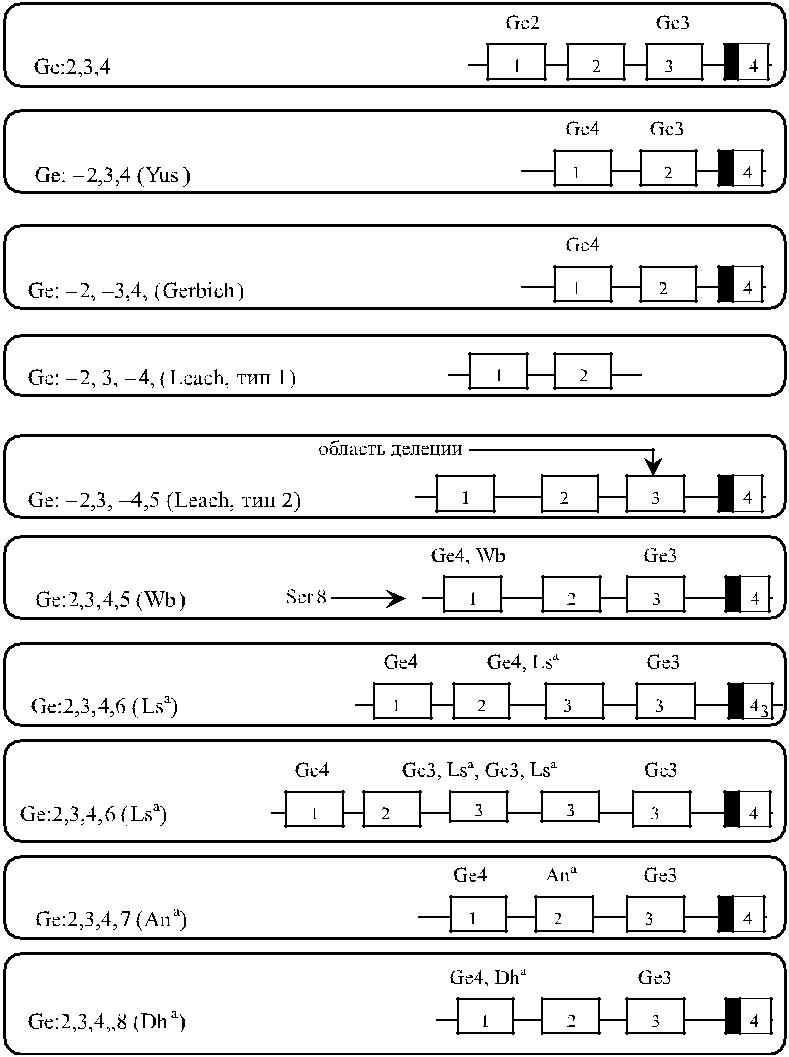
Рис. 20.5. Организация редких вариантов гена GYPC (по Daniels [24]).
Дата: 2019-02-24, просмотров: 421.