Banks и соавт. [1], Spring и соавт. [42, 43] посредством перекрестной имму-нопреципитации показали, что антигенные детерминанты Do a, Gy a, Hy и Jo a расположены на одном и том же экстрацеллюлярном гликопротеине (рис. 16.1), имеющем мол. массу 46,75–57,5 кДа. Обработка эритроцитов эндогликозила-зой F приводила к уменьшению мол массы гликопротеина до 11 кДа, что свиде-тельствовало о N-гликозилировании изучаемого субстрата. Вместе с тем проте-ин Dombrock не подвергался О-гликозилированию.
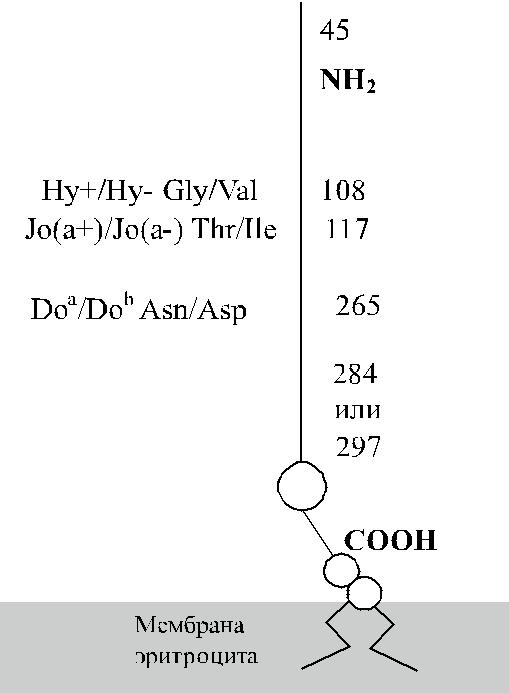
Рис. 16.1. Строение гликопротеина
Dombrock.
732
процессе иммунопреципитации предположительно выделялись также ди-меры указанных соединений.
экспрессии антигенов Gy a и Ну участвуют дисульфидные связи. При об-работке сульфгидрильными реагентами мол. масса гликопротеина уменьшалась до 40–50 кДа и он быстрее мигрировал в полиакриламидном геле в присутствии додецил-сульфата.
Gubin и соавт. [9] провели скрининг базы данных, включающих около 5000 нуклеотидных последовательностей хромосом, полученных из диффе-ренцирующихся эритроидных клеточных линий. Оказалось, что синтез ГФИ-ассоциированных протеинов кодируют гены, расположенные на хромосоме 12.
Идентифицирован фрагмент ДНК, который, по-видимому, и является геном Dombrock. Трансфекция этого фрагмента в эритролейкемические клетки K562 приводила к экспрессии на их поверхности антигенов Do a, Gy a, Hy и Jo a (Gubin
35. соавт. [9]).
Локус DO имеет величину 14 кб, состоит из трех экзонов (рис. 16.2) и коди-рует синтез протеина, состоящего из 314 аминокислот (рис. 16.3). Экзон 1 ко-дирует аминокислоты в позиции 1–45, экзон 2 – в позиции 49–285, экзон 3 – в позиции 286–314, включая ГФИ-ассоциированный фрагмент из 17 аминокислот (Reid, Lomas-Francis [35]).
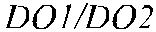
| Рис. 16.2. Генная карта локуса DO. | ||||||||||||
| MGPLINRCKK ILLPTTVPPA TMRIWLLGGL LPFLLLLSGL QSPTEGSEVA | 50 | |||||||||||
| IKIDFDFAPG SFDDQYQGCS KQVMEKLTQG DYFTKDIEAQ KNYFRMWQKA | 100 | |||||||||||
| HLAWLNQGKV LPQNMTTTHA VAILFYTLNS NVHSDFTRAM ASVARTPQQY | 150 | |||||||||||
| ERSFHFKYLH YYLTSAIQLL RKDSIMENGT LCYEVHYRTK DVHFNAYTGA | 200 | |||||||||||
| TIRFGQFLST SLIKEEAQEF GNQTLFTIFT CLGAPVQYFS LKKEVLIPPY | 250 | |||||||||||
| ELFKVINMSY HPRGNWLQLR STGNLSTINC QLLKASSKKC IPDPIAIASL | 300 | |||||||||||
| SFLTSVIIFS KSRV | 314 | |||||||||||

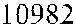
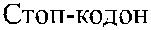
Рис. 16.3. Аминокислотная последовательность гликопротеина Dombrock.
Обследование индивидов Do(a + ) и Do(a −) с использованием молекулярно-генетических методов показало, что антигенные различия Do a / Do b обусловлены нуклеотидной заменой A 793 G в экзоне 2 гена DO (Gubin и соавт. [9], Rios и соавт. [36]). Последняя приводит к аминокислотной замене Asn 265 Asp (табл. 16.4). Два других замещения нуклеотидов, приводящие к появлению аминокислотных остат-ков Tyr 126 и Leu 208, также связаны с различиями Do a / Do b. Антигенные различия Hy +/Hy − и Jo(a + )/Jo(a −) обусловлены заменами Gly 108 Val и Thr 117 Ile.
733
Таблица 16.4
Дата: 2019-02-24, просмотров: 373.