| Показатель | Частота, % | |||
| у мужчин | у женщин | |||
| Фенотип | Xg(a + ) | 65,9 | 88,7 | |
| Xg(a −) | 34,1 | 11,3 | ||
| Xg a / Xg a | 0 | 43,4 | ||
| Генотип | Xg a / Xg | 65,9 | 45,0 | |
| Xg / Xg | 34,1 | 11,6 | ||
700
Антиген Xg a обнаружен у представителей всех исследованных популяций. Наибольшая частота гена Xg a констатирована у аборигенов Новой Гвинеи и Австралии, жителей о. Сардинии и бразильцев (табл. 14.3).
| Таблица 14.3 | |||||
| Частота генов XG у разных народов | |||||
| Популяция | Количество | Xga | Xg | Источник | |
| обследованных | |||||
| Аборигены Новой Гвинеи (папуасы) | 263 | 0,85 | 0,15 | [85] | |
| Австралийские аборигены | 352 | 0,79 | 0,21 | [85] | |
| Индейцы навахо | 308 | 0,77 | 0,23 | [28] | |
| Жители о. Сардиния | 322 | 0,76 | 0,24 | [89] | |
| Бразильцы белые | 1 078 | 0,74 | 0,26 | [68] | |
| Бразильцы мулаты | 786 | 0,62 | 0,38 | [68] | |
| Бразильцы негры | 827 | 0,57 | 0,43 | [68] | |
| Евреи Израиля, сефарды | 201 | 0,68 | 0,32 | [1] | |
| Японцы | 529 | 0,68 | 0,32 | [67] | |
| Жители стран Северной Европы | 15 716 | 0,66 | 0,34 | [16, 27, 52, 65, 66, | |
| 80] | |||||
| Индусы, Бомбей | 100 | 0,65 | 0,35 | [10] | |
| Индусы, Сингапур | 91 | 0,57 | 0,43 | [77] | |
| Китайцы, континентальный | 171 | 0,60 | 0,40 | [28] | |
| Китай | |||||
| Китайцы, Тайвань | 178 | 0,53 | 0,47 | [28] | |
| Китайцы, Гонконг | 1 300 | 0,49 | 0,51 | [63] | |
| Китайцы, Сингапур | 165 | 0,45 | 0,55 | [11, 77] | |
| Испанцы | 636 | 0,59 | 0,41 | [96] | |
| Тайцы | 181 | 0,57 | 0,43 | [74] | |
| Греки | 638 | 0,55 | 0,45 | [38] | |
| Негры, Нью-Йорк, жители | 219 | 0,55 | 0,45 | [40] | |
| Ямайки | |||||
| Малайцы, Сингапур | 72 | 0,54 | 0,46 | [77] | |
| Тайваньцы (аборигены) | 164 | 0,38 | 0,62 | [28] | |
701
Свойства
Антиген Xg a не вполне развит к моменту рождения. Его экспрессия на эри-троцитах новорожденных ниже, чем на эритроцитах взрослых (Mayr [65], Toivanen, Hirvonen [94]). Вещество Xg a формируется в относительно поздние сроки внутриутробного развития. Из 54 плодов от 6 до 20 недель развития толь-ко 19 были Xg(a + ), что существенно ниже частоты встречаемости этого антиге-на в популяции (Toivanen, Hirvonen [93]). Антиген Xg(a + ) появляется у плодов начиная с 12 недель развития. У 5–10 % мальчиков Xg(a + ) при рождении ука-занный антиген не удается выявить серологическими методами (Szabo и соавт. [90]). По мере взросления организма выраженность его на эритроцитах возрас-тает (Campana и соавт. [15]).
О процессе эритропоэза in vitro антиген Xg a появлялся на клетках после гли-кофорина А и протеина полосы 3, но раньше Rh-протеина (Daniels, Green [20]).
Антиген Xg a не является сильным иммуногеном. На эритроцитах гетерози-готных мужчин и гомозиготных женщин он выражен одинаково. У женщин, ге-терозиготных по гену Xg a, экспрессия антигена может быть снижена. До 10 % гетерозиготных женщин имеют слабовыраженный антиген Xg a (Race, Sanger [73]). Слабые варианты Xg a среди мужчин редки.
Количество антигенных участков Xg a на эритроците, по данным разных ав-
торов, варьирует от 159 (Foucher и соавт. [36]) до 9000 (Szabo и соавт. [90]).
О 1974 г. Fellous и соавт. [34] обнаружили антиген Xg a на фибробластах
В гибридомных клетках человек – мышь. Антиген выявлялся одновремен-но с другими продуктами Х-ассоциированных локусов. Тем самым было еще раз подтверждено, что антиген Xg a контролируется геном, расположенным на Х-хромосоме. При инактивации Х-хромосомы антиген Xg a на клетках человека не выявлялся (Hsu и соавт. [54]).
Антиген Xg a разрушается бромелином, фицином, папаином, проназой, трип-сином и химотрипсином (Habibi и соавт. [49], Herron, Smith [53]), однако устой-чив к воздействию сиалидазой.
Молекулярная основа
Herron и Smith [53] посредством иммунопреципитации субстрата антитела-ми анти-Xg a установили, что антигенные эпитопы Xg a эритроцитарной мем-браны относятся к сиалогликопротеинам. Установлена мол. масса вещества (22,5 –28 кДа). Обработка эритроцитов сиалидазой приводила к уменьшению мол. массы. Гликопротеин, определяющий специфичность Xg, тесно связан с белком CD99 (Petty, Tippett [71], Fouchet и соавт. [37]).
Кодируемый геном XG протеин состоит из 180 аминокислот. Экстрацеллюлярный N-терминальный домен включает 142 аминокислоты, содержит 16 участков О-гликозилирования, но не имеет участков N-гликозилирования. Остальная часть Xg-протеина представлена трансмембранным и цитоплазматическим С-терминальным доменами (рис. 14.1) (Ellis и соавт. [32]).
702

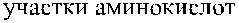
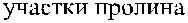
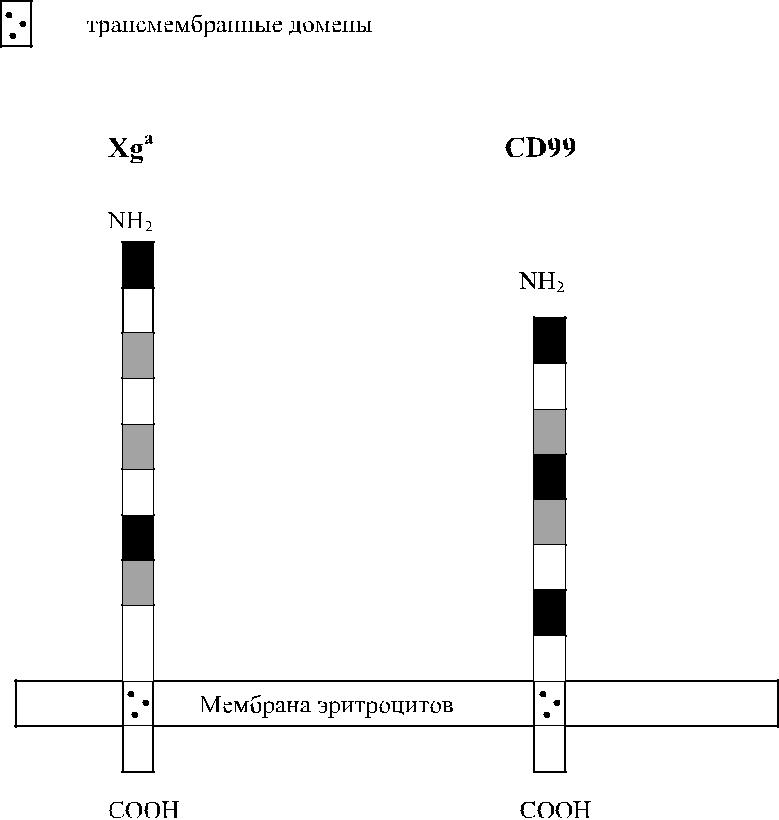
Рис. 14.1. Строение гликопротеинов Xg a и CD99.
Последовательность аминокислот Xg- и CD99-гликопротеинов расшифрова-на (рис. 14.2 и 14.3).
| MESWWGLPCL | AFLCFLMHAR | GQRDFDLADA | LDDPEPTKKP | NSDIYPKPKP | 50 |
| PYYPQPENPD | SGGNIYPRPK | PRPQPQPGNS | GNSGGYFNDV | DRDDGRYPPR | 100 |
| PRRRPPAGGG | GGGYSSYGNS | DNTHGGDHHS | TYGNPEGNMV | AKIVSPIVSV | 150 |
| VVVTLLGAAA | SYFKLNNRRN | CFRTHEPENV | 180 |
Рис. 14.2. Аминокислотная последовательность Xg-гликопротеина.
| MARGAALALL | LFGLLGVLVA | APDGGFDLSD | ALPDNENKKP | TAIPKKPSAG | 50 |
| DDFDLGDAVV | DGENDDPRPP | NPPKPMPNPN | PNHPSSSGSF | SDADLADGVS | 100 |
| GGEGKGGSDG | GGSHRKEGEE | ADAPGVIPGI | VGAVVVAVAG | AISSFIAYQK | 150 |
| KKLCFKENAE | QGEVDMESHR | NANAEPAVQR | TLLEK | 185 |
Рис. 14.3. Аминокислотная последовательность CD99-гликопротеина.
Транскрипты гена XG, помимо эритроидных клеток и фибробластов, выявле-ны в скелетных мышцах, сердце, плаценте, клетках предстательной и щитовид-ной желез, позвоночнике и трахее (Fouchet и соавт. [37]). Некоторое количество транскриптов XG обнаружено в легких, почках, яичке, а также в тканях плода и
703
некоторых перевиваемых лимфоидных клеточных линиях (Fouchet и соавт. [37], Ellis и соавт. [31]).
Связь с антигеном CD99
В 1979 г. Levy и соавт. [60] путем иммунизации мышей лейкемическими Т-клетками человека получили моноклональные антитела анти-CD99, которые, как показали Goodfellow и Tippett [48], реагировали с антигеном Xg.
Антиген CD99, открываемый этими антителам, присутствовал практически во всех тканях человека (Goodfellow [41]), однако в отличие от других клеток эритроциты экспрессировали его в разных количествах. С помощью радиоим-мунного антиглобулинового метода и проточной цитофлюориметрии выделены два типа людей: с высокой (high) и низкой (low) экспрессией антигена CD99 на эритроцитах (Goodfellow, Tippett [48], Foucher и соавт. [36]).
Установлено, что высокая экспрессия CD99 характерна для эритроцитов
Xg(a + ). У женщин Xg(a −) экспрессия CD99 низкая. У 68 % мужчин Xg(a −) вы-
явлена высокая экспрессия CD99, в 32 % – низкая.
На основании полученных данных Goodfellow и соавт. [45, 48], Tippett и со-авт. [92] высказали предположение о существовании на Y-хромосоме локуса YG, который контролирует уровень экспрессии антигена CD99. По мнению ав-торов, ген YG представлен двумя аллелями: Yg a и Yg. Лица с высокой экспрес-сией CD99 имеют ген Xg a и Yg a, в то время как у людей со слабовыраженным антигеном CD99 присутствуют аллели Xg a и Yg. Далее указанные авторы усо-вершенствовали предложенную модель, предположив существование гена XGR, регулирующего одновременно экспрессию антигенов CD99 и Xg а и присутству-ющего как на Y-, так и на Х-хромосоме.
Uchikawa и соавт. [95] нашли у 2 японских доноров антитела анти-CD99, по-добные описанным выше, но несколько отличающиеся от них. Эти антитела ре-агировали с антигеном Xg а, получившим обозначение XG2.
Вещество CD99, так же как Xg a, относится к сиалогликопротеинам. Равным образом CD99 разрушается папаином, проназой, трипсином и химотрип-
сином (Goodfellow [41], Latron и соавт. [59], Daniels, Tippett [21]). Антиген
CD99 в основном устойчив к действию сиалидазы, однако некоторые образ-цы анти-CD99-подобных антител не реагировали с эритроцитами, обрабо-
танными сиалидазой (Goodfellow [41], Latron и соавт. [59], Daniels, Tippett [21]). Иммуноблоттинг с эритроцитами, лимфоцитами, различными клеточ-ными линиями человека, гибридными клетками человек – мышь показал, что антиген CD99 ассоциирован с гликопротеином, имеющим мол. массу 32 кДа
(Petty, Tippett [71], Fouchet и соавт. [37], Latron и соавт. [59], Daniels, Tippett [21], Banting и соавт. [6], Anstee и соавт. [3]). Обработка эритроцитов сиалида-зой приводила к снижению мол. массы CD99 (Petty, Tippett [71], Fouchet и со-авт. [37], Latron и соавт. [59], Anstee и соавт. [3]). Иммуноблоттинг преципита-тов, полученных с помощью антител анти-Xg a и анти-CD99, показал, что эти
704
антигены расположены на разных структурах (Fouchet и соавт. [37]). Частично очищенный гликопротеин CD99 ингибировал активность антител анти-CD99 и анти-Xg a (Banting и соавт. [6]).
Petty и Tippett [71] установили , что аллогенные анти-Xg a-антитела преци-питировали гликопротеины Xg a и CD99. Авторы пришли к заключению, что эти высокогомологичные структуры связаны между собой и представлены в эритроцитарной мембране в виде гетеродимера. При использовании монокло-нальных анти-Xg a-антител эти результаты воспроизвести не удалось (Fouchet
у соавт. [37]).
Клонирование гена MIC2 показало, что антиген CD99 локализован на проте-ине, состоящем из 186 аминокислот. Протеин включает N-терминальный сиг-нальный пептид из 20 или 21 аминокислоты (расщепляется после встраивания
и мембрану эритроцита). Экстрацеллюлярная часть пептида включает 100 ами-нокислот, имеет гидрофобный трансмембранный домен и цитоплазматический фрагмент из 36 аминокислот (Goodfellow и соавт. [47], Banting и соавт. [5]). Различий между молекулами CD99, кодируемыми Х- и Y-хромосомами, не вы-
явлено (Banting и соавт. [6]).
Подсчитано, что один лимфоцит несет 27 тыс. эпитопов CD99. Для тромбо-цитов этот показатель составил 4 тыс. На эритроцитах число антигенных участ-ков, связывающих анти-CD99-антитела, существенно меньше: 1 тыс. для вари-антов с высокой экспрессией CD99 и только 100 для вариантов с низкой экс-
прессией (Foucher и соавт. [36]).
Антитела анти-Xg a
Антитела анти-Xg a выявлены Mann и соавт. [64] в сыворотке крови муж-чины, которому многократно переливали кровь. Позднее найдены другие об-разцы антител указанной специфичности (Azar и соавт. [4], Cook и соавт. [17], Devenish и соавт. [27], Herron, Smith [53], Mak и соавт. [63], Metaxas, Metaxas-Buhler [66], Nakajima и соавт. [67], Race, Sanger [73], Sausais и соавт. [82], Yokoyama и соавт. [99]).
Анти-Xg a-антитела встречаются редко: при исследовании 325 сывороток в Гонконге антитела анти-Xg a были идентифицированы в 4 случаях, один образец ука-занных антител приходился на 60 108 обследованных доноров (Azar и соавт. [4]).
Относительно низкая частота встречаемости антигена Xg a среди мужчин дала основание полагать, что они в большей мере, чем женщины, подверже-ны аллоиммунизации антигеном Xg a. Действительно, из 14 сывороток анти-Xg a, найденных первыми, 12 образцов были получены от мужчин (Race, Sanger [73]), из 13 образцов анти-Xg a, выявленных у японцев, 11 принадлежали здоро-вым лицам – донорам мужчинам (Azar и соавт. [4]).
Анти-Xg a-антитела чаще встречаются у монголоидов, что, по-видимому, об-условлено еще более низкой распространенностью антигена Xg a среди пред-ставителей этой расы. Остается, однако, без объяснения тот факт, что антитела
705
анти-Xg a встречаются у мужчин значительно чаще, чем можно ожидать, исходя из частоты встречаемости этого антигена в популяции.
Антитела анти-Xg a присутствуют в сыворотках обычно в чистом виде, без примеси других антител. Они, как правило, естественного происхождения: их обнаруживают у здоровых лиц, не имевших беременностей и гемотрансфузий.
и большинстве случаев они относятся к классу IgG, и лишь отдельные образ-цы проявляют агглютинирующую активность в солевой среде. Адекватный ме-тод выявления анти-Xg a-антител – непрямая антиглобулиновая проба. Многие образцы указанных антител обладают способностью связывать комплемент. Посттрансфузионных осложнений и ГБН они не вызывают (Issitt, Anstee [56]). Описан больной, имевший анти-Xg a-антитела, которому были перелиты шесть доз эритроцитов Xg(a + ) без каких-либо реакций (Cook и соавт. и соавт. [17]). Тесты с эритроцитами, меченными Cr51, подтвердили заключение о том, что анти-Xg a-антитела не влияют на продолжительность циркуляции перелитых эритроцитов (Sausais и соавт. [82]).
одной женщины во время беременности выявлены аутоиммунные анти-Xg a-антитела (Yokoyama и соавт. [99, 100]).
Ellis и соавт. [31] получили мышиные моноклональные анти-Xg a-реагенты. Мышей предварительно иммунизировали субстратом, содержащим фрагменты N-терминального участка Xg-гликопептида.
Инактивация Х-хромосомы
Нормальные клетки всех млекопитающих имеют две Х-хромосомы у особей женского пола и только одну Х-хромосому у особей мужского пола. Для разви-тия зародышевой клетки достаточно одной Х-хромосомы. Одновременное функ-ционирование в зиготе двух гомологичных Х-хромосом исключено благодаря яв-лению, получившему название «инактивация Х-хромосомы, или эффект Лайона».
а каждой соматической клетке женского организма (Х / Х) активной является только одна Х-хромосом, активность другой подавляется в раннем эмбриональ-ном периоде (Lyon [61, 62]). Инактивация одной из двух Х-хромосом (отцовской или материнской) – событие случайное. Количество клеток с отцовской и мате-ринской Х-хромосомами приблизительно одинаковое. Потомство клетки, в кото-рой произошла инактивация одной из Х-хромосом, будет обладать точно такой же инактивированной хромосомой. Таким образом, женские особи химеричны по Х-хромосоме, поскольку в одних клетках активна отцовская Х-хромосома, в дру-гих – материнская. Инактивация генов Х-хромосомы происходит в позиции цис. На одной из Х-хромосом возникает центр инактивации, Xist, который образует большой иРНК-транскрипт, блокирующий Х-хромосому (Lyon [61]).
Сначала полагали, что нейтрализации подвергаются все без исключения гены инактивированной Х-хромосомы. Однако в дальнейшем стало очевидным, что ряд генов (не мене 20) в такой Х-хромосоме не инактивируется (Davies [61]). Одним из генов, не подвергающихся инактивации, является XG. Если бы
706
ген XG пребывал на одной Х-хромосоме в активном состоянии, а на другой – в неактивном, то женщины, гетерозиготные по гену Xg a (Xg a / Xg), должны были бы иметь в периферической крови смешанную популяцию эритроцитов, состо-ящую из клеток Xg(a + ) и Xg(a −). В действительности же этого не наблюдается (Race, Sanger [73], Klinger и соавт. [58], Ducos и соавт. [29]).
Описаны случаи естественных и трансплантационных химер по Xg а, однако при этом было установлено, что эритроциты Xg(a + ) и Xg(a −) происходили из одних и тех же костномозговых предшественников (Sparkes и соавт. [88]).
Ген MIC2, контролирующий синтез антигена CD99, также не подвергается инактивации (Goodfellow и соавт. [46]). Гибридные клеточные линии, содержав-шие инактивированные Х-хромосомы, продуцировали антиген CD99.
Имеются данные, свидетельствующие о том, что локус XG нейтрализуется при инактивации дефектных Х-хромосом с наличием делеций (Polani и соавт. [72]).
Локус XG картирован на коротком плече Х-хромосомы. Среди 20 женщин с делецией короткого плеча Х-хромосомы 13 имели фенотип Xg(a + ). Такая ча-стота соответствует встречаемости антигена Xg a среди мужчин (Sanger и соавт. [79, 81]), поэтому есть все основания полагать, что у женщин с делецией ко-роткого плеча на одной Х-хромосоме антиген Xg a вырабатывается за счет гена XG другой, нормальной, Х-хромосомы. Локус MIC2, контролирующий CD99, при инактивации дефектной Х-хромосомы нейтрализации не подвергается (Goodfellow и соавт. [46]).
Псевдоаутосомы Xg
в процессе мейоза у мужчин Х- и Y-хромосомы расходятся в разные сперма-тоциты. Подобно аутосомам, Х- и Y-хромосомы в процессе мейотического деле-ния спариваются. При спаривании и последующем разделении возможно пере-распределение генного материала – рекомбинации. Такие участки получили на-звание псевдоаутосомных, поскольку гены, находящиеся в этих участках, в том числе Xg, наследуются не как Х-сцепленные, и их ошибочно принимают за ау-
тосомные (Burgoyne [13, 14], Ellis, Goodfellow [30], Rappold и соавт. [75]).
Частота рекомбинаций в псевдоаутосомах в 20 раз выше, чем в других хро-мосомах. Некоторые гены псевдоаутосом, расположенные близко к теломере, претерпевают рекомбинации в 50 % случаев. При проведении посемейных ис-следований такие гены невозможно отличить от аутосомных. Ген MIC2, контро-лирующий антиген CD99, является псевдоаутосомным и также подвержен ре-комбинациям между гомологичными участками Х- и Y-хромосом. Такие реком-бинации в процессе мейоза выявлены примерно у 2 % мужчин (Goodfellow и соавт. [44]). Псевдоаутосомные участки, располагающиеся на Х-хромосоме, по-сле инактивации Х-хромосомы остаются активными.
Ген XG не относится к псевдоаутосомным, однако сцеплен с другими, обла-дающими такой характеристикой (Ellis и соавт. [32]). В очень редких случаях ген XG, по-видимому, вовлекается в рекомбинации с гомологичным участком
707
Y-хромосомы. Именно этим объясняют случаи рождения сыновей Xg(a + ) у женщин Xg(a −) Sanger и соавт. [80], Chown и соавт. [16], Tippett, Ellis [91] и др.
Гены MIC2 и XG
Ген MIC2, как отмечалось выше, контролирует антиген CD99. При изучении гибридных клеток человек – мышь установлено, что локус MIC2 присутству-ет как на Х-, так и на Y-хромосоме (Goodfellow и соавт. [42, 43], Curry и соавт. [18]). По данным Goodfellow и соавт. [43], гибридные клетки экспрессировали CD99 и в тех случаях, когда содержали только одну (Х или Y) половую хромо-сому человека. Клонирование кДНК MIC2 показало идентичность локуса MIC2 на Х- и Y-хромосомах (Goodfellow и соавт. [47], Darling и соавт. [22]).
Локус MIC2 картирован на концах короткого плеча Х- и Y-хромосом в пози-циях X pter → X p22.32 и Y pter → Yp11.2 (Buckle и соавт. [12]).
Выделение геномной ДНК, примыкающей к локусу MIC2, показало нали-чие генного вещества, связанного с псевдоаутосомными структурами (Smith и соавт. [86]). Ген MIC2 на Х- и Y-хромосоме состоит из 10 небольших экзонов (табл. 14.4). Экзон 1 кодирует лидер-пептид, экзоны 2–9, а также часть экзона 10 – протеин CD99.
| Таблица 14.4 | |||||||
| Организация генов MIC2 и XG * | |||||||
| MIC2 | XG | ||||||
| Экзон | |||||||
| Размер | Аминокислота1 | Размер | Размер | Аминокислота1 | Размер | ||
| экзона, пн | интрона, кб | экзона, пн | интрона, кб | ||||
| 1 | ~244 | 1–23 | 23 | 246 | 1–21 | 12,5 | |
| 2 | 33 | 23–34 | 3,2 | 42 | 21–35 | 3,3 | |
| 3 | 48 | 34–50 | 2,4 | 24 | 35–43 | 8,3 | |
| 4 | 45 | 50–65 | 0,6 | 63 | 43–64 | 7,0 | |
| 5 | 69 | 65–88 | 1,0 | 63(66)2 | 64–85 | 7,0 | |
| 6 | 48 | 88–104 | 1,2 | 69 | 85–108 | 2,0 | |
| 7 | 51 | 104–121 | 4,1 | 51 | 108–125 | 10,0 | |
| 8А3 | 45 | (125–140)3 | |||||
| 8 | 114 | 121–159 | 6,8 | 36 | 125–137 | 5,0 | |
| (140–152) | |||||||
| 9 | 57 | 159–178 | 7,7 | 117 | 137–176 | 4,0 | |
| (152–191) | |||||||
| 10 | 533 | 178–186 | 67(244) | 176–180 | |||
| (191–195) | |||||||
* По Tippett, Ellis [93], Ellis и соавт. [32], Smith и соавт. [86].
с Аминокислоты, кодируемые генами MIC2 и XG на эритроидной форме Xg-гликопротеина;
2 кДНК XG содержит дополнительную вставку величиной 3 пн, кодирующую серин в пози-ции 86 между экзонами 5 и 6;
3 Экзон 8А представлен только в фибробластах, в клетках эритроидного ряда он отсутствует.
708
Гены MIC2 и XG характеризуются высокой степенью гомологии. Подобно гену MIC2 ген XG также включает 10 экзонов. Экзон 1 кодирует лидер-пептид, экзоны 2–10 – иммунодоминантный протеин. Дополнительный экзон XG, полу-чивший обозначение 8А, представлен только в транскриптах из фибробластов (Tippett, Ellis [91], Ellis и соавт. [32]).
Экзоны 1–3 гена XG Y-хромосомы менее активны по сравнению с экзона-ми 1–3 гена XG Х-хромосомы и образуют меньшее количество транскриптов (Weller и соавт. [97]).
Одиночная трансфекция (только кДНК MIC2 или XG) и двойная трансфек-ция (кДНК MIC2 и XG одновременно) мышиных фибробластов показали, что антигенные эпитопы Xg и CD99 экспрессируются на мембране клеток незави-симо друг от друга (Fouchet и соавт. [37]).
Экзоны 1–3 гена XG Y-хромосомы менее активны по сравнению с экзона-ми 1–3 гена XG Х-хромосомы и образуют меньшее количество транскриптов (Weller и соавт. [97]).
Одиночная трансфекция (только кДНК MIC2 или XG) и двойная трансфек-ция (кДНК MIC2 и XG одновременно) мышиных фибробластов показали, что антигенные эпитопы Xg и CD99 экспрессируются на мембране клеток незави-симо друг от друга (Fouchet и соавт. [37]).
Ген XGR
людей Xg(а −) экспрессия антигена CD99 варьирует от низкой степени до вы-сокой (Tippett и соавт. [92]). Для объяснения этого феномена Goodfellow и соавт. [45] предложили гипотезу о существовании XG-регуляторного локуса – XGR. В пози-ции цис ген XGR влияет на активность генов XG и MIC2 на Х-хромосоме, а также гена MIC2 на Y-хромосоме. Ген XGR представлен двумя аллелями: XGR low и XGR high. Аллель XGR low препятствует экспрессии CD99, в то время как аллель XGR high ей спо-собствует. В соответствии с этой моделью женщины Xg(a −) имеют ген XGR low на обеих Х-хромосомах и экспрессия CD99 у них неизменно низкая. Мужчины Xg(a −) имеют ген XGR low на Х-хромосоме, но при этом на Y-хромосоме может присутство-вать как XGR low, так и XGR high, и именно это определяет уровень экспрессии CD99.
Ген XGR является псевдоаутосомным, поскольку образуется в результате X–Y-рекомбинации.
Модель, согласно которой экспрессия антигенов Xg a и CD99 регулируется од-ним и тем же геном XGR, позволяет объяснить, почему частота и выраженность антигенов Xg a и CD99 столь связаны. Она также позволяет понять, почему матери Xg(a −) имеют сыновей Xg(a + ): сын наследует от матери ген Xg с Х-хромосомой,
с от отца ген XGR high с Y-хромосомой, несущей рекомбинацию XG–XGR, кодиру-ющую антиген Xg a.
Следует отметить, что модель, предложенная Goodfellow и соавт., остается ги-потетической, однако она весьма конструктивна, поскольку позволяет объяснить имеющееся разнообразие фенотипов Xg и CD99 (табл. 14.5).
709
Таблица 14.5
Влияние аллелей High и Low гена XGR на выраженность антигенов Xg a и CD99
| Пол | XGR-аллели на хромосоме | Фенотип | ||||
| X | X | Xg | CD99 | |||
| Женщины | High | High | Xg(a + ) | Сильный | ||
| High | Low | Xg(a + ) | Сильный | |||
| Low | Low | Xg(a −) | Слабый | |||
| X | Y | Xg | CD99 | |||
| Мужчины | High | High | Xg(a + ) | Сильный | ||
| High | Low | Xg(a + ) | Сильный | |||
| Low | High | Xg(a −) | Сильный | |||
| Low | Low | Xg(a −) | Слабый | |||
Мужчины ХХ
Рекомбинации Х–Y затрагивают участки хромосом, получившие название «псевдоаутосомные». Участки Y-хромосомы, определяющие мужской пол, в том числе тестисдетерминирующий ген SRY, в рекомбинациях, как правило, не участву-ют. Однако встречаются исключения из этого правила: примерно один из 20 000 мужчин имеет хромосомный набор ХХ, свойственный женскому организму.
Как полагает Fergusson-Smith [35], в результате рекомбинации генетическо-го материала на концах короткого плеча Х- и Y-хромосом локус XG отцовской Х-хромосомы заменяется тестисдетерминирующим геном SRY из Y-хромосомы. Образуется Х-хромосома, определяющая мужской пол. Такие индивиды страда-ют бесплодием, несмотря на нормально выраженные мужские половые призна-ки (Davies [23], De la Chapelle [24, 25], Jacobs, Hassold [56]).
Антигены Xg и CD99 имеют отношение к феномену ХХ-дисомии (рис. 14.4): пробанд (III-2) Xg(a −) с высокой экспрессией антигена CD99 имел кариотип ХХ. Его отец (II-2) Xg(a + ) имел ген Yg a (XGR high), происходивший из Y-хромосомы. Брат отца (II-1) имел такую же Y-хромосому, его эритроциты Xg(a −) также содержали высокоэкспрессированный антиген CD99. Наиболее вероятное объяснение кариотипа ХХ: отец пробанда имел Х-хромосому, в ко-торой локус XG был замещен фрагментом короткого плеча Y-хромосомы, со-держащим ген SRY.
Присутствие Y-хромосомного материала у большинства мужчин, имеющих кариотип ХХ, было подтверждено результатами молекулярно-генетических ис-следований. Кариотип таких лиц получил обозначение Y( + )XX.
Petit и соавт. [69] выявили мужчин с кариотипом ХХ, у которых Y-генетический материал отсутствовал.
в редких случаях мужчины ХХ наследуют от отца ген Xg a. Это дает основа-ния полагать, что рекомбинации Х- и Y-хромосом могут происходить без уча-
стия локуса XG (De la Chapelle и соавт. [25], Evans и соавт. [33]).
Evans и соавт. отметили, что у мужчин ХХ короткое плечо обеих Х-хромосом
710
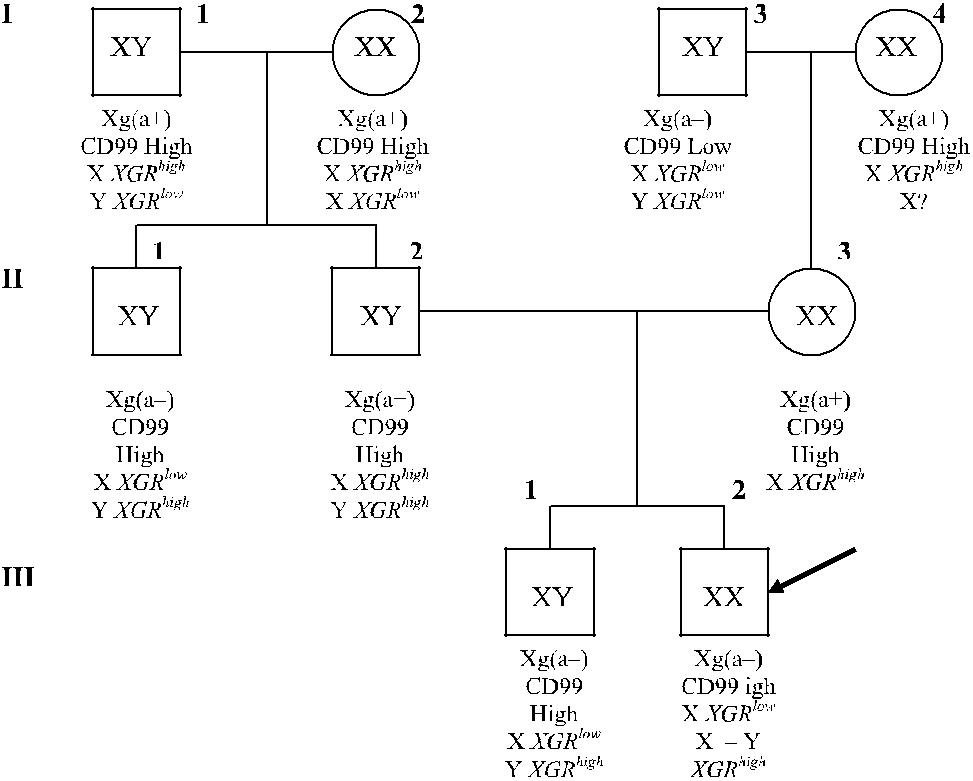
Рис. 14.4. Родословная мужчины с кариотипом ХХ, показывающая возмож-ность рекомбинации X–Y (по De la Chapelle и соавт. [26]) с различными уровня-ми экспрессии антигена СD99. Пробанд (мужчина III-2) Xg(a−) унаследовал: от матери (II-3) Х-хромосому с геном XGR low, от отца (II-2) рекомбинантную Х–Y-хромосому, в которой локус XG замещен геном XGR high. У брата пробанда реком-бинация локуса XG не затронула Y-хромосому.
значительно длиннее, чем у Х-хромосом женщин. Соответственно рекомбина-ции Х–Y могут происходить с различным количеством генетического материа-ла, и это объясняет, как одна и та же Х-хромосома может нести одновременно локусы XG и SRY.
Дата: 2019-02-24, просмотров: 421.