Lu a и Lu b
и 1945 г. Callender и соавт. [17] обнаружили у женщины, страдавшей системной красной волчанкой, антитела, которые образовались у нее после трансфузии крови донора по фамилии Lutheran. Таким образом, первый антиген системы Lutheran – Lu a, открытый авторами, и сама система своим названием обязаны указанному донору.
Десятью годами позднее Cutbush и Chanarin [31] описали антитела, откры-вавшие антиген, антитетичный фактору Lu a, который обозначили Lu b.
Частота антигена Lu a около 8 % среди европеоидов и негроидов. Он встре-чается очень редко или отсутствует у монголоидов (Bertinshaw и соавт. [9], Callender, Race [16], Chown и соавт. [23, 24], Dublin и соавт. [44], Hartmann и соавт. [66], Mainwaring, Pickles [84], Mourant и соавт. [99], Yung и соавт. [152]).
Последующие популяционные исследования с использованием двух сыво-роток, анти-Lu a и анти-Lu b, выявили лиц редкого нулевого фенотипа Lu(a −b −) (Rowe и соавт. [118], Shaw и соавт. [123]).
Посемейными исследованиями показано кодоминантное наследование генов
Lu a и Lu b (Chown и соавт. [23, 24], Lawler [79], Race, Sanger [113]).
Молекулярно-генетическими исследованиями последнего десятилетия уста-новлено, что специфичность антигенов Lu a и Lu b обусловлена мутацией в эк-зоне 3 гена LU, приводящей к замене гистидина на аргинин в положении 77 (El Nemer и соавт. [51], Parsons и соавт. [104]).
Серологические исследования выявили вариабельность экспрессии антиге-нов Lutheran у разных лиц. Однако у членов одной и той же семьи выражен-ность антигенов примерно одинакова (Race, Sanger [113]). Другой особенно-стью антигенов Lutheran является выраженный эффект дозы (Cutbush, Chanarin [31], Greenwalt и соавт. [61, 62], Kissmeyer-Nilssen [77], Metaxas и соавт. [93]).
Реагирование антигенов и антител системы LU имеет свои особенности. Так, антиген Lu b на эритроцитах лиц Lu(a +b + ) в отдельных случаях выявляют только с помощью метода адсорбции – элюции. Агглютинация, вызываемая ан-тителами системы Lutheran, нередко имеет смешанный характер: наряду с аг-глютинатами присутствует значительное количество свободных эритроцитов
(Callender, Race [16], Cutbush, Chanarin [31], Daniels [34], Issitt, Anstee [72]).
529
Количество антигенных участков Lu b на эритроцитах невелико: при фенотипе Lu(a −b + ) на 1 эритроците размещено 1640–4070 антигенных участков; при фено-типе Lu(a +b + ) – 850–1820 (Merry и соавт. [92]). Антигены LU выражены слабее у детей, чем у взрослых. Антиген Lu a обнаруживали у 12-недельных плодов, Lu b –
В 10-недельных (Race, Sanger [113], Toivanen, Hirvonen [142]). К 15 годам экспрес-
сия антигенов LU достигает уровня взрослых (Greenwalt и соавт. [62]).
Анти-Lu a
Как отмечено выше, первый образец антител анти-Lu a был получен от жен-щины, имевшей гемотрансфузии. В ее сыворотке, помимо анти-Lu a, содержа-лись антитела анти-с, анти-C W, анти-Kp c и анти-N. Через некоторое время после гемотрансфузии активность антител анти-Lu a постепенно снизилась. Попытки повысить их титр инъекциями небольших доз крови донора Lutheran не дали желаемого результата (Callender, Race [16]).
и выявлении антител анти-Lu a во время беременности или после гемотранс-
фузий сообщили Francis, Hatcher [53], Greendyke, Chorpenning [60], Greenwalt и
соавт. [61, 62], Inderbitzen, Windle [70]. Их часто обнаруживали одновременно с другими антителами, особенно с анти-Bg (HLA-антитела, реагирующие с эри-
троцитами) (Crawford [26]).
Gonzenbach и соавт. [58], Shaw и соавт. [125] описали анти-Lu a-антитела есте-ственного происхождения у лиц, не имевших беременностей и гемотрансфузий.
Антитела анти-Lu a в основном IgM, при этом в сыворотке могут присут-
ствовать фракции IgG и IgA (Gonzenbach и соавт. [58], Issitt, Anstee [72], Reid, Lomas-Francis [117], Shaw и соавт. [125]). Активные анти-Lu a-сыворотки, при-
годные для фенотипирования, встречаются редко.
Анти-Lu a-антитела вызывают прямую агглютинацию эритроцитов Lu(a + ) при комнатной температуре (20–22 оС). Некоторые сыворотки реагируют так-же при 37 оС в антиглобулиновой пробе, и лишь отдельные, содержащие только IgG, проявляют себя исключительно в непрямой пробе Кумбса (Francis, Hatcher [53], Issitt, Anstee [72], Mollison и соавт. [94]).
Анти-Lu b
Антитела анти-Lu b встречаются реже, чем анти-Lu b, однако многократно описа-ны в литературе и детально изучены (Boulton [11], Chattoraj и соавт. [22], Croucher
У соавт. [30], Dube, Zoes [43], Greenwalt и соавт. [61, 62], Kissmeyer-Nilssen [77], Metaxas и соавт. [93], Molthan, Crawford [95], Parsons и соавт. [106], Peters и соавт. [108], Scheffer, Tamaki [122]). Чаще всего они моноспецифические. В большин-стве случаев причиной их образования были беременности или гемотрансфузии. Антитела анти-Lu b естественного происхождения не описаны. Оптимальным ме-тодом их выявления является непрямая антиглобулиновая проба, хотя и описа-ны образцы, агглютинирующие эритроциты в прямой реакции при температуре
20–22 оС (Cutbush, Chanarin [31], Greenwalt и соавт. [62], Kissmeyer-Nilssen [77],
530
Metaxas и соавт. [93]). В большинстве случаев антитела анти-Lu b являлись сме-сью IgM и IgG, некоторые сыворотки содержали также фракцию IgA (Adkins [3], Dube, Zoes [43], Mollison и соавт. [94], Peters и соавт. [108]). Анти-Lu b чаще были представлены субклассом IgG1, однако встречались также IgG2 и IgG4 (Hardman, Beck [65], Herron и соавт. [69], Novotny и соавт. [102]).
Описаны 2 образца мышиных моноклональных антител анти-Lu b, которые не были идентичны аллогенным. В тестах адсорбции – элюции они частично реагировали с эритроцитами Lu(a +b −) и Lunull (Daniels [35], Inglis и соавт. [71], Judson и соавт. [75], Telen [135]).
Анти-Lu3
Всех индивидов с рецессивным типом Lunull удалось выявить по наличию в их крови антител к антигену с очень высокой частотой встречаемости. Эти антитела первоначально были обозначены как анти -Lu ab и позднее – анти -Lu3 (Bove и соавт. [12], Melonas, Noto [91]). Указанные антитела не являются про-стой смесью анти-Lu a и анти-Lu b и реагируют одинаково интенсивно с эритро-цитами Lu(a −b + ) и Lu(a +b −) и могут быть адсорбированы клетками любого из указанных фенотипов. Адсорбция антител эритроцитами Lu(a −b + ) полно-стью устраняла их способность агглютинировать эритртроциты Lu(a +b −), а адсорбция эритроцитами Lu(a +b −) устраняла их способность агглютиниро-вать эритроциты Lu(a −b + ) (Darnborough и соавт. [41], Myhre и соавт. [100]). Антиген Lu3 всегда присутствует на эритроцитах, если они экспрессируют какой -либо из антигенов системы Lutheran. Эритроциты лиц с другими ти-пами Lunull (доминантным и Х-связанным) не агглютинируются антителами анти-Lu3, однако способны их адсорбировать, что было показано с помощью адсорбции – элюции.
Имеются сообщения о получении мышиных моноклональных антител, спец-ифичность которых близка к анти-Lu3. Указанные антитела реагировали со все-ми образцами эритроцитов, за исключением Lunull (Parsons и соавт. [105], Telen [135], Zelinski и соавт. [154]).
Клиническое значение
Антитела системы Lutheran не считаются клинически значимыми. По дан-ным ряда авторов, ГБН, обусловленная антителами анти-Lu a и анти-Lu b, про-текала в легкой форме и не требовала лечения, не считая фототерапии. В то же время прямая антиглобулиновая проба с эритроцитами новорожденных была положительной, содержание билирубина повышено (Boulton [11], Dube, Zoes [43], Francis, Hatcher [53], Inderbitzen, Windle [70], Kissmeyer-Nilssen [77], Molthan, Crawford [95], Scheffer, Tamaki [122]). Одной из возможных причин легкого течения ГБН при несовместимости по факторам LU является их сла-бая выраженность на эритроцитах новорожденных. Существует и другое объ-яснение: значительная часть материнских антител адсорбируется на клетках
531
плаценты, которые содержат гликопротеины Lutheran, что в значительной мере смягчает воздействие антител на организм плода.
Антитела системы Lutheran не вызывали гемолитических посттрансфу-зионных реакций. Castillo, Leveque [20], Greenwalt, Sasaki [61], Mollison и со-авт. [94], Molthan, Crawford [95] описали единичные случаи замедленных пост-трансфузионных реакций с легким течением и умеренно выраженной желтухой. Эритроциты Lu(a + ) с радиоактивной меткой, будучи введенными больным, имеющим анти-Lu a-антитела, имели нормальную продолжительность жизни (Greendyke, Chorpenning [60]). Аналогичные исследования в отношении анти-Lu b-антител подтвердили, что лишь часть меченых эритроцитов выводится из сосудистого русла (Boulton [11], Cutbush, Mollison [32], Tilley и соавт. [138]).
Фенотип Lu null
Как и другие групповые системы эритроцитов, система Lutheran может быть представлена нулевым фенотипом. Фенотип Lunull, впервые описанный Crawford и соавт. [27] в 1961 г. как Lu(a −b −), возникает вследствие трех причин:
–– гомозиготность по рецессивному аллелю LU −;
–– наличие доминантного супрессорного гена In(Lu) независимого от LU; –– гомозиготность по Х-сцепленному супрессорному гену.
Истинным нулевым фенотипом является первый из указанных в табл. 8.3, поскольку только в этом случае отсутствие антигенов LU обусловлено соб-ственно геном LU, в 2 других случаях следовые количества вещества Lutheran на эритроцитах удается выявить специальными методами исследования.
| Таблица 8.3 | |||||
| Характеристика фенотипа Lu null | |||||
| Тип наследования | Вовлеченный ген | Вещество LU | Антиген AnWj | Антигены P1, i, | |
| (Anton) | CD44 | ||||
| Рецессивный | Lu | Отсутствует | Присутствует | Нормальные | |
| Доминантный | In(Lu) | Ослаблено | Отсутствует | Ослаблены | |
| Х-сцепленный | XS2 | Ослаблено | Присутствует | Нормальные | |
Фенотип Lunull преимущественно обусловлен доминирующим геном In(Lu). Так, при исследовании 50 семей, среди членов которых имелись лица Lunull, доминантный тип наследования супрессорного гена был доказан в 41 случае. В 9 других случаях причину фенотипа Lunull точно установить не удалось, хотя серологические данные (наличие следовых количеств групповых субстанций Lutheran) также указывали на наследование супрессорного гена (Rowe и соавт. [118], Shaw и соавт. [123]).
Несколько обширных исследований, проведенных в Англии Darnborough и со-авт. [41], Gibson [57], Rowe и соавт. [118], Shaw и соавт. [123], позволили устано-вить частоту фенотипа Lunull – 0,005–0,012 % (табл. 8.4). Среди негров Детройта (США) этот показатель соответствовал 0,027 % (Winkler, Hamilton [149]), у до-норов Хьюстона (США) – 0,02 % (Udden и соавт. [145]); у жителей Портленда
532
частота фенотипа Lunull – 0,12 % (Lukasavage [82]). В последнем случае данные могут быть не совсем точными, поскольку автор использовал сыворотку, содер-жащую антитела анти-AnWj к часто встречающемуся антигену Anton (Lu15), ко-торый на протяжении ряда лет считали частью системы Lutheran.
Broadberry и соавт. [14] нашли фенотип Lunull у китайцев.
| Таблица 8.4 | |||||
| Частота фенотипа Lu null в некоторых популяциях | |||||
| Жители городов | Количество | Выявлено лиц | Частота | Источник | |
| обследованных | Lunull | Lunull, % | |||
| Лондон, Англия | 250 000 | 79 | 0,03 | [123] | |
| Шеффилд, Англия | 18 069 | 1 | 0,01 | [41] | |
| Кембридж, Англия | 3 197 | 1 | 0,03 | [57] | |
| Южный Уэльс, Англия | 75 614 | 15 | 0,02 | [118] | |
| Хьюстон, США | 42 000 | 8 | 0,02 | [145] | |
| Портленд, США | 2 400 | 3 | 0,12 | [82] | |
| Детройт, США, негры | 7 314 | 2 | 0,03 | [149] | |
| Тайвань, китайцы | 1 922 | 1 | 0,05 | [14, 152] | |
Lu null рецессивного типа
Фенотип Lunull, сформировавшийся за счет рецессивного гена, впервые описан Darnborough и соавт. [41] у англичанки, миссис LB. Сыворотка ее крови содержала антитела, реагировавшие с эритроцитами всех обследованных лиц за исключением членов ее семьи (Crawford и соавт. [27]). Титрование сывороток анти-Lu b эритроци-тами детей миссис LB показало, что эти эритроциты содержат только 1, а не 2 дозы указанного антигена. Авторы пришли к выводу, что миссис LB гомозиготна по ре-цессивному аморфному гену Lu −, находящемуся под контролем локуса LU.
Позднее 7 индивидов с рецессивным типом Lu null были найдены в одной ка-надской и двух японских семьях (Brown и соавт. [15], Mallinson и соавт. [85], Myhre и соавт. [100]). В этих семьях родители были кровными родственниками. Авторы подтвердили рецессивный характер наследования молчащего гена Lu −.
В сыворотках крови 5 лиц Lunull присутствовали антитела, реагировавшие со всеми образцами эритроцитов, за исключением Lunull. Антитела получили обо-значение анти-Lu3.
В одном случае женщина Lunull (с предполагаемым генотипом Lu −/Lu −), имевшая анти-Lu3-антитела, состояла в браке с мужчиной Lu(a +b + ) (генотип Lu a / Lu b). Ее дети имели фенотип Lu(a −b + ) и Lu(a +b −) (генотип Lu −/Lu b и Lu a / Lu − соответственно). Таким образом, антигенный статус детей не мог служить источником ее аллоиммуни-зации антигеном Lu3, который представляет собой антиген Lu ab, а не Lu a + Lu b.
Обследование 3 упомянутых выше семей показало, что в браках Lunull × не-
Lunull не было детей Lunull. Это со всей очевидностью указывало на рецессивный характер наследования молчащего аллеля Lu −.
533
Обнаружение антител анти-Lu3 в сыворотке крови одной американской не-гритянки давало основания полагать, что она имела рецессивный тип Lunull, од-нако при обследовании ее семьи это доказать не удалось (Melonas, Noto [91]).
Дополнительные сведения в пользу существования молчащего аллеля Lu − были получены Brown и соавт. [15]. Авторы нашли семьи, в которых родители Lu(a +b + ) × Lu(a −b + ) имели детей с фенотипом Lu(a +b −). Вероятно, в этих случа-ях имела место гетерозиготность родителей Lu(a −b + ) по гену Lu −. В браках роди-телей Lu a / Lu b × Lu b / Lu − были дети Lu a / Lu −, что фенотипически проявлялось как Lu(a +b −).
На эритроцитах лиц с рецессивным типом Lunull все, без исключения, анти-гены системы Lutheran отсутствуют. Их не удавалось обнаружить методом ад-сорбции – элюции.
с одной японской семье пробанд Lu(a −b −), имевший антитела анти-Lu3, оказался гомозиготным по нонсенс-мутации С 733 А в экзоне 6 гена LU. Последняя преобразует кодон Cys 237 в стоп-кодон (Mallinson и соавт. [85]). Родители пробанда были гетерозиготными по указанной мутации.
Lu null доминантного типа
Обследование трех поколений семьи первого из выявленных пробандов Lunull показало, что этот признак находится под контролем гена, имеющего доминантный тип наследования (Crawford и соавт. [27]). Позднее появились другие аналогичные сообщения (Contreras, Tippett [25], Gibson [57], Rowe и соавт. [118], Shaw и соавт. [123], Stanbury, Francis [133], Taliano и соавт. [134], Wright, Moore [150]).
В отличие от лиц Lunull рецессивного типа, которых выявляли случайно в свя-зи с наличем у них антител, лиц Lunull доминантного типа обнаруживали при плановом фенотипировании доноров сыворотками анти-Lu a и анти-Lu b.
В обследованных семьях 52 пробанда Lunull имели 63 сибса Lu null и 61 сибса не Lunull (Gibson [57], Race, Sanger [113], Rowe и соавт. [118], Shaw и соавт. [123]). Статистический анализ результатов обследования детей у ро-дителей Lunull × не-Lunull показал, что соотношение частоты фенотипов рав-
но 1:1. Таким образом, имелись все основания полагать, что ген Lu null явля-ется кодоминантным.
Taliano и соавт. [134] обозначили супрессорный ген, приводящий к Lunull доминантного типа, буквами In(Lu). Авторы предположили, что должен су-ществовать его аллель in(Lu), не оказывающий супрессорного эффекта на антигены системы Lutheran. Однако последующее открытие супрессорно-го действия In(Lu) на антигены Р1 и i, не входящие в систему Lutheran, по-будило Race и Sanger [113] высказать сомнения относительно концепции Taliano и соавт.
Marsh и соавт. [89] предлагали переименовать In(Lu) в SYN-1 и SYN-1B, нарушающие нормальный биосинтез некоторых групповых антиге-нов, и SYN-1A, в присутствии которого биосинтез происходит нормально.
534
Эта номенклатура была признана неудовлетворительной, поскольку в ней подразумевалось, что ген In(Lu) модифицирует биосинтез на уровне субстанций-предшественников, в то время как механизм действия этого
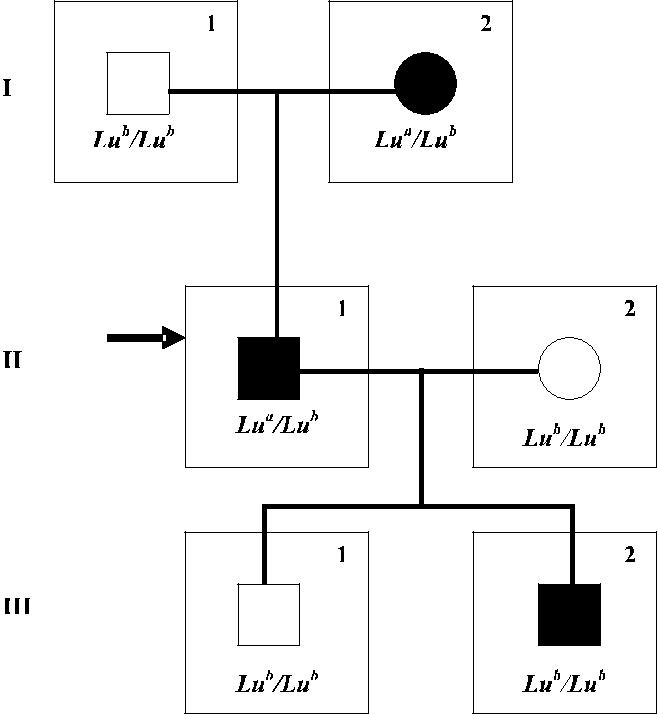
Рис. 8.2. Родословная семьи, где ген In(Lu) не являет-ся частью локуса LU [134]. Стрелкой указан пробанд, черными фигурами отмечены члены семьи с феноти-пом In(Lu). Указаны вероятные генотипы членов се-мьи по результатам обследования сыворотками анти-Lu a и анти-Lu b. Присутствие слабоэкспрессирован-ных антигенов показано методом адсорбции – элю-ции. II-1 унаследовал ген Lu a вместе с In(Lu) от мате-ри I-2; II-1 передал двум детям (III-1 и III-2) ген Lu b, одному ген In(Lu). Между генами LU и In(Lu) прои-зошла рекомбинация.
гена неизвестен (Shaw, Tippett [124]). По этой причине в настоящее время предпочитают использовать обозначения In(Lu) (для гена) и In(Lu) (для фе-нотипических проявлений).
Эритроциты лиц, имеющих ген In(Lu), не обладают истинным феноти-пом Lunull, поскольку способны адсорбировать антитела системы Lutheran (Moulds, Shah и соавт. [97], Stanbury, Francis [133], Telen и соавт. [136], Tippett [139]). Однако отрицательные результаты экспериментов с адсорбцией – элю-цией антител системы Lutheran нельзя расценивать как абсолютное доказа-тельство того, что обследуемый относится к группе Lunull рецессивного типа.
535
Некоторым исследователям не удавалось элюировать антитела Lutheran с эри-троцитов In(Lu) (Crawford и соавт. [27], Wright, Moore [150]).
то же время адсорбция – элюция антител анти-Lu a и анти-Lu b позволяют выявить истинный рецессивный тип Lunull у некоторых лиц In(Lu). Посемейные исследования выявили рекомбинацию генов LU и In(Lu) (Taliano et. al. [134]). На рис. 8.2 представлена родословная семьи, показывающая независимость су-прессорного гена In(Lu) от локуса LU. Исследования в других семьях позволи-ли установить рекомбинации In(Lu) и генов, контролирующих системы ABO, MNS, P1, Rh, Kell, Kidd, Cartrwrigh, Colton, Se и HLA (Rowe и соавт. [118], Shaw
и соавт. [123]). Статистический анализ подтвердил отсутствие коррелятивной связи гена In(Lu) с перечисленными локусами групп крови.
О выявлении каких-либо антител системы Lutheran в сыворотках крови лиц, имеющих фенотип In(Lu), ни разу не сообщалось. Вероятно, иммунная система таких индивидов не реагирует на антигенные детерминанты указан-ной системы как на чужеродные. Антитела не были найдены в сыворотках крови 12 женщин группы In(Lu), родивших детей с нормально выраженны-
ми антигенами Lu (Shaw и соавт. [123], Wright, Moore [150]).
Ген In(Lu) подавляет синтез антигенов Lutheran. Кроме того, на эритроцитах лиц In(Lu) снижена экспрессия ряда других антигенов, не относящихся к систе-ме Lutheran. Интересен тот факт, что у индивидов с рецессивным типом Lunull эти антигены выражены нормально.
Присутствие гена In(Lu) вызывает супрессию антигена Р1, хотя этот эф-фект менее выражен, чем в отношении факторов Lutheran. Crawford и со-авт. [27], Gibson [57], Shaw и соавт. [123] привели данные обследования 236 человек, членов 41 семьи, среди которых были индивиды In(Lu) (табл. 8.5). Распределение антигенов Р1 и Р2 среди носителей фенотипа In(Lu) существен-но отличалось от распределения этих антигенов у лиц с фенотипом не-In(Lu).
36 лиц Lunull антиген Р1 был выражен нормально, что могло быть обусловле-но присутствием высокоактивного аллеля Р1 +, или гомозиготностью по нему,
или обеими причинами одновременно. У лиц с рецессивным типом Lunull вы-раженность антигена Р1 также не отличалась от нормы. В 3 семьях у родите-
лей Р2 Lunull × Р2Lu(a −b + ) были дети Р1Lu(a −b + ), что подтверждает ингибиру-ющий эффект гена In(Lu) на ген Р 1 (рис. 8.3).
Таблица 8.5
Угнетение экспрессии антигена Р1 геном In(Lu) на примере 41 семьи
| Фенотип | Количество членов семей, имеющих фенотип | |||
| Р1 | Р2 | |||
| Lunull | 36 | (95)* | 84 (25) | |
| не-Lunull | 86 | (91) | 30 (25) | |
17. в скобках количество ожидаемых лиц соответствующего фенотипа.
536
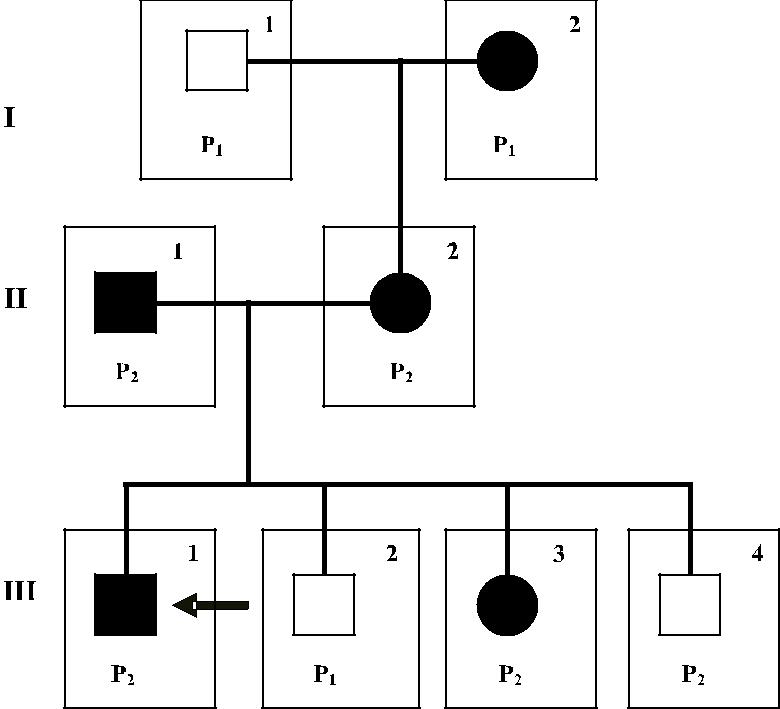
Рис. 8.3. Наследование фенотипа In(Lu) в семье жителей о. Сардиния, Италия. Ген In(Lu) (черные фигуры) и фенотипы членов семьи по системе Р1 [25]. Члены семьи II-1 и III-4 имеют фенотип Р2 в отсутствие гена In(Lu),
в то время как I-2 имеет фенотип Р1 и обладает геном In(Lu), I-2, вероятно, гомозиготна по гену Р1+, поэтому экспрессирует Р1 в присутствие гена In(Lu).
К антигенам, экспрессия которых снижена в присутствии гена In(Lu), отно-сят фактор i. Антиген i хорошо выражен на эритроцитах новорожденных, одна-ко его экспрессия резко снижена у детей In(Lu) (Crawford и соавт. [29]).
У взрослых людей, имевших фенотип Lunull, антиген I был выражен нормаль-но: какого-либо супрессорного влияния на ген I ген In(Lu) не оказывал.
На эритроцитах In(Lu) слабо экспрессированы антигенные детерминан-ты CD44. Этот кластер дифференцировки несет антигены In a и In b системы Indian, которые, помимо эритроцитов, экспрессированы на других клетках. Антигенные детерминанты In b у лиц In(Lu) ослаблены. У лиц с рецессивным типом Lunull антигенные детерминанты CD44, в том числе антиген In b, выраже-ны нормально (Spring и соавт. [132], Telen, Green [137]).
По данным Poole, Giles [109], Marsh и соавт. [88], со структурой CD44 ассоци-ирован часто встречающийся антиген AnWj (Anton). Он слабо выражен на эри-троцитах In(Lu), в связи с чем сначала был причислен к системе Lutheran и по-лучил обозначение Lu15. Однако далее выяснилось, что антиген AnWj нормаль-но выражен на эритроцитах лиц с рецессивным типом Lunull. По этой причине ан-тиген AnWj был исключен из описываемой системы, а обозначение Lu15 – из но-менклатуры групп крови и его более не используют (Poole и соавт. [110]).
537
Ген In(Lu) угнетает также экспрессию антигенов системы Knops: Kn a, McC a, Sl a и антигенов Yk a, Cs a коллекции 205 Cost (Daniels и соавт. [40]). Известно, что указанные антигенные детерминанты являются рецепторами компонентов С3 / С4 системы комплемента, CR1 (CD35), однако In(Lu) не влияет на экспрес-сию CR1 (Moulds, Shah [97]).
Ингибирующий эффект In(Lu) установлен также в отношении антигена MER2 системы RAPH (Daniels [36]).
Интересный феномен, связанный с фенотипом по системе Lutheran, обна-ружен в экспериментах с лошадиным антилимфоцитарным иммуноглобули-ном, который применяют в трансплантологии для профилактики кризов от-торжения . Оказалось, что он значительно слабее реагирует с эритроцитами In(Lu) по сравнению с любыми другими, включая Lunull (Anderson и соавт. [4], Postoway, Garratty [112]).
Слабая агглютинация эритроцитов In(Lu) отмечена также с конканавали-ном А – растительным лектином, агглютинирующим эритроциты человека. Указанный лектин реагирует главным образом с протеином полосы 3 (band 3 protein), транспортером анионов. В связи с этим высказано предположение, что гликозилирование анионных транспортеров на клетках In(Lu) отличается от нормального (Udden и соавт. [145]).
Вместе с тем на эритроцитах имеется уникальная структура – CDw75, вы-раженность которой усиливается в присутствии гена In(Lu). Этот лиганд, по-мимо эритроцитов , содержится в лимфоцитах и распознается моноклональ-ными антителами. Биохимическая природа и физиологические функции эпи-топа CDw75 до конца не выяснены, известно лишь, что для его экспрессии необходимо присутствие N-гликанов с остатками α2,6-сиаловых кислот (Bast
В соавт. [8], Guy и соавт. [63, 64]). Эпитоп CDw75 выражен нормально на эритроцитах лиц Lunull рецессивного типа, но отсутствует у индивидов Lunull Х-ассоциированного (Tippett, Guy [141]). На эритроцитах пуповинной крови CDw75 отсутствует.
Лица, имеющие фенотип In(Lu), соматически здоровы и не обнаруживают каких-либо признаков анемии (снижение уровня гемоглобина, ретикулоцитоз), хотя у членов трех семей, наследовавших In(Lu), имелся акантоцитоз (Ballas и соавт. [6], Udden и соавт. [145]). Выживание аутологичных эритроцитов In(Lu) in vivo было нормальным (Ballas и соавт. [6]), осмотическая резистентность эри-троцитов соответствовала норме. Инкубация эритроцитов In(Lu) в плазме в те-чение 24 ч при 37 оС повышала их осмотическую резистентность. При этом от-мечали утрату значительной части ионов калия и относительное повышение со-держания натрия; в целом концентрация катионов снижалась. Эти изменения позволяют объяснить повышение осмотической резистентности (Udden и соавт. [145]). Выраженный гемолиз эритроцитов In(Lu) наблюдали при хранении их в растворе Алсевера (глюкозидцитратный консервант для эрмассы) при 4 оС, раз-рушение клеток уменьшалось после добавлении глюкозы или АТФ.
538
По мнению Tippett [140], ингибирующий эффект гена In(Lu), оказываемый одновременно на несколько различных локусов, контролирующих групповые антигены эритроцитов, является уникальным. Моделей, которые могли бы объ-яснить этот феномен, пока не предложено.
Marcus и соавт. [86] высказали предположение, что Lu null доминантного типа может быть результатом действия гликозилтрансферазы, присоединяющей до-полнительные сахара к структуре-предшественнику.
Udden и соавт. [145] полагают, что частичное редуцирование рецепторов для конканавалина А на эритроцитах In(Lu) обусловлено необычным гликозилировани-ем углеводных последовательностей, общих для гликопротеинов и гликолипидов.
Shaw и Tippett [124] считают, что в присутствии In(Lu) могут возникать кон-формационные изменения некоторых мембранных структур, затрудняющие их связывание с антителами.
По мнению Daniels и соавт. [40], ген In(Lu) кодирует ДНК-связывающий про-теин или какой-либо из факторов транскрипции, ингибирующий функции ге-нов, ответственных за синтез мембранных структур.
Lu null Х-ассоциированный
с 1986 г. Norman и соавт. [101] обследовали большую австралийскую семью (рис. 8.4), пятеро членов которой имели фенотип Lunull с характеристиками как ре-цессивного, так и доминантного типа. Эритроциты типировались как Lu(a −b −), слабо адсорбировали анти-Lu b-антитела, содержали антиген AnWj; экспрессия антигена i была повышена. Экспрессия антигена Р1 была слабой, хотя это могло быть обусловлено присутствием слабого гена Р1 + в данной семье.
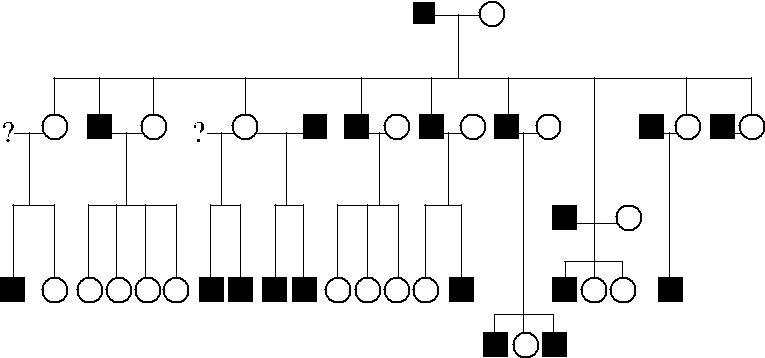
Рис. 8.4. Х-сцепленное наследование Lunull [101]. Темными фигурами обозначены лица Lu(a−b−), светлыми – Lu(a−b+). Все лица Lunull – мужчины (XS2 / Y), унаследовавшие ген XS2 от своих матерей, являющихся гетерозиготами XS2 / XS1.
Особенностью обнаруженного варианта Lunull являлось наследование иницииру-ющего гена. Возникновение фенотипа Lunull в указанной семье не могло быть обу-словлено геном In(Lu), поскольку родители троих лиц Lunull имели группу Lu(a −b + ). Возможную гомозиготность по рецессивному гену Lu также исключили, поскольку
539
и этом случае ген Lu должен был иметься одновременно у 5 различных неродствен-ных лиц, что представляется маловероятным. Характер наследования гена указы-
вал на его рецессивный тип, ассоциированный с Х-хромосомой. Все лица Lunull были мужчинами, среди представителей следующего поколения не было лиц указанного
фенотипа (см. рис. 8.4). Регуляторный локус был маркирован как XS, обычный часто встречающийся аллель – XS1, а редкий ингибиторный, вызывающий супрессию ге-нов LU, – XS2. В данной семье мужчины с фенотипом Lunull были гемизиготными по ингибиторному аллелю (XS2 / Y), женщины – гетерозиготными (XS1 / XS2).
Williamson и соавт. [148] привели случай аутоиммунной тромбоцитопении у мужчины, временно утратившего антигены Kell и имевшего антитела анти-Ku (KEL5). Его эритроциты нормально экспрессировали антигены Lu a, Lu b и антиген LW a системы LW. Через год экспрессия антигенов Kell нормализовалась, анти-Ku-антитела исчезли, однако имела место утрата антигенов Lutheran, а сыворотка крови содержала антитела анти-Lu3. Экспрессия антигена LW a резко снизилась.
Poole и соавт. [111] наблюдали еще одого больного группы Lu(a −b + ) с ауто-иммунной тромбоцитопенической пурпурой. В течение заболевания его фено-тип сменился на Lu(a −b −), экспрессия антигенов AnWj и LW оставалась нор-мальной. Сыворотка крови содержала анти-Lu-подобные антитела.
Другие антигены LU
Помимо антигенов Lu a, Lu b и Lu3 в систему Lutheran входят 16 других анти-генов: 12 часто встречающихся, 2 редко встречающихся и 2 с частотой 50–80 % (см. табл. 8.1). Шесть из них являются продуктами аллельных генов и образуют антитетичные пары: Lu6 и Lu9, Lu8 и Lu14, Au a и Au b. Антигены Lu4, Lu5, Lu7, Lu12, Lu13, Lu20 и Lu21 отсутствуют на эритроцитах Lunull.
Антигены Lutheran локализуются в основном на гликопротеине Lu, многие слабо экспрессированы на эритроцитах новорожденных, не имеют рекомбина-ций и кроссинговера (Daniels и соавт. [33, 38], Levene и соавт. [80], Parsons и со-авт. [104], Reid и соавт. [116]).
Локализация детерминант Lu11, Lu16 и Lu17 на гликопротеине Lu не доказа-на, поэтому по отношению к ним используют обозначение «пара-Lutheran».
Антигены Lu11, Lu16 и Lu17 отсутствуют на эритроцитах Lunull и In(Lu) рецессивного типа . Антиген Lu17 присутствует на эритроцитах Lunull Х-ассоциированного типа.
Большинство антител Lutheran не вызывает гемолитических осложнений и ГБН.
Lu4
Bove и соавт. [12] нашли единственный образец антител анти-Lu4. Двое сибсов белой женщины группы Lu: −4, у которой были выявлены антитела, также имели фенотип Lu: −4. Все лица, кровь которых исследована с использованием указанной сыворотки (2700 человек, преимущественно доноров), имели фенотип Lu4 +.
Антиген Lu4 размещается на втором IgSF-домене гликопротеина Lu (см. рис. 8.1).
540
Lu5
11. выявлении антител к антигенам Lu5, Lu6 и Lu7 сообщил Marsh [87] на одном из рабочих совещаний Американской ассоциации банков крови.
Bowen и соавт. [13], Crawford [26], Marsh [87], Smart и соавт. [130] иденти-
фицировали более 10 образцов антител анти-Lu5. Эти антитела присутствова-ли как у европеоидов, так и у негроидов. При обследовании 423 неродственных лиц, преимущественно доноров европейцев, не было найдено ни одного с фе-нотипом Lu: −5 (Marsh [87]). Подобно антигенам Lu a и Lu b, антигенные участки Lu5 располагаются в N-терминальном домене IgSF гликопротеина Lu (Parsons и
соавт. [104]) (см. рис. 8.1).
Lu6 и Lu9
Антигены Lu6 и Lu9 имеют высокую и низкую частоту соответственно, про-являют себя в серологических реакциях как продукты аллельных генов.
Антитела анти-Lu6 обнаружил Marsh [87]. Позднее появились другие сооб-щения о выявлении антител указанной специфичности (Dybkjaer и соавт. [47], Ellis и соавт. [52], Gibson и соавт. [56], Herron и соавт. [69], Issitt и соавт. [73], Wrobel и соавт. [151]).
Антиген Lu6 отсутствует на эритроцитах Lunull всех трех указанных выше ти-пов (Marsh [87], Norman и соавт. [101]).
При исследовании выживаемости несовместимых эритроцитов, введенных сен-сибилизированным реципиентам, установлено, что антитела анти-Lu6 клиниче-ского значения не имеют (Ellis и соавт. [52], Gibson и соавт. [56]). Аналогичные ис-следования, проведенные у пожилой женщины, имевшей антитела анти-Lu6 IgG1-субкласса, напротив, свидетельствовали об их способность вызвать разрушение эритроцитов in vivo. Этой больной были успешно перелиты эритроциты Lunull.
По наблюдениям Herron и соавт. [69], эритроциты ребенка, родившегося у женщины, которая имела высокоактивные антитела анти-Lu6, давали отрица-тельную прямую пробу Кумбса; в сыворотке крови ребенка указанные антите-ла отсутствовали. Очевидно, антитела анти-Lu6 оказались не способны преодо-леть плацентарный барьер.
Molthan и соавт. [96] выявили антитела анти-Lu9 у родильницы одновре-менно с антителами анти-Lu a . Антитела обнаружили с помощью прямой пробы Кумбса с эритроцитами всех трех ее новорожденных, однако каких-либо кли-нических проявлений ГБН не наблюдали. Отец детей имел фенотип Lu:1,2,9. Исследование семьи показало, что антиген Lu9 контролируется локусом LU, хотя последний не являлся аллелем Lu a и Lu b. Среди 521 обследованного этой сывороткой 1,7 % имели антиген Lu9.
Еще один образец антител анти-Lu9 был найден у женщины, получившей множественные гемотрансфузии (Champagne и соавт. [21]).
Эритроциты выявленного Marsh [87] индивида Lu: −6, его сибсов, а так-же эритроциты другого из найденных лиц Lu: −6 реагировали с антителами
541
анти-Lu9. Это послужило доказательством того, что антигены Lu6 и Lu9 анти-тетичны и являются продуктами аллельных генов Lu 6 и Lu 9.
Эритроциты Lu null всех трех типов были Lu: −6, −9. Описана семья, в кото-рой один индивид Lu: −6 (вероятно Lu 6 / Lu 6) имел слабый антиген Lu9, а эри-троциты других его родственников (Lu 6 / Lu 9) интенсивно реагировали с анти-телами анти-Lu9. Антиген Lu b у всех членов данной семьи был выражен нор-мально. Угнетение экспрессии антигена Lu9 в данной семье осталось без объ-яснения (Daniels [34]).
Полагают, что эпитопы Lu9 находятся на четвертом IgSF-домене гликопроте-ина Lutheran (Parsons и соавт. [104]) (см. рис. 8.1).
Lu7
Антитела анти-Lu7 субкласса IgG3 были найдены Marsh [87] у женщины Lu: −1,2, −7. Прямая проба Кумбса с эритроцитами родившегося у нее ребенка была отрицательная. Среди 285 обследованных доноров европейцев не оказалось ни одно-го Lu: −7 (Marsh [87]). Так же как и Lu9, антигенные эпитопы Lu7 находятся на чет-вертом IgSF-домене гликопротеина Lutheran (Parsons и соавт. [104]) (см. рис. 8.1).
Lu8 и Lu14
Антитела анти-Lu8 обнаружены MacIllroy и соавт. [83] в 1972 г. Позднее были описаны другие образцы антител этой специфичности (Kobuszewski и соавт. [78], Shirey и соавт. [126], Watt и соавт. [146]). Один из них показал положительные ре-акции в пробе с монослоем моноцитов и, очевидно, явился причиной умеренно выраженной посттрансфузионной реакции (Kobuszewski и соавт. [78]).
Антигенные эпитопы Lu8 находятся на втором IgSF-домене гликопротеина Lutheran (Parsons и соавт. [104]) (см. рис. 8.1).
№1977 г. Judd и соавт. [74] описали антитела у женщины, получившей гемо-трансфузии и сеансы гемодиализа. Антитела реагировали с эритроцитами 14 из 580 доноров (2,4 %). Их обозначили анти-Lu14. Они реагировали с эритроцита-ми трех неродственных лиц Lu: −8, что дало основание считать антигены Lu8 и Lu14 антитетичными. Антиген Lu14 чаще присутствовал у лиц Lu(a −b + ), чем
29. лиц Lu(a +b + ), что дало основание предполагать аллельные взаимоотноше-ния контролирующих генов. Моноклональные антитела анти-Lu b реагировали более интенсивно с эритроцитами Lu:14 по сравнению с эритроцитами Lu: −14 (Zelinski и соавт. [153]).
Cantrell и соавт. [19], Marsh и соавт. [90], Crawford [26] выявили много дру-
гих образцов анти-Lu14-антител. В одном случае антитела анти-Lu14 класса IgG имели естественное происхождение.
Частота антигена Lu14 среди 610 датских и 600 английских доноров соста-вила 1,5 и 1,8 % соответственно.
542
Lu12
Первый образец антител анти-Lu12 был выявлен Sinclair и соавт. [128] у жен-щины польско-украинского происхождения. Ее эритроциты были Lu(a −b + w), антиген Lu b был слабо выражен. Эритроциты ее отца содержали слабый ан-тиген Lu12, ее сестра имела фенотип Lu(a −b + w) со слабо выраженным Lu b. Другие антигены Lutheran на эритроцитах женщины были выражены слабо. При обследование семьи выявлена рекомбинация генов, контролирующих анти-ген Lu12 и выделительство групповых субстанций АВН. Вероятность того, что синтез антигена Lu12 находится под контролем гена LU, составила 9 : 1.
Эритроциты всех 1050 канадских доноров, исследованные с помощью сыво-ротки анти-Lu12, дали положительную реакцию. В одном случае реакция была слабо выражена: донор имел фенотип Lu(a −b + w).
Второй образец антител анти-Lu12 был найден у женщины белой расы с фе-нотипом Lu: −12. Двое ее сибсов также имели группу Lu: −12 (Shirey и соавт. [127]). В экспериментах по выживаемости эритроцитов in vivo указанные анти-тела вызывали ускоренное разрушение эритроцитов Lu12.
Локализация антигенных эпитопов Lu12 на гликопротеине Lutheran точно не установлена. Результаты иммунопреципитации специфическими антителами по-зволили предположить, что участок Lu12, вероятно, расположен вблизи Lu b, на первом IgSF-домене гликопротеина Lutheran (Parsons и соавт. [104]) (см. рис. 8.1).
Lu13
Сообщение о выявлении первого образца антител анти-Lu13 (антител Hughes) не было опубликовано. Второй образец антител этой специфичности был выявлен у финской женщины, однако исследовать ее эритроциты с антите-лами Hughes не удалось (Sistonen и соавт. [129]). В этой финской семье, помимо пропозиты, трое сибсов имели фенотип Lu: −13 (Marsh и соавт. [88]).
Установлено (Parsons и соавт. [104]), что эпитопы Lu13 находятся на пятом IgSF-домене гликопротеина Lutheran (см. рис. 8.1).
Au a и Au b
Антигены Auberger (Оберже*) – Au a (LU18) и Au b (LU19) – представляют четвертую пару антитетичных антигенов системы Lutheran. В течение мно-гих лет антиген Au a рассматривали как фактор, представляющий самостоя-тельную групповую систему независимую от локуса LU. Основанием для это-го служило описание семьи, в которой была обнаружена рекомбинация ге-нов Au a и Lu a (Salmon и соавт. [120]). При повторном обследовании указанной семьи сыворотками анти-Au a и анти-Au b выявлена неточность первоначаль-ного заключения. Напротив, полученные данные указывали на связь антиге-нов Auberger и Lutheran (Daniels и соавт. [39]). Синтез указанных антигенов
79. В английской фонетике правильным считается произношение Обэджи, но не Аубергер (Issitt, Anstee [72]), в русской фонетике – Оберже (П.Н. Косяков [2], М.А. Умнова [1]).
543
контролировал один и тот же ген (Zelinski и соавт. [153]). Эритроциты лиц Lunull имеют фенотип Au(a −b −) (Crawford и соавт. [28], Frandson и соавт. [54], Norman и соавт. [101]).
Первый образец антител анти-Au a был идентифицирован в 1961 г. Salmon и соавт. [121]. Миссис Auberger получала многократные гемотрансфузии, в сыво-ротке ее крови содержались также антитела анти-E, анти-K, анти-Fy b и HLA.
Drachmann и соавт. [42], Race и Sanger [113] сообщили о выявлении двух об-разцов анти-Au a-антител, при этом обе сыворотки содержали другие антиэри-троцитарные антитела.
Антитела анти-Au b, открывающие антиген Au b, антитетичный Au a, были описаны в 1989 г. Frandson и соавт. [54], сыворотка содержала также анти-Lu a-антитела. Вскоре были найдены 3 другие сыворотки анти-Au b, во всех сы-воротках также содержались антитела анти-Lu a (Moulds и соавт. [98]).
Антиген Au a имеет частоту 80–90 %, Au b – 50 % среди европеоидов, 68 % среди негроидов (Frandson и соавт. [54]). Частота генов и фенотипов Auberger приведена в табл. 8.6.
| Таблица 8.6 | |||||||||
Дата: 2019-02-24, просмотров: 475.